第七单元常见的酸和碱2022-2023学年九年级化学鲁教版下册随堂练习(有答案)
文档属性
| 名称 | 第七单元常见的酸和碱2022-2023学年九年级化学鲁教版下册随堂练习(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 122.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-15 15:39:34 | ||
图片预览



文档简介
第七单元常见的酸和碱
一、单选题
1.下列常见的三种溶液:①澄清石灰水,②食盐水,③食醋,pH大小关系是( )
A.②>①>③ B.③>②>① C.①>②>③ D.③>①>②
2.下列数据是人体内一些液体的正常pH范围,其中酸性最强的是
A.尿液4.7-8.4 B.唾液6.6-7.1 C.血浆7.35-7.45 D.胃液0.9-1.5
3.一些食物的近似pH如表所示,下列说法正确的是
食物 苹果汁 西瓜汁 牛奶 鸡蛋清
pH 2.9 5.8 6.4 7.6
A.牛奶放置一段时间后变酸,pH变大
B.西瓜汁比苹果汁酸性强
C.鸡蛋清和牛奶都显碱性
D.胃酸过多的人应该少饮苹果汁
4.下列宏观事实的微观解释错误的是
A.墙内开花墙外香——分子是不断运动的
B.6000升氧气在加压的情况下可装入容积为40升的钢瓶中——分子体积变小
C.硫酸、盐酸有一些相似的性质原因——不同的酸溶液中都含有氢离子
D.一氧化碳能燃烧二氧化碳不能燃烧——分子构成不同
5.下列关于物质用途的叙述错误的是
A.稀硫酸可用于除铁锈
B.氢氧化钙用于改良酸性土壤
C.氧气可用作燃料
D.明矾用于处理水中微小悬浮物
6.下列关于氢氧化钠的说法正确的是
A.实验室称量氢氧化钠时可以将氢氧化钠放在纸上称量
B.氢氧化钠易潮解,要密封保存
C.不小心将浓硫酸沾到皮肤上,应立即用氢氧化钠进行中和,然后用大量的水冲洗
D.溶于水放出大量热的白色固体一定是氢氧化钠
7.下列物质不能与稀硫酸发生反应的是
A.CuO B.Ag C.BaCl2 D.Mg(OH)2
8.分析和推理是化学学习常用的方法,以下推理正确的是
A.厨房洗涤剂对油污有乳化作用,则汽油除油污利用的也是乳化作用
B.化合物是由不同种元素组成的纯净物,则只含一种元素的物质一定不是化合物
C.溶液具有均一性和稳定性,则均一性和稳定性的液体一定是溶液
D.活泼金属与酸反应能产生气体,则能与酸反应产生气体的一定是活泼金属
9.下列有关氢氧化钠的说法,错误的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等
10.证据推理是化学学科核心素养的重要内容,下列推理正确的是
A.酸能使紫色石蕊溶液变色,所以酸也能使无色酚酞溶液变色
B.化合物由不同种元素组成,所以由不同种元素组成的纯净物一定是化合物
C.中和反应是有盐和水生成的反应,所以有盐和水生成的反应一定是中和反应
D.燃烧都伴随有发光、放热现象,所以有发光、放热现象的变化一定是燃烧
11.某化学小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是
A.该实验是将氢氧化钠溶液滴入稀盐酸中
B.a点所示溶液中,溶质只有NaCl
C.b点表示稀盐酸和氢氧化钠溶液恰好完全反应
D.向点c所示溶液中滴加紫色石蕊溶液,溶液变蓝色
二、简答题
12.如图展示了家庭中常见的洗涤用品及其主要成分。
洗涤用品 去污粉 洁厕灵 炉具清洁剂
实物图
主要成分 小苏打 盐酸 烧碱
(1)洁厕灵与去污粉混合后会发生反应,现象是_____。
(2)炉具清洁剂与洁厕灵不能混合使用,其原因是_____(用化学方程式表示)。
13.用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。
(1)熟石灰与盐酸反应的化学方程式为?
(2)当加入熟石灰mg时,溶液中的溶质为?
(3)若改用ng氢氧化钠与相同量盐酸反应,所得溶液的pH大小?
14.有五瓶失去标签的无色溶液分别是稀盐酸、稀硫酸、氢氧化钠溶液、澄清的石灰水、氯化钠溶液,如何将它们一一鉴别出来______?
三、推断题
15.A~H是初中化学常见的物质,其相互转化关系如图所示,其中A是人体胃液中帮助消化的物质, B常用于改良酸性土壤。回答下列问题:
(1)物质B的化学式为______________。
(2)物质C反应生成物质E和F的化学方程式为______________ ,其反应基本类型属于______________。
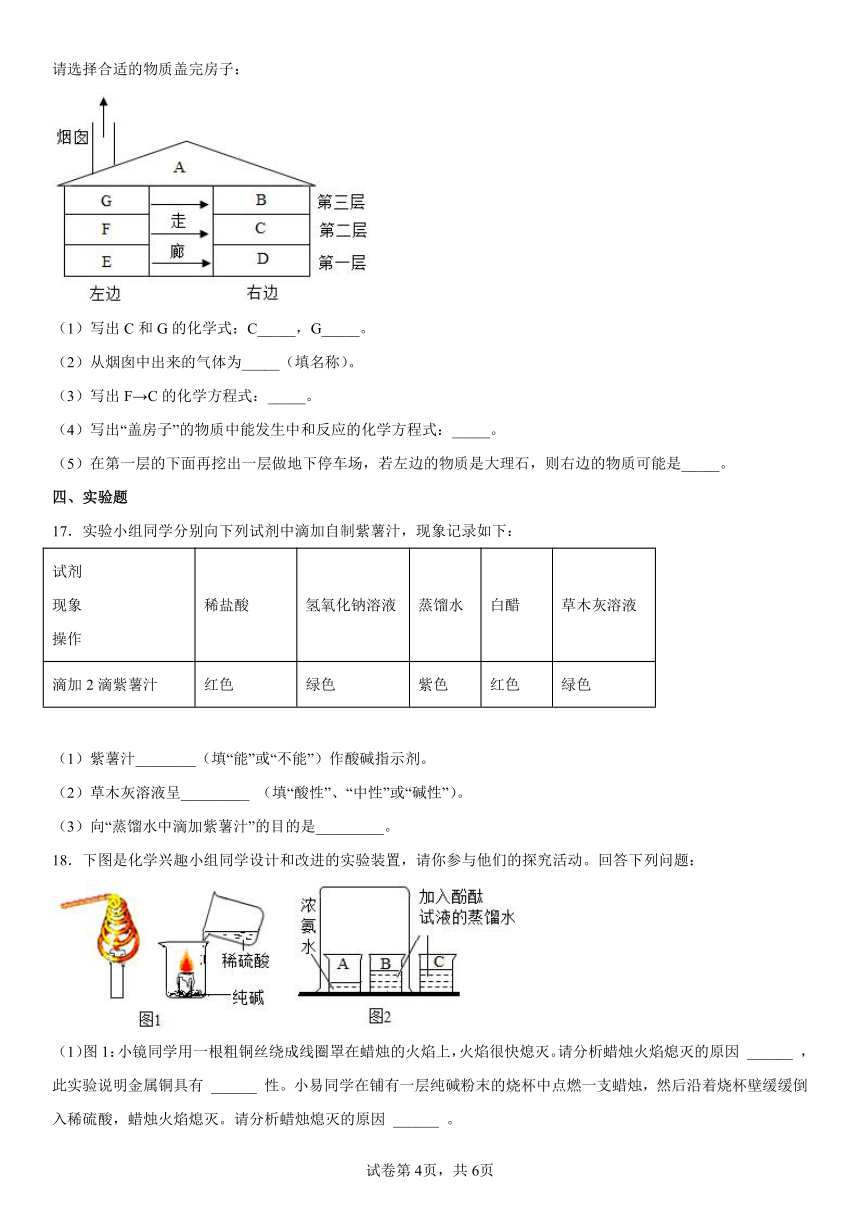
16.你玩过“盖房子”的游戏吗?如图所示,A、B、C、D、E是初中化学常见的不同类别的物质,其中B的溶液呈蓝色,G是汽车用铅酸蓄电池中的酸,D的固体常用于人工降雨,游戏规则是根据“上下相邻物质间均可发生化学,且左边上下相邻物质间反应均有气体产生,左边物质能转化为右边物质”来堆砌物质。
请选择合适的物质盖完房子:
(1)写出C和G的化学式:C_____,G_____。
(2)从烟囱中出来的气体为_____(填名称)。
(3)写出F→C的化学方程式:_____。
(4)写出“盖房子”的物质中能发生中和反应的化学方程式:_____。
(5)在第一层的下面再挖出一层做地下停车场,若左边的物质是大理石,则右边的物质可能是_____。
四、实验题
17.实验小组同学分别向下列试剂中滴加自制紫薯汁,现象记录如下:
试剂 现象 操作 稀盐酸 氢氧化钠溶液 蒸馏水 白醋 草木灰溶液
滴加2滴紫薯汁 红色 绿色 紫色 红色 绿色
(1)紫薯汁________(填“能”或“不能”)作酸碱指示剂。
(2)草木灰溶液呈_________ (填“酸性”、“中性”或“碱性”)。
(3)向“蒸馏水中滴加紫薯汁”的目的是_________。
18.下图是化学兴趣小组同学设计和改进的实验装置,请你参与他们的探究活动。回答下列问题:
(1)图1:小镜同学用一根粗铜丝绕成线圈罩在蜡烛的火焰上,火焰很快熄灭。请分析蜡烛火焰熄灭的原因 ______ ,此实验说明金属铜具有 ______ 性。小易同学在铺有一层纯碱粉末的烧杯中点燃一支蜡烛,然后沿着烧杯壁缓缓倒入稀硫酸,蜡烛火焰熄灭。请分析蜡烛熄灭的原因 ______ 。
(2)图2:小含同学在烧杯中加入浓氨水;在烧杯、中都加入 蒸馏水,并分别滴加3滴酚酞试液于蒸馏水中,得到无色溶液。用一只大烧杯把、两烧杯罩在一起,几分钟后,溶液颜色变成红色的烧杯是 ______ (填“”“”或“”),请你用分子的知识解释烧杯中溶液变红的原因 ______ 。
19.Y形管因形似字母Y而得名,其特殊的结构为许多化学实验的进行创造了条件。如图均为用用 Y 形管或 Y 形导管完成的实验,请回答以下问题:
(1)图1中, Y 形导管平放于桌面,实验中可观察到的现象_____,用化学方程式解释结论:_____。
(2)图2中,若把 Y 形导管固定在铁架台上,a 管位于上方, b 管位于下方,两石蕊试纸均湿润,可观察到 b 管中试纸变色比 a 管明显,原因是_____。
五、计算题
20.取100g一定质量分数的Ba(OH)2溶液于烧杯中,逐渐加入质量分数为20%的H2SO4溶液.实验过程中,溶液的pH与加入H2SO4溶液的质量关系如图所示。请计算Ba(OH)2溶液中溶质的质量分数。( 反应的方程式为:Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O)
21.取73g稀盐酸加入锥形瓶中,再逐滴滴加溶质质量分数为10%的NaOH溶液,反应过程中溶液的酸碱度变化如图所示。求该盐酸中溶质的质量分数。
22.某氢氧化钙粉末中含有碳酸钙杂质。现取一定质量的样品于锥形瓶中并加水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示。
(1)生成二氧化碳的质量是______。
(2)加入稀盐酸后所得溶液中含有的溶质是______(填化学式)。
(3)计算所用稀盐酸的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.B
5.C
6.B
7.B
8.B
9.C
10.B
11.B
12. 产生大量气泡 HCl+NaOH═NaCl+H2O
13.(1)Ca(OH)2+2HCl═CaCl2+2H2O
(2)CaCl2和HCl
(3)pH<7
14.用五支洁净试管,分别取五种溶液少许,再分别滴入几滴紫色石蕊试液.仍为紫色的是新化钠溶液,使紫色石蕊试液变为红色的是稀盐酸和稀硫酸,使紫色石蕊试液变为蓝色的是氢氧化钠溶液和石灰水.
@另取两支洁净试管,分别取两种酸溶液少许,再分别滴入少量氯化钡溶液,产生白色沉淀的是稀硫酸,无沉淀产生的是稀盐酸.
@再另取两支洁净试管,分别取两种碱溶液少许,分别通入少量二氧化碳气体,出现浑浊的是石灰水,无现象的是氢氧化钠溶液.
15. Ca(OH)2 分解反应
16. NaOH H2SO4 二氧化碳
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 2NaOH+H2SO4=Na2SO4+2H2O 水或氧化钙
17. 能 碱性 空白对照实验
18. 铜丝具有导热性,能将蜡烛燃烧产生的热量传导出去,使得蜡烛周围的温度低于蜡烛的着火点,致使蜡烛的火焰熄灭(合理即可) 导热 烧杯中的纯碱与稀硫酸反应产生大量的二氧化碳,二氧化碳不燃烧也不支持燃烧,使蜡烛熄灭(合理即可) 浓氨水具有挥发性,氨分子运动到烧杯中,溶于水得到氨水,氨水呈碱性,遇酚酞试液,会使溶液变为红色(合理即可)
19. 湿润的紫色石蕊试纸变红色,干燥的紫色石蕊试纸无明显变化 H2O+CO2=H2CO3 二氧化碳的密度比空气大,主要从b管中通过
20.6.48%
21.5%
22.(1)2.2;(2)、;(3)18.25%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列常见的三种溶液:①澄清石灰水,②食盐水,③食醋,pH大小关系是( )
A.②>①>③ B.③>②>① C.①>②>③ D.③>①>②
2.下列数据是人体内一些液体的正常pH范围,其中酸性最强的是
A.尿液4.7-8.4 B.唾液6.6-7.1 C.血浆7.35-7.45 D.胃液0.9-1.5
3.一些食物的近似pH如表所示,下列说法正确的是
食物 苹果汁 西瓜汁 牛奶 鸡蛋清
pH 2.9 5.8 6.4 7.6
A.牛奶放置一段时间后变酸,pH变大
B.西瓜汁比苹果汁酸性强
C.鸡蛋清和牛奶都显碱性
D.胃酸过多的人应该少饮苹果汁
4.下列宏观事实的微观解释错误的是
A.墙内开花墙外香——分子是不断运动的
B.6000升氧气在加压的情况下可装入容积为40升的钢瓶中——分子体积变小
C.硫酸、盐酸有一些相似的性质原因——不同的酸溶液中都含有氢离子
D.一氧化碳能燃烧二氧化碳不能燃烧——分子构成不同
5.下列关于物质用途的叙述错误的是
A.稀硫酸可用于除铁锈
B.氢氧化钙用于改良酸性土壤
C.氧气可用作燃料
D.明矾用于处理水中微小悬浮物
6.下列关于氢氧化钠的说法正确的是
A.实验室称量氢氧化钠时可以将氢氧化钠放在纸上称量
B.氢氧化钠易潮解,要密封保存
C.不小心将浓硫酸沾到皮肤上,应立即用氢氧化钠进行中和,然后用大量的水冲洗
D.溶于水放出大量热的白色固体一定是氢氧化钠
7.下列物质不能与稀硫酸发生反应的是
A.CuO B.Ag C.BaCl2 D.Mg(OH)2
8.分析和推理是化学学习常用的方法,以下推理正确的是
A.厨房洗涤剂对油污有乳化作用,则汽油除油污利用的也是乳化作用
B.化合物是由不同种元素组成的纯净物,则只含一种元素的物质一定不是化合物
C.溶液具有均一性和稳定性,则均一性和稳定性的液体一定是溶液
D.活泼金属与酸反应能产生气体,则能与酸反应产生气体的一定是活泼金属
9.下列有关氢氧化钠的说法,错误的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等
10.证据推理是化学学科核心素养的重要内容,下列推理正确的是
A.酸能使紫色石蕊溶液变色,所以酸也能使无色酚酞溶液变色
B.化合物由不同种元素组成,所以由不同种元素组成的纯净物一定是化合物
C.中和反应是有盐和水生成的反应,所以有盐和水生成的反应一定是中和反应
D.燃烧都伴随有发光、放热现象,所以有发光、放热现象的变化一定是燃烧
11.某化学小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是
A.该实验是将氢氧化钠溶液滴入稀盐酸中
B.a点所示溶液中,溶质只有NaCl
C.b点表示稀盐酸和氢氧化钠溶液恰好完全反应
D.向点c所示溶液中滴加紫色石蕊溶液,溶液变蓝色
二、简答题
12.如图展示了家庭中常见的洗涤用品及其主要成分。
洗涤用品 去污粉 洁厕灵 炉具清洁剂
实物图
主要成分 小苏打 盐酸 烧碱
(1)洁厕灵与去污粉混合后会发生反应,现象是_____。
(2)炉具清洁剂与洁厕灵不能混合使用,其原因是_____(用化学方程式表示)。
13.用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。
(1)熟石灰与盐酸反应的化学方程式为?
(2)当加入熟石灰mg时,溶液中的溶质为?
(3)若改用ng氢氧化钠与相同量盐酸反应,所得溶液的pH大小?
14.有五瓶失去标签的无色溶液分别是稀盐酸、稀硫酸、氢氧化钠溶液、澄清的石灰水、氯化钠溶液,如何将它们一一鉴别出来______?
三、推断题
15.A~H是初中化学常见的物质,其相互转化关系如图所示,其中A是人体胃液中帮助消化的物质, B常用于改良酸性土壤。回答下列问题:
(1)物质B的化学式为______________。
(2)物质C反应生成物质E和F的化学方程式为______________ ,其反应基本类型属于______________。
16.你玩过“盖房子”的游戏吗?如图所示,A、B、C、D、E是初中化学常见的不同类别的物质,其中B的溶液呈蓝色,G是汽车用铅酸蓄电池中的酸,D的固体常用于人工降雨,游戏规则是根据“上下相邻物质间均可发生化学,且左边上下相邻物质间反应均有气体产生,左边物质能转化为右边物质”来堆砌物质。
请选择合适的物质盖完房子:
(1)写出C和G的化学式:C_____,G_____。
(2)从烟囱中出来的气体为_____(填名称)。
(3)写出F→C的化学方程式:_____。
(4)写出“盖房子”的物质中能发生中和反应的化学方程式:_____。
(5)在第一层的下面再挖出一层做地下停车场,若左边的物质是大理石,则右边的物质可能是_____。
四、实验题
17.实验小组同学分别向下列试剂中滴加自制紫薯汁,现象记录如下:
试剂 现象 操作 稀盐酸 氢氧化钠溶液 蒸馏水 白醋 草木灰溶液
滴加2滴紫薯汁 红色 绿色 紫色 红色 绿色
(1)紫薯汁________(填“能”或“不能”)作酸碱指示剂。
(2)草木灰溶液呈_________ (填“酸性”、“中性”或“碱性”)。
(3)向“蒸馏水中滴加紫薯汁”的目的是_________。
18.下图是化学兴趣小组同学设计和改进的实验装置,请你参与他们的探究活动。回答下列问题:
(1)图1:小镜同学用一根粗铜丝绕成线圈罩在蜡烛的火焰上,火焰很快熄灭。请分析蜡烛火焰熄灭的原因 ______ ,此实验说明金属铜具有 ______ 性。小易同学在铺有一层纯碱粉末的烧杯中点燃一支蜡烛,然后沿着烧杯壁缓缓倒入稀硫酸,蜡烛火焰熄灭。请分析蜡烛熄灭的原因 ______ 。
(2)图2:小含同学在烧杯中加入浓氨水;在烧杯、中都加入 蒸馏水,并分别滴加3滴酚酞试液于蒸馏水中,得到无色溶液。用一只大烧杯把、两烧杯罩在一起,几分钟后,溶液颜色变成红色的烧杯是 ______ (填“”“”或“”),请你用分子的知识解释烧杯中溶液变红的原因 ______ 。
19.Y形管因形似字母Y而得名,其特殊的结构为许多化学实验的进行创造了条件。如图均为用用 Y 形管或 Y 形导管完成的实验,请回答以下问题:
(1)图1中, Y 形导管平放于桌面,实验中可观察到的现象_____,用化学方程式解释结论:_____。
(2)图2中,若把 Y 形导管固定在铁架台上,a 管位于上方, b 管位于下方,两石蕊试纸均湿润,可观察到 b 管中试纸变色比 a 管明显,原因是_____。
五、计算题
20.取100g一定质量分数的Ba(OH)2溶液于烧杯中,逐渐加入质量分数为20%的H2SO4溶液.实验过程中,溶液的pH与加入H2SO4溶液的质量关系如图所示。请计算Ba(OH)2溶液中溶质的质量分数。( 反应的方程式为:Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O)
21.取73g稀盐酸加入锥形瓶中,再逐滴滴加溶质质量分数为10%的NaOH溶液,反应过程中溶液的酸碱度变化如图所示。求该盐酸中溶质的质量分数。
22.某氢氧化钙粉末中含有碳酸钙杂质。现取一定质量的样品于锥形瓶中并加水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示。
(1)生成二氧化碳的质量是______。
(2)加入稀盐酸后所得溶液中含有的溶质是______(填化学式)。
(3)计算所用稀盐酸的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.B
5.C
6.B
7.B
8.B
9.C
10.B
11.B
12. 产生大量气泡 HCl+NaOH═NaCl+H2O
13.(1)Ca(OH)2+2HCl═CaCl2+2H2O
(2)CaCl2和HCl
(3)pH<7
14.用五支洁净试管,分别取五种溶液少许,再分别滴入几滴紫色石蕊试液.仍为紫色的是新化钠溶液,使紫色石蕊试液变为红色的是稀盐酸和稀硫酸,使紫色石蕊试液变为蓝色的是氢氧化钠溶液和石灰水.
@另取两支洁净试管,分别取两种酸溶液少许,再分别滴入少量氯化钡溶液,产生白色沉淀的是稀硫酸,无沉淀产生的是稀盐酸.
@再另取两支洁净试管,分别取两种碱溶液少许,分别通入少量二氧化碳气体,出现浑浊的是石灰水,无现象的是氢氧化钠溶液.
15. Ca(OH)2 分解反应
16. NaOH H2SO4 二氧化碳
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 2NaOH+H2SO4=Na2SO4+2H2O 水或氧化钙
17. 能 碱性 空白对照实验
18. 铜丝具有导热性,能将蜡烛燃烧产生的热量传导出去,使得蜡烛周围的温度低于蜡烛的着火点,致使蜡烛的火焰熄灭(合理即可) 导热 烧杯中的纯碱与稀硫酸反应产生大量的二氧化碳,二氧化碳不燃烧也不支持燃烧,使蜡烛熄灭(合理即可) 浓氨水具有挥发性,氨分子运动到烧杯中,溶于水得到氨水,氨水呈碱性,遇酚酞试液,会使溶液变为红色(合理即可)
19. 湿润的紫色石蕊试纸变红色,干燥的紫色石蕊试纸无明显变化 H2O+CO2=H2CO3 二氧化碳的密度比空气大,主要从b管中通过
20.6.48%
21.5%
22.(1)2.2;(2)、;(3)18.25%
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
