第四单元 盐 化肥 巩固练习 2022-2023学年九年级化学人教版(五四学制)全一册(有答案)
文档属性
| 名称 | 第四单元 盐 化肥 巩固练习 2022-2023学年九年级化学人教版(五四学制)全一册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 109.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-15 15:49:59 | ||
图片预览



文档简介
第四单元盐化肥巩固
一、单选题
1.工业用反应来制备纯碱,该反应属于
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
2.科学地施用化肥是农业增产的重要手段。下列属于氮肥的是
A.K2CO3 B.Ca(H2PO4)2
C.NH4HCO3 D.K2SO4
3.下列有关纯碱的说法正确的是
A.纯碱难溶于水
B.纯碱是碱而不是盐
C.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
D.纯碱中含有少量的小苏打可以用稀盐酸除去
4.下列化学方程式所表示的化学反应能发生的是 ( )
A.Cu+H2SO4=CuSO4+H2↑ B.Fe+ Zn( NO3)2=Fe(NO3)2+Zn↓
C.CuCl2+2NaOH=Cu(OH)2↓+2NaCl D.Na2CO3+2KNO3=K2CO3+ 2NaNO3
5.下列各组离子能在指定溶液中大量共存的一组是
A.在稀硫酸中:Ba2+、CO3 2—、Zn2+ B.在氢氧化钙溶液中:H+、Mg2+、Cl—
C.在氯化钠溶液中:K+、Ca2+、NO3— D.在氯化铵溶液中:Na+、Cu2+、OH—
6.某同学总结的的化学性质如图,下列说法错误的是( )
A.反应①甲一定是碳酸钠
B.反应②为中和反应
C.反应③可用于检验气体
D.反应④向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
7.向一定质量的FeCl3溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势如图所示。下列说法正确的是
A.a点时溶液中一定存在Fe3+
B.c点时所加试剂是NaOH溶液
C.加入试剂总体积为V1时,溶液中不存在NaOH
D.d点时溶液中的溶质不只是盐
8.除去下列物质中的杂质,选用试剂和方法均正确的是
选项 物质 杂质(少量) 试剂和方法
A 氯化钾 氯酸钾 加入少量二氧化锰粉末,加热
B 稀硫酸 稀盐酸 加入适量的氯化钡溶液,过滤
C 氯化钙溶液 氢氧化钙 加入稍微过量的稀盐酸,加热
D 硝酸钾溶液 硫酸钾 加入过量的硝酸钡溶液,过滤
A.A B.B C.C D.D
9.除去下列各组物质中的杂质(括号内为杂质),所选用的试剂(足量)及操作方法均正确的是( )
选项 物质 选用试剂 操作方法
A Fe2O3(Fe) 盐酸 浸泡、过滤、洗涤、烘干
B CO(CO2) NaOH溶液、浓硫酸 洗气、干燥
C CaO(CaCO3) 水 过滤、烘干
D NaCl(Na2CO3) Ca(NO3)2溶液 溶解、过滤、蒸发、结晶
A.A B.B C.C D.D
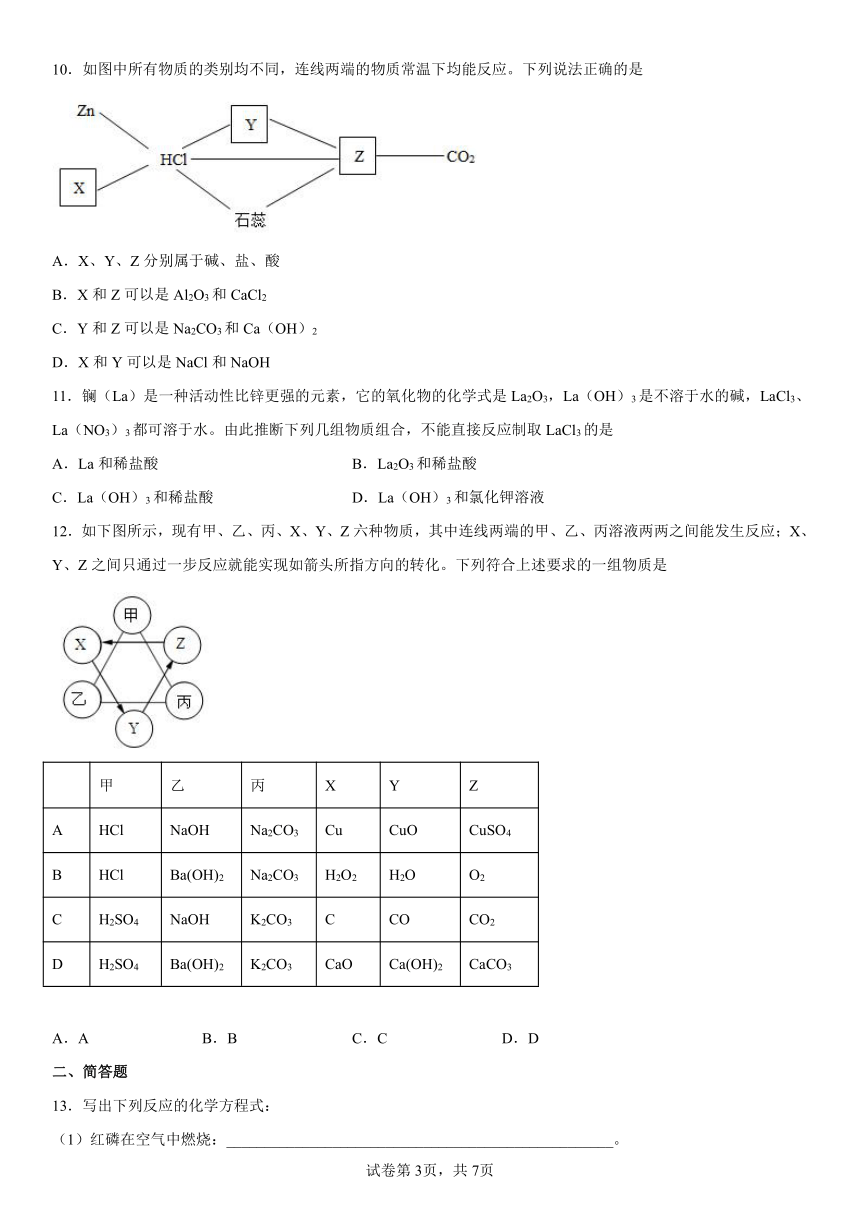
10.如图中所有物质的类别均不同,连线两端的物质常温下均能反应。下列说法正确的是
A.X、Y、Z分别属于碱、盐、酸
B.X和Z可以是Al2O3和CaCl2
C.Y和Z可以是Na2CO3和Ca(OH)2
D.X和Y可以是NaCl和NaOH
11.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是
A.La和稀盐酸 B.La2O3和稀盐酸
C.La(OH)3和稀盐酸 D.La(OH)3和氯化钾溶液
12.如下图所示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应;X、Y、Z之间只通过一步反应就能实现如箭头所指方向的转化。下列符合上述要求的一组物质是
甲 乙 丙 X Y Z
A HCl NaOH Na2CO3 Cu CuO CuSO4
B HCl Ba(OH)2 Na2CO3 H2O2 H2O O2
C H2SO4 NaOH K2CO3 C CO CO2
D H2SO4 Ba(OH)2 K2CO3 CaO Ca(OH)2 CaCO3
A.A B.B C.C D.D
二、简答题
13.写出下列反应的化学方程式:
(1)红磷在空气中燃烧:___________________________________________________。
(2)氯化铵与熟石灰加热制氨气:____________________________________________________。
14.(1)下图是初中化学常见的三个实验,回答下列问题:
① 实验中集气瓶内预先装少量水的目的是___________。
②B 实验中导致实验结果偏小的原因是______________。
③C 实验中该操作将导致所配溶液溶质质量分数 _____________(填“ 偏大”、“偏 小”或“不 变”)。
(2)除去下列物质中的少量杂 质,所选试剂及操作都正确( )(多选)
序号 物质 杂质 试 剂 操作
A Fe Fe2O3 盐 酸 结晶
B NaCl NH4HCO3 ---- 加热
C Cu(NO3)2 溶液 BaCl2 AgNO3溶液 过滤
D O2 水蒸气 浓硫酸 洗气
15.氯化铁是一种良好的净水剂,化学上可以用多种方法来制取.请写出四种用铁及某化合物通过一步化学反应制取氯化铁的三个化学方程式:
(1)________________________________________;
(2)____________________________________;
(3)__________________________________ . (碳酸钠不要作为反应物)
三、推断题
16.果果以水为主题进行“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,据下图完成有关问题:
(1)反应的基本类型为_____反应:;
(2)反应的基本类型为置换反应:_____;
(3)反应的基本类型为化合反应:________________________;
(4)反应的基本类型为复分解反应:__________________________。
17.框图中的物质为初中化学所学的物质,其中A是白色固体,D是单质, B、F是固体氧化物; H可作补钙剂,E→C属于复分解反应图中“→”表示物质间存在转化关系;部分反应条件、反应物或生成物已略去。
(1)写出化学式: A_____________,B______________,H______________。
(2) F的俗名是________________,F→G反应能______________(选填“放出”、“吸收”)热量。
(3)写出下列转化的化学方程式
①G→H:_________________________________。
②E→C:_____________________________。
四、实验题
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.小宁同学在家里做了一个小实验:如图所示,取一个小玻璃杯,放入洗净的碎鸡蛋壳,然后加入一些醋精(主要成分是醋酸),立即用蘸有澄清石灰水的玻璃片盖住。
观察到的现象是:(1) __________; (2)__________.
由此,可推测鸡蛋壳里主要含有__________ 两种元素,并请你写出其中一个反应的化学方程式__________.
20.同学们在实验室用混合两种固体药品的办法自制“钾、氮复合肥料”,使用到的药品有KCl,K2SO4,NH4HCO3,NH4Cl。同学们制得了成分不同的“钾、氮复合肥料”,从中抽取一份作为样品探究其成分,请回答有关问题:
限选试剂:稀HCl,稀H2SO4,BaCl2溶液,AgNO3溶液,蒸馏水
(1)提出合理假设。所抽样品的成分有4种可能:
假设1:KCl和 NH4HCO3;假设2:KCl和NH4Cl;
假设3:K2SO4和 NH4HCO3;假设4:_____。
(2)形成设计思路。
①甲同学先提出先用AgNO3溶液确定是否含有KCl,你是否同意并说出理由:____。
②乙同学提出先确定是否含有NH4HCO3,则可以选择的试剂是_____。
(3)完成实验方案。请填写实验操作,与表中结论相符的预期现象。
实验操作 预期现象 结论
步骤1:____ _____ 假设2成立
步骤2:_____ _____
五、计算题
21.现有氢氧化钠和碳酸钠的混合溶液,为了测定溶液中碳酸钠的溶质的质量分数。化学小组的同学取上述溶液50g于烧杯中,逐滴加入稀盐酸,如图所示关系:
(1)反应生成二氧化碳的质量为_____g。
(2)计算溶液中碳酸钠的溶质的质量分数。
22.用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 优良品 一级品 二级品
氯化钾质量分数(≥) 93.00% 90.00% 87.00%
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
23.钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。
提示①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2Hac=CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)该实验中浓硫酸的作用是___________。
(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是___________(选填“变大”、“变小”或“不变)。
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数___________。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.C
5.C
6.A
7.C
8.C
9.B
10.C
11.D
12.D
13. 4P+ 5O22P2O5 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
14. 防止高温生成物溅落,将集气瓶炸裂 红磷的量不足(其它合理答案也可) 偏大 BD
15. 2Fe+3C12 2FeCl 3 Fe 2O 3+6HCl===2FeCl 3+3H 2O Fe(OH) 3+3HCl===FeCl 3+3H 2O
16. 分解 Fe2O3 Ca(OH)2+2HCl=CaCl2+2H2O
17. KClO3 MnO2 CaCO3 生石灰 放出
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. 鸡蛋壳表面有气泡产生 澄清的石灰水变浑浊; 碳、氧 Ca(OH)2+CO2=CaCO3↓+H2O
20. K2SO4和NH4Cl 不同意,因为AgNO3也可以与NH4Cl反应生成AgCl沉淀,不能确定是否有KCl 稀HCl(或稀H2SO4) 取少量样品放入试管中,加适量水溶解,加入足量稀盐酸 不产生气泡 向步骤1的试管中加入少量氯化钡溶液 不产生白色沉淀
21.(1)8.8
(2) 解:设溶液中碳酸钠的溶质的质量分数为x。
x=42.4%
答:溶液中碳酸钠的溶质的质量分数为42.4%。
22.(1)二级品;(2)3.725%
23. 吸收二氧化碳携带的水蒸气,防止实验结果不准确 变小 生成二氧化碳的质量为:820g﹣819.89=0.11g
解:设鱼骨中碳酸钙的质量分数为x
x=1.25%
答:鱼骨中碳酸钙的质量分数为1.25% 要使鱼骨中的碳酸钙完全反应需要的时间太长
答案第1页,共2页
答案第1页,共2页
一、单选题
1.工业用反应来制备纯碱,该反应属于
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
2.科学地施用化肥是农业增产的重要手段。下列属于氮肥的是
A.K2CO3 B.Ca(H2PO4)2
C.NH4HCO3 D.K2SO4
3.下列有关纯碱的说法正确的是
A.纯碱难溶于水
B.纯碱是碱而不是盐
C.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
D.纯碱中含有少量的小苏打可以用稀盐酸除去
4.下列化学方程式所表示的化学反应能发生的是 ( )
A.Cu+H2SO4=CuSO4+H2↑ B.Fe+ Zn( NO3)2=Fe(NO3)2+Zn↓
C.CuCl2+2NaOH=Cu(OH)2↓+2NaCl D.Na2CO3+2KNO3=K2CO3+ 2NaNO3
5.下列各组离子能在指定溶液中大量共存的一组是
A.在稀硫酸中:Ba2+、CO3 2—、Zn2+ B.在氢氧化钙溶液中:H+、Mg2+、Cl—
C.在氯化钠溶液中:K+、Ca2+、NO3— D.在氯化铵溶液中:Na+、Cu2+、OH—
6.某同学总结的的化学性质如图,下列说法错误的是( )
A.反应①甲一定是碳酸钠
B.反应②为中和反应
C.反应③可用于检验气体
D.反应④向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
7.向一定质量的FeCl3溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势如图所示。下列说法正确的是
A.a点时溶液中一定存在Fe3+
B.c点时所加试剂是NaOH溶液
C.加入试剂总体积为V1时,溶液中不存在NaOH
D.d点时溶液中的溶质不只是盐
8.除去下列物质中的杂质,选用试剂和方法均正确的是
选项 物质 杂质(少量) 试剂和方法
A 氯化钾 氯酸钾 加入少量二氧化锰粉末,加热
B 稀硫酸 稀盐酸 加入适量的氯化钡溶液,过滤
C 氯化钙溶液 氢氧化钙 加入稍微过量的稀盐酸,加热
D 硝酸钾溶液 硫酸钾 加入过量的硝酸钡溶液,过滤
A.A B.B C.C D.D
9.除去下列各组物质中的杂质(括号内为杂质),所选用的试剂(足量)及操作方法均正确的是( )
选项 物质 选用试剂 操作方法
A Fe2O3(Fe) 盐酸 浸泡、过滤、洗涤、烘干
B CO(CO2) NaOH溶液、浓硫酸 洗气、干燥
C CaO(CaCO3) 水 过滤、烘干
D NaCl(Na2CO3) Ca(NO3)2溶液 溶解、过滤、蒸发、结晶
A.A B.B C.C D.D
10.如图中所有物质的类别均不同,连线两端的物质常温下均能反应。下列说法正确的是
A.X、Y、Z分别属于碱、盐、酸
B.X和Z可以是Al2O3和CaCl2
C.Y和Z可以是Na2CO3和Ca(OH)2
D.X和Y可以是NaCl和NaOH
11.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是
A.La和稀盐酸 B.La2O3和稀盐酸
C.La(OH)3和稀盐酸 D.La(OH)3和氯化钾溶液
12.如下图所示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应;X、Y、Z之间只通过一步反应就能实现如箭头所指方向的转化。下列符合上述要求的一组物质是
甲 乙 丙 X Y Z
A HCl NaOH Na2CO3 Cu CuO CuSO4
B HCl Ba(OH)2 Na2CO3 H2O2 H2O O2
C H2SO4 NaOH K2CO3 C CO CO2
D H2SO4 Ba(OH)2 K2CO3 CaO Ca(OH)2 CaCO3
A.A B.B C.C D.D
二、简答题
13.写出下列反应的化学方程式:
(1)红磷在空气中燃烧:___________________________________________________。
(2)氯化铵与熟石灰加热制氨气:____________________________________________________。
14.(1)下图是初中化学常见的三个实验,回答下列问题:
① 实验中集气瓶内预先装少量水的目的是___________。
②B 实验中导致实验结果偏小的原因是______________。
③C 实验中该操作将导致所配溶液溶质质量分数 _____________(填“ 偏大”、“偏 小”或“不 变”)。
(2)除去下列物质中的少量杂 质,所选试剂及操作都正确( )(多选)
序号 物质 杂质 试 剂 操作
A Fe Fe2O3 盐 酸 结晶
B NaCl NH4HCO3 ---- 加热
C Cu(NO3)2 溶液 BaCl2 AgNO3溶液 过滤
D O2 水蒸气 浓硫酸 洗气
15.氯化铁是一种良好的净水剂,化学上可以用多种方法来制取.请写出四种用铁及某化合物通过一步化学反应制取氯化铁的三个化学方程式:
(1)________________________________________;
(2)____________________________________;
(3)__________________________________ . (碳酸钠不要作为反应物)
三、推断题
16.果果以水为主题进行“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,据下图完成有关问题:
(1)反应的基本类型为_____反应:;
(2)反应的基本类型为置换反应:_____;
(3)反应的基本类型为化合反应:________________________;
(4)反应的基本类型为复分解反应:__________________________。
17.框图中的物质为初中化学所学的物质,其中A是白色固体,D是单质, B、F是固体氧化物; H可作补钙剂,E→C属于复分解反应图中“→”表示物质间存在转化关系;部分反应条件、反应物或生成物已略去。
(1)写出化学式: A_____________,B______________,H______________。
(2) F的俗名是________________,F→G反应能______________(选填“放出”、“吸收”)热量。
(3)写出下列转化的化学方程式
①G→H:_________________________________。
②E→C:_____________________________。
四、实验题
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.小宁同学在家里做了一个小实验:如图所示,取一个小玻璃杯,放入洗净的碎鸡蛋壳,然后加入一些醋精(主要成分是醋酸),立即用蘸有澄清石灰水的玻璃片盖住。
观察到的现象是:(1) __________; (2)__________.
由此,可推测鸡蛋壳里主要含有__________ 两种元素,并请你写出其中一个反应的化学方程式__________.
20.同学们在实验室用混合两种固体药品的办法自制“钾、氮复合肥料”,使用到的药品有KCl,K2SO4,NH4HCO3,NH4Cl。同学们制得了成分不同的“钾、氮复合肥料”,从中抽取一份作为样品探究其成分,请回答有关问题:
限选试剂:稀HCl,稀H2SO4,BaCl2溶液,AgNO3溶液,蒸馏水
(1)提出合理假设。所抽样品的成分有4种可能:
假设1:KCl和 NH4HCO3;假设2:KCl和NH4Cl;
假设3:K2SO4和 NH4HCO3;假设4:_____。
(2)形成设计思路。
①甲同学先提出先用AgNO3溶液确定是否含有KCl,你是否同意并说出理由:____。
②乙同学提出先确定是否含有NH4HCO3,则可以选择的试剂是_____。
(3)完成实验方案。请填写实验操作,与表中结论相符的预期现象。
实验操作 预期现象 结论
步骤1:____ _____ 假设2成立
步骤2:_____ _____
五、计算题
21.现有氢氧化钠和碳酸钠的混合溶液,为了测定溶液中碳酸钠的溶质的质量分数。化学小组的同学取上述溶液50g于烧杯中,逐滴加入稀盐酸,如图所示关系:
(1)反应生成二氧化碳的质量为_____g。
(2)计算溶液中碳酸钠的溶质的质量分数。
22.用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 优良品 一级品 二级品
氯化钾质量分数(≥) 93.00% 90.00% 87.00%
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
23.钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。
提示①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2Hac=CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)该实验中浓硫酸的作用是___________。
(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是___________(选填“变大”、“变小”或“不变)。
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数___________。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.C
5.C
6.A
7.C
8.C
9.B
10.C
11.D
12.D
13. 4P+ 5O22P2O5 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
14. 防止高温生成物溅落,将集气瓶炸裂 红磷的量不足(其它合理答案也可) 偏大 BD
15. 2Fe+3C12 2FeCl 3 Fe 2O 3+6HCl===2FeCl 3+3H 2O Fe(OH) 3+3HCl===FeCl 3+3H 2O
16. 分解 Fe2O3 Ca(OH)2+2HCl=CaCl2+2H2O
17. KClO3 MnO2 CaCO3 生石灰 放出
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. 鸡蛋壳表面有气泡产生 澄清的石灰水变浑浊; 碳、氧 Ca(OH)2+CO2=CaCO3↓+H2O
20. K2SO4和NH4Cl 不同意,因为AgNO3也可以与NH4Cl反应生成AgCl沉淀,不能确定是否有KCl 稀HCl(或稀H2SO4) 取少量样品放入试管中,加适量水溶解,加入足量稀盐酸 不产生气泡 向步骤1的试管中加入少量氯化钡溶液 不产生白色沉淀
21.(1)8.8
(2) 解:设溶液中碳酸钠的溶质的质量分数为x。
x=42.4%
答:溶液中碳酸钠的溶质的质量分数为42.4%。
22.(1)二级品;(2)3.725%
23. 吸收二氧化碳携带的水蒸气,防止实验结果不准确 变小 生成二氧化碳的质量为:820g﹣819.89=0.11g
解:设鱼骨中碳酸钙的质量分数为x
x=1.25%
答:鱼骨中碳酸钙的质量分数为1.25% 要使鱼骨中的碳酸钙完全反应需要的时间太长
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
