高中化学人教版(2019)选择性必修1 3.1电离平衡(共24张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修1 3.1电离平衡(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-15 20:28:03 | ||
图片预览




文档简介
(共24张PPT)
第三章
电离平衡
第一节
水溶液中的离子反应与平衡
IONIZATION BALANCE
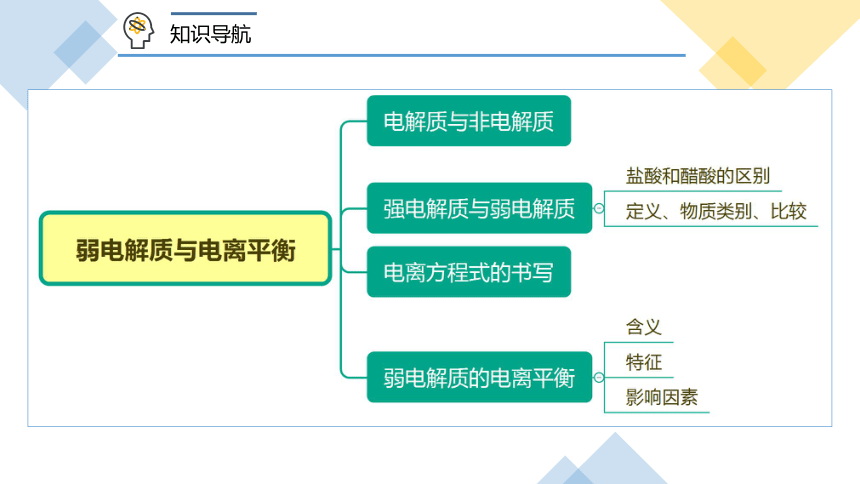
强电解质和弱电解质 弱电解质的电离平衡
知识导航
知识回顾
(1)什么叫电解质?
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态都不能导电的化合物。
(3)电解质的导电
(2)什么叫非电解质?
条件:
溶于水或熔融状态
本质 :
自由离子的定向移动
能力:
离子浓度、离子所带电荷
包括酸、 碱、 盐、活泼金属氧化物、水等。
包括大多数有机物、NH3、大部分非金属氧化物等。
盐酸常用于卫生洁具的清洁,比如某些洁厕灵有效成分是盐酸。
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
任务一: 研究在相同条件下,不同电解质的电离程度是否有区别。
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
与镁条反应
实验3-1
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
与镁条反应
1 接近3
强 弱
迅速产生大量气泡
产生气泡相对缓慢
结论:
HCl在水中的电离程度大于CH3COOH
c(H+)=10-pH
0.1mol/L HCl(aq)
c(H+)=
10-1
=0.1 mol/L
0.1mol/L CH3COOH(aq)
c(H+)≈
10-3 mol/L
结论:
HCl分子在水中完全电离
醋酸分子在水中部分电离,且非常微弱
数据分析
已知: pH= lgC(H+)
Cl- H3O+
图示模拟微观电离
HCl完全电离
CH3COOH部分电离
HCl在水中电离示意图 CH3COOH在水中电离示意图
H3O+ CH3COO- CH3COOH
强电解质
弱电解质
一、强、弱电解质的定义、物质类别与比较
强电解质 弱电解质
定义 在水溶液中能_______电离 在水溶液中只能_______电离
电离过程
在溶液中的 存在形式
物质类别 及示例
完全
部分
不可逆,
可逆,
只有离子
既有离子,又有电解质分子
①强酸,如HCl、H2SO4、HNO3、HBr、 HI、HClO4
②强碱,如KOH、NaOH、Ca(OH)2、Ba(OH)2
③大部分盐,如NaCl、BaSO4
④活泼金属氧化物Na2O等
①弱酸,HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH
②弱碱,如NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2
③水
④少数盐 (CH3COO)2Pb,HgCl2
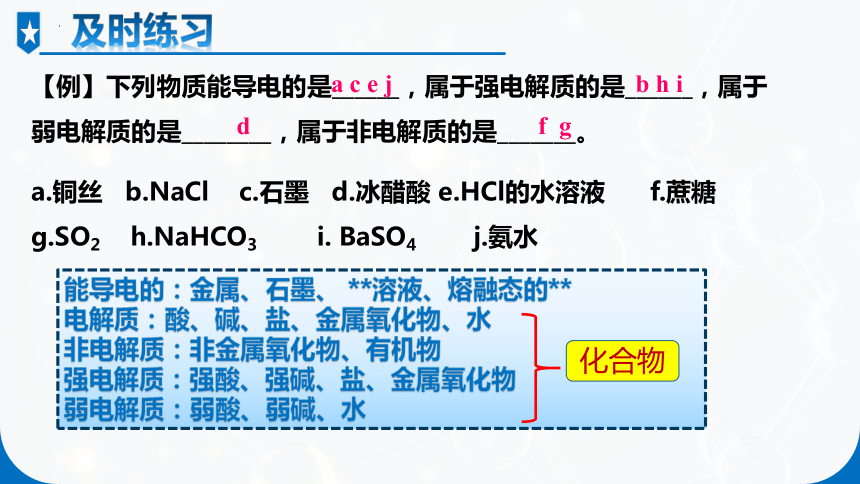
【例】下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是________,属于非电解质的是_______。
a.铜丝 b.NaCl c.石墨 d.冰醋酸 e.HCl的水溶液 f.蔗糖 g.SO2 h.NaHCO3 i. BaSO4 j.氨水
a c e j
b h i
d
f g
能导电的:金属、石墨、 **溶液、熔融态的**
电解质:酸、碱、盐、金属氧化物、水
非电解质:非金属氧化物、有机物
强电解质:强酸、强碱、盐、金属氧化物
弱电解质:弱酸、弱碱、水
及时练习
化合物
二、电离方程式
强电解质 强酸
强碱
盐 正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl === H+ + Cl-
完全电离,如Ba(OH)2 === Ba2+ + 2OH-
原则:遵循质量守恒、电荷守恒、客观事实
完全电离,如CH3COONH4 = CH3COO - + NH4+
完全电离,如NaHSO4=Na++H++SO42-(水溶液)
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3=Na++HCO3- HCO3- H++CO32-
NaHSO4=Na++H++SO42-(熔融态)
弱电解质 一元弱酸
一元弱碱
H2O
多元弱酸
多元弱碱
二、电离方程式
碱式
酸式
两性氢氧化物双向电离
部分电离,CH3COOH H++CH3COO-
部分电离,NH3·H2O NH4+ + OH -
部分电离,H2O H+ + OH -
分步电离,分步写出,(以第一步电离为主)
H2CO3 H+ +HCO3
HCO3 H+ + CO32
Cu(OH)2 Cu2+ + 2OH
分步电离,一步写出
总结:强等号、弱可逆;多元弱酸分步写;
多元弱碱一步完;酸式盐看强弱、看条件。
任务二:研究弱电解质是如何部分电离的?
猜测1:部分电离就是只有一部分CH3COOH发生电离,另一部分CH3COOH不发生电离;
猜测2:部分电离是指CH3COOH电离生成CH3COO-和H+,而生成的CH3COO-又与H+结合生成CH3COOH
(宏观现象)
(微观本质)
pH变化?
H+与CH3COO 能结合
【设计实验】
如何研究溶液中的H+与CH3COO 能否结合为CH3COOH?
可选试剂:0.1mol/L CH3COOH、CH3COONa溶液(碱性)、
CH3COONa(s)、CH3COONH4溶液(中性)、CH3COONH4(s),
可选仪器:pH计、烧杯、玻璃棒等。
反映
设计实验
向0.1 mol/L CH3COOH溶液中加入CH3COONH4固体,充分搅拌后测pH。
(宏观现象)
溶液pH变大
(微观本质)
c(H+)减小
结论:
弱电解质分子在水溶液存在电离平衡
CH3COOH
CH3COO
+ H+
pH升高,c(H+)下降
CH3COOH
CH3COO
+ H+
实验结果:
任务二:研究弱电解质是如何部分电离的?
H+与CH3COO 能结合
(1)开始时,V电离 和 V结合怎样变化?
(2)当V电离 = V结合时,可逆过程达到一种什么样的状态?画出V~t图。
思考:在一定的条件下,往一杯水中加进一定量的冰醋酸会发生如何的变化?
CH3COOH CH3COO - + H+
电离
结合
三、弱电解质的电离平衡
(HAc Ac- + H+)
化学平衡
电离平衡
知识迁移
c(H+) c(CH3COO-) c(CH3COOH) v(电离) v(结合)
醋酸初溶于水时
接着
最后
0(最小)
0(最小)
最大
增大
最大
0(最小)
增大
减小
减小
增大
不变
不变
不变
不变
不变
电离平衡状态建立
反应速率
V(电离)
V(结合)
V(电离) = V(结合)
电离平衡状态
弱电解质电离平衡状态建立示意图
时间
三、弱电解质的电离平衡
电离平衡是一种动态平衡。
逆:弱电解质的电离是可逆过程
在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时, 电离过程就达到了平衡状态, 这种平衡状态叫做弱电解质的电离平衡。
动:电离平衡是一种动态平衡
定:条件不变,溶液中各分子、离子的浓度不变
变:条件改变时,电离平衡发生移动
等:V电离 = V结合≠0
定义
1
特征
2
三、弱电解质的电离平衡
不是可逆反应
影响电离平衡的因素
(1) 内因:电解质自身性质,电解质越弱电离程度越小
(2) 外因:电离平衡是动态平衡,遵循勒夏特列原理。
影响电离平衡的条件有温度、浓度、电解质(酸碱盐等)
3
三、弱电解质的电离平衡
改 变 条 件 平衡移 动方向 电离
程度
加 热
通HCl(g)
加NaOH (s)
加NaAc (s)
加少量冰醋酸
加水稀释
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
减小
增大
增大
减小
减小
c(H+)
c(Ac-)
c(HAc)
三、弱电解质的电离平衡
H>0
α= —————————×100%
已电离的溶质分子数
原有溶质分子总数
①温度:弱电解质的电离为吸热,升温促使电离平衡正向移动(越热越电离)
影响电离平衡的因素
④离子反应效应:加入能与弱电解质电离产生的某种离子反应的物质时,将促进平衡,向正向移动。
②浓度: 降低浓度,电离平衡向正向移动,因为离子相互碰撞结合为分子的几率减小。(越稀越电离)
③同离子效应:加入与弱电解质具有相同离子的强电解质,将抑制平衡,向逆向移动。
3
三、弱电解质的电离平衡
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
CaCO3是卫生洁具常见的污染物之一。
去污原理如下:
CaCO3 + 2H+ = CO2↑ + H2O + Ca2+
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率。
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度。
学以致用
化学与生活
小孩大哭过后,容易出现抽抽搭搭,停不下来、喘不上气,或者手脚僵硬的情况。
已知人体血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO3-
人体血液的pH需维持在7.35~7.45。
当pH<7.35会导致酸中毒,pH大于7.45会导致碱中毒。
小孩大哭后,呼出大量CO2,平衡状态改变后,发生了轻微碱中毒。
出现轻微碱中毒后,如何缓解中毒症状呢?
直接吸入大量CO2合理吗?
可用纸袋,罩于鼻、口上再呼吸,增加动脉血CO2浓度
会窒息
1.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示:
(3)a、b、c三点对应的溶液中CH3COOH电离程度最大的是______。
(4)若使b点对应的溶液中c(CH3COO-)增大,c(H+)减小,可采用的方法是______(填序号)
① 加入H2O ②加入NaOH固体
③加入浓硫酸 ④ 加入Na2CO3固体
b>a>c
(1)“O”点不能导电的理由________________。
(2)a、b、c三点溶液c(H+)由大到小的顺序为______。
没有自由移动的离子
C
②④
及时练习
知识导航
第三章
电离平衡
第一节
水溶液中的离子反应与平衡
IONIZATION BALANCE
强电解质和弱电解质 弱电解质的电离平衡
知识导航
知识回顾
(1)什么叫电解质?
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态都不能导电的化合物。
(3)电解质的导电
(2)什么叫非电解质?
条件:
溶于水或熔融状态
本质 :
自由离子的定向移动
能力:
离子浓度、离子所带电荷
包括酸、 碱、 盐、活泼金属氧化物、水等。
包括大多数有机物、NH3、大部分非金属氧化物等。
盐酸常用于卫生洁具的清洁,比如某些洁厕灵有效成分是盐酸。
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
任务一: 研究在相同条件下,不同电解质的电离程度是否有区别。
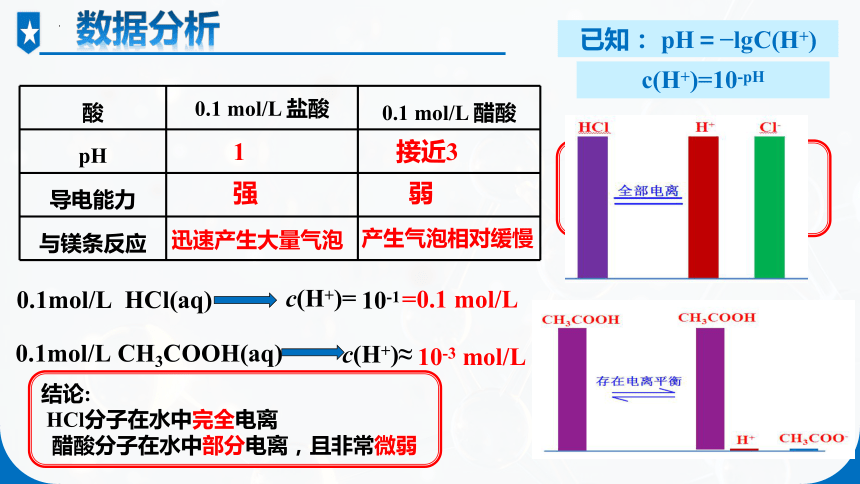
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
与镁条反应
实验3-1
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
与镁条反应
1 接近3
强 弱
迅速产生大量气泡
产生气泡相对缓慢
结论:
HCl在水中的电离程度大于CH3COOH
c(H+)=10-pH
0.1mol/L HCl(aq)
c(H+)=
10-1
=0.1 mol/L
0.1mol/L CH3COOH(aq)
c(H+)≈
10-3 mol/L
结论:
HCl分子在水中完全电离
醋酸分子在水中部分电离,且非常微弱
数据分析
已知: pH= lgC(H+)
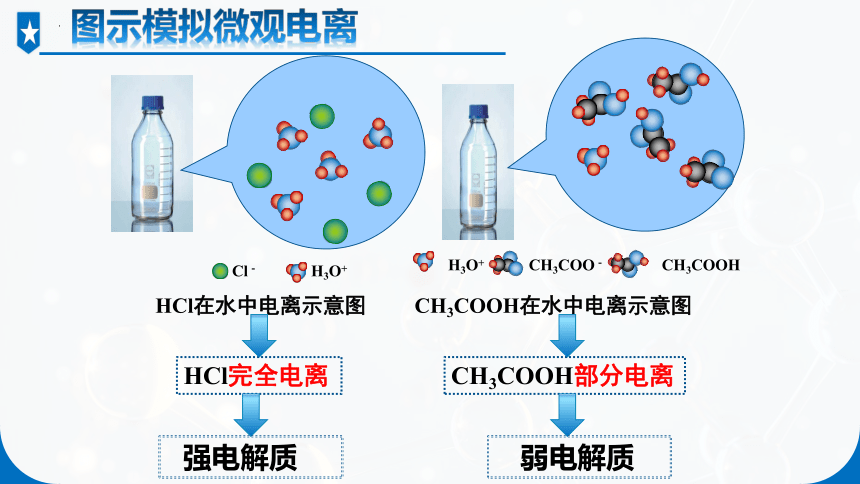
Cl- H3O+
图示模拟微观电离
HCl完全电离
CH3COOH部分电离
HCl在水中电离示意图 CH3COOH在水中电离示意图
H3O+ CH3COO- CH3COOH
强电解质
弱电解质
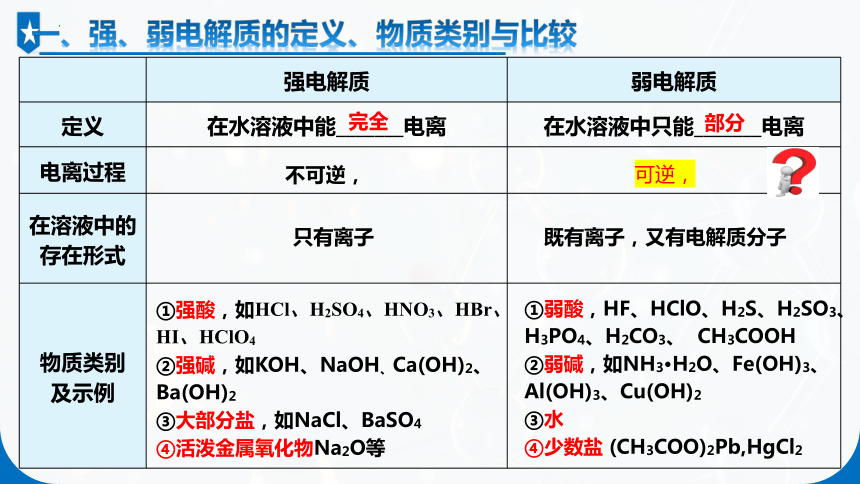
一、强、弱电解质的定义、物质类别与比较
强电解质 弱电解质
定义 在水溶液中能_______电离 在水溶液中只能_______电离
电离过程
在溶液中的 存在形式
物质类别 及示例
完全
部分
不可逆,
可逆,
只有离子
既有离子,又有电解质分子
①强酸,如HCl、H2SO4、HNO3、HBr、 HI、HClO4
②强碱,如KOH、NaOH、Ca(OH)2、Ba(OH)2
③大部分盐,如NaCl、BaSO4
④活泼金属氧化物Na2O等
①弱酸,HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH
②弱碱,如NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2
③水
④少数盐 (CH3COO)2Pb,HgCl2
【例】下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是________,属于非电解质的是_______。
a.铜丝 b.NaCl c.石墨 d.冰醋酸 e.HCl的水溶液 f.蔗糖 g.SO2 h.NaHCO3 i. BaSO4 j.氨水
a c e j
b h i
d
f g
能导电的:金属、石墨、 **溶液、熔融态的**
电解质:酸、碱、盐、金属氧化物、水
非电解质:非金属氧化物、有机物
强电解质:强酸、强碱、盐、金属氧化物
弱电解质:弱酸、弱碱、水
及时练习
化合物
二、电离方程式
强电解质 强酸
强碱
盐 正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl === H+ + Cl-
完全电离,如Ba(OH)2 === Ba2+ + 2OH-
原则:遵循质量守恒、电荷守恒、客观事实
完全电离,如CH3COONH4 = CH3COO - + NH4+
完全电离,如NaHSO4=Na++H++SO42-(水溶液)
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3=Na++HCO3- HCO3- H++CO32-
NaHSO4=Na++H++SO42-(熔融态)
弱电解质 一元弱酸
一元弱碱
H2O
多元弱酸
多元弱碱
二、电离方程式
碱式
酸式
两性氢氧化物双向电离
部分电离,CH3COOH H++CH3COO-
部分电离,NH3·H2O NH4+ + OH -
部分电离,H2O H+ + OH -
分步电离,分步写出,(以第一步电离为主)
H2CO3 H+ +HCO3
HCO3 H+ + CO32
Cu(OH)2 Cu2+ + 2OH
分步电离,一步写出
总结:强等号、弱可逆;多元弱酸分步写;
多元弱碱一步完;酸式盐看强弱、看条件。
任务二:研究弱电解质是如何部分电离的?
猜测1:部分电离就是只有一部分CH3COOH发生电离,另一部分CH3COOH不发生电离;
猜测2:部分电离是指CH3COOH电离生成CH3COO-和H+,而生成的CH3COO-又与H+结合生成CH3COOH
(宏观现象)
(微观本质)
pH变化?
H+与CH3COO 能结合
【设计实验】
如何研究溶液中的H+与CH3COO 能否结合为CH3COOH?
可选试剂:0.1mol/L CH3COOH、CH3COONa溶液(碱性)、
CH3COONa(s)、CH3COONH4溶液(中性)、CH3COONH4(s),
可选仪器:pH计、烧杯、玻璃棒等。
反映
设计实验
向0.1 mol/L CH3COOH溶液中加入CH3COONH4固体,充分搅拌后测pH。
(宏观现象)
溶液pH变大
(微观本质)
c(H+)减小
结论:
弱电解质分子在水溶液存在电离平衡
CH3COOH
CH3COO
+ H+
pH升高,c(H+)下降
CH3COOH
CH3COO
+ H+
实验结果:
任务二:研究弱电解质是如何部分电离的?
H+与CH3COO 能结合
(1)开始时,V电离 和 V结合怎样变化?
(2)当V电离 = V结合时,可逆过程达到一种什么样的状态?画出V~t图。
思考:在一定的条件下,往一杯水中加进一定量的冰醋酸会发生如何的变化?
CH3COOH CH3COO - + H+
电离
结合
三、弱电解质的电离平衡
(HAc Ac- + H+)
化学平衡
电离平衡
知识迁移
c(H+) c(CH3COO-) c(CH3COOH) v(电离) v(结合)
醋酸初溶于水时
接着
最后
0(最小)
0(最小)
最大
增大
最大
0(最小)
增大
减小
减小
增大
不变
不变
不变
不变
不变
电离平衡状态建立
反应速率
V(电离)
V(结合)
V(电离) = V(结合)
电离平衡状态
弱电解质电离平衡状态建立示意图
时间
三、弱电解质的电离平衡
电离平衡是一种动态平衡。
逆:弱电解质的电离是可逆过程
在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时, 电离过程就达到了平衡状态, 这种平衡状态叫做弱电解质的电离平衡。
动:电离平衡是一种动态平衡
定:条件不变,溶液中各分子、离子的浓度不变
变:条件改变时,电离平衡发生移动
等:V电离 = V结合≠0
定义
1
特征
2
三、弱电解质的电离平衡
不是可逆反应
影响电离平衡的因素
(1) 内因:电解质自身性质,电解质越弱电离程度越小
(2) 外因:电离平衡是动态平衡,遵循勒夏特列原理。
影响电离平衡的条件有温度、浓度、电解质(酸碱盐等)
3
三、弱电解质的电离平衡
改 变 条 件 平衡移 动方向 电离
程度
加 热
通HCl(g)
加NaOH (s)
加NaAc (s)
加少量冰醋酸
加水稀释
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
减小
增大
增大
减小
减小
c(H+)
c(Ac-)
c(HAc)
三、弱电解质的电离平衡
H>0
α= —————————×100%
已电离的溶质分子数
原有溶质分子总数
①温度:弱电解质的电离为吸热,升温促使电离平衡正向移动(越热越电离)
影响电离平衡的因素
④离子反应效应:加入能与弱电解质电离产生的某种离子反应的物质时,将促进平衡,向正向移动。
②浓度: 降低浓度,电离平衡向正向移动,因为离子相互碰撞结合为分子的几率减小。(越稀越电离)
③同离子效应:加入与弱电解质具有相同离子的强电解质,将抑制平衡,向逆向移动。
3
三、弱电解质的电离平衡
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
CaCO3是卫生洁具常见的污染物之一。
去污原理如下:
CaCO3 + 2H+ = CO2↑ + H2O + Ca2+
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率。
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度。
学以致用
化学与生活
小孩大哭过后,容易出现抽抽搭搭,停不下来、喘不上气,或者手脚僵硬的情况。
已知人体血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO3-
人体血液的pH需维持在7.35~7.45。
当pH<7.35会导致酸中毒,pH大于7.45会导致碱中毒。
小孩大哭后,呼出大量CO2,平衡状态改变后,发生了轻微碱中毒。
出现轻微碱中毒后,如何缓解中毒症状呢?
直接吸入大量CO2合理吗?
可用纸袋,罩于鼻、口上再呼吸,增加动脉血CO2浓度
会窒息
1.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示:
(3)a、b、c三点对应的溶液中CH3COOH电离程度最大的是______。
(4)若使b点对应的溶液中c(CH3COO-)增大,c(H+)减小,可采用的方法是______(填序号)
① 加入H2O ②加入NaOH固体
③加入浓硫酸 ④ 加入Na2CO3固体
b>a>c
(1)“O”点不能导电的理由________________。
(2)a、b、c三点溶液c(H+)由大到小的顺序为______。
没有自由移动的离子
C
②④
及时练习
知识导航
