化学人教版(2019)选择性必修1 3.2. 2 溶液pH的测定与计算(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.2. 2 溶液pH的测定与计算(共22张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-15 22:57:41 | ||
图片预览








文档简介
(共22张PPT)
3.2. 2 溶液pH的测定与计算
人教版高中化学 选择性必修1
能正确测定溶液pH
能进行溶液pH的简单计算
(一)正确测定溶液的pH
pH计或pH传感器(可识别的pH 差0.01)
pH试纸
广泛:可识别的pH差约为1
精密:可识别pH差为0.2或0.3
方法导引 pH试纸测溶液pH的方法
取一小段pH试纸放在干净的玻璃片或表面皿上,用干燥洁净的玻璃棒蘸取待测液点在试纸的中央,待变色后与标准比色卡进行比对。
注意 测溶液的pH时,试纸不可提前润湿,否则可能导致测定结果产生偏差。
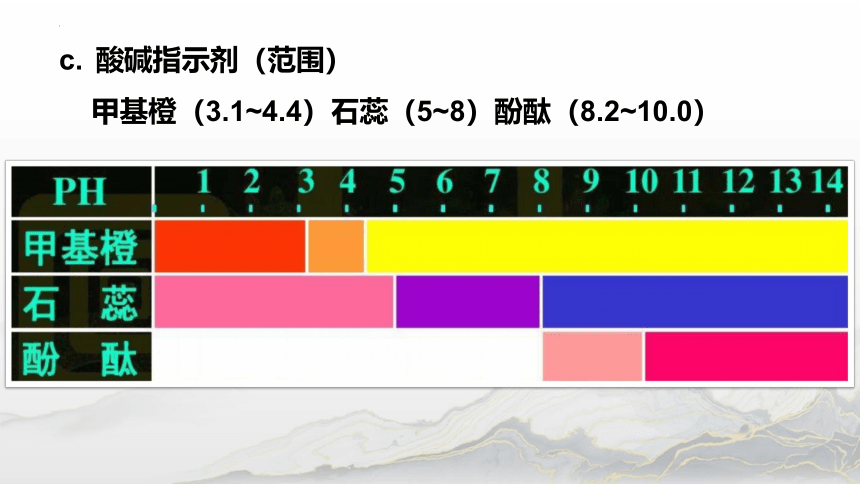
酸碱指示剂(范围)
甲基橙(3.1~4.4)石蕊(5~8)酚酞(8.2~10.0)
难点突破
pH的简单计算
酸碱溶液稀释的定量分析
一般规则
恒等式 c(H+ )c(OH-)水
近似式 若a的数量级比b的数量级大2及以上,则ab
关系式 Kw=c(H+ )c(OH-)
pH=-c(H+ )
一般思路——先判断溶液的酸碱性再分类计算
酸性 c(H+ )
碱性 c(OH-)
中性 c(H+ )c(OH-) n(H+ )n(OH-)
例1 0.001 mol/L盐酸,求溶液的pH
c(H+ )=1 mol/LpH=-c(H+ )=3
例2 常温, 1 mol/L NaOH溶液,求溶液的pH
c(OH-)= 1 mol/L
c(H+ )= 1 mol/L pH=-c(H+ )=10
练习:常温下0.05 mol/L的Ba(OH)2的pH=________
c(OH-)= 1 mol/L
c(H+ )= 1 mol/L pH=-c(H+ )=13
情境体验-全程设计第73页
常温下将pH=8和 pH=10的两种NaOH溶液等体积混合,混合后溶液的pH= ,
变式:常温下将pH=2和 pH=4的两种盐酸等体积混合,混合后溶液的pH= ,
典例剖析
在常温下,将xmL pH=a 的稀盐酸与ymL pH=b的稀NaOH溶液充分反应。下列关于反应后溶液酸碱性的判断,正确的是
A.若x=y, 且a+b=14,则pH>7,溶液呈碱性
B.若10x=y,且a+b=13,则pH=7,溶液呈中性
C.若ax=by,且a+b=13,则pH=7,溶液呈中性
D.若x=10y,且a+b=14,则pH<7,溶液呈酸性
B
常温下 强酸强碱混合后溶液酸碱性分析
盐酸x mL pH=a c(H+ ) 1 mol/L
NaOH溶液 y mL pH=b c(OH-)= 1 mol/L
混合后溶液的酸碱性决定于n(H+ )酸与n(OH-)碱的相对大小
若n(H+ )酸=n(OH-)碱即 =溶液为中性
若n(H+ )酸>n(OH-)碱即 >溶液为酸性
若n(H+ )酸常温下 酸碱强弱混合后溶液酸碱性分析
A酸x mL pH=a c(H+ ) 1 mol/L
B碱 y mL pH=b c(OH-)= 1 mol/L
=
若为强酸与强碱,则溶液为中性
若为强酸与弱碱,则溶液为碱性
若为弱酸与强碱,则溶液为酸性
即谁弱显谁性,同强为中性
学以致用
在常温下,取x mL pH=a 的稀盐酸,用y mL pH=b的稀NaOH溶液恰好完全中和。
(1)若a+b=14,则x:y= ,
(2)若a+b=13,则x:y= ,
(3)若a+b>14,则x:y= ,且x y(填“>”“<”“=”)
随堂训练
1.在室温下,等体积的酸和碱的溶液混合后, pH一定大于7的是( )
A.pH=3的硝酸和pH=11的氢氧化钾溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3的硫酸和pH=11的氢氧化钠溶液
D.pH=3的磷酸和pH=11的氢氧化钾溶液
B
2.室温下,将pH=1的盐酸加水稀释至原体积的10n倍,求稀释后溶液的pH,
若n=1,则稀释后溶液的pH= ,
若n=2,则稀释后溶液的pH= ,
若n=3,则稀释后溶液的pH= ,
若n=4,则稀释后溶液的pH= ,
将酸不断加水稀释,稀释后溶液的pH有可能大于等于7吗?
变式:室温下,将pH=13的氢氧化钠溶液加水稀释至原体积的10n倍,求稀释后溶液的pH,
若n=1,则稀释后溶液的pH= ,
若n=2,则稀释后溶液的pH= ,
若n=3,则稀释后溶液的pH= ,
若n=4,则稀释后溶液的pH= ,
将酸不断加水稀释,稀释后溶液的pH有可能小于等于7吗?
难点突破
pH的简单计算
酸碱溶液稀释的定量分析
常温下 酸碱稀释过程中pH的变化规律
稀释对象 加水稀释至 原体积的10n倍 稀释后溶液的pH
pH=a的强酸 pH=a+n
pH=a的弱酸 apH=b的强碱 pH=b-n
pH=b的弱碱 b-n对酸或碱进行不断稀释,pH只能不断趋近于7。
理解应用 根据pH与稀释倍数的线性关系知
(1)HY为强酸 MOH为强碱
(2)在图1中,水的电离程度为:D>C>A=B
在图1中,溶液导电能力为:A=B>C>D
图1
图2
(3)在图2中,体积相等、pH相同的MOH溶液和ROH溶液中和酸的能力为
ROH>MOH
中和酸的能力决定于碱中n(OH-)碱
中和碱的能力决定于酸中n(H+ )酸
典例分析
某温度下,相同pH的盐酸和醋酸分别加水稀释, pH随溶液体积变化的曲线如图所示。据图判断正确的是( )
Ⅱ为盐酸稀释时变化曲线
N点溶液的导电性比P点溶液的导
电性强
C. M点KW的数值比P点KW的数值大
D. N点酸溶液的总浓度大于M点酸溶液
的总浓度
B
3.2. 2 溶液pH的测定与计算
人教版高中化学 选择性必修1
能正确测定溶液pH
能进行溶液pH的简单计算
(一)正确测定溶液的pH
pH计或pH传感器(可识别的pH 差0.01)
pH试纸
广泛:可识别的pH差约为1
精密:可识别pH差为0.2或0.3
方法导引 pH试纸测溶液pH的方法
取一小段pH试纸放在干净的玻璃片或表面皿上,用干燥洁净的玻璃棒蘸取待测液点在试纸的中央,待变色后与标准比色卡进行比对。
注意 测溶液的pH时,试纸不可提前润湿,否则可能导致测定结果产生偏差。
酸碱指示剂(范围)
甲基橙(3.1~4.4)石蕊(5~8)酚酞(8.2~10.0)
难点突破
pH的简单计算
酸碱溶液稀释的定量分析
一般规则
恒等式 c(H+ )c(OH-)水
近似式 若a的数量级比b的数量级大2及以上,则ab
关系式 Kw=c(H+ )c(OH-)
pH=-c(H+ )
一般思路——先判断溶液的酸碱性再分类计算
酸性 c(H+ )
碱性 c(OH-)
中性 c(H+ )c(OH-) n(H+ )n(OH-)
例1 0.001 mol/L盐酸,求溶液的pH
c(H+ )=1 mol/LpH=-c(H+ )=3
例2 常温, 1 mol/L NaOH溶液,求溶液的pH
c(OH-)= 1 mol/L
c(H+ )= 1 mol/L pH=-c(H+ )=10
练习:常温下0.05 mol/L的Ba(OH)2的pH=________
c(OH-)= 1 mol/L
c(H+ )= 1 mol/L pH=-c(H+ )=13
情境体验-全程设计第73页
常温下将pH=8和 pH=10的两种NaOH溶液等体积混合,混合后溶液的pH= ,
变式:常温下将pH=2和 pH=4的两种盐酸等体积混合,混合后溶液的pH= ,
典例剖析
在常温下,将xmL pH=a 的稀盐酸与ymL pH=b的稀NaOH溶液充分反应。下列关于反应后溶液酸碱性的判断,正确的是
A.若x=y, 且a+b=14,则pH>7,溶液呈碱性
B.若10x=y,且a+b=13,则pH=7,溶液呈中性
C.若ax=by,且a+b=13,则pH=7,溶液呈中性
D.若x=10y,且a+b=14,则pH<7,溶液呈酸性
B
常温下 强酸强碱混合后溶液酸碱性分析
盐酸x mL pH=a c(H+ ) 1 mol/L
NaOH溶液 y mL pH=b c(OH-)= 1 mol/L
混合后溶液的酸碱性决定于n(H+ )酸与n(OH-)碱的相对大小
若n(H+ )酸=n(OH-)碱即 =溶液为中性
若n(H+ )酸>n(OH-)碱即 >溶液为酸性
若n(H+ )酸
A酸x mL pH=a c(H+ ) 1 mol/L
B碱 y mL pH=b c(OH-)= 1 mol/L
=
若为强酸与强碱,则溶液为中性
若为强酸与弱碱,则溶液为碱性
若为弱酸与强碱,则溶液为酸性
即谁弱显谁性,同强为中性
学以致用
在常温下,取x mL pH=a 的稀盐酸,用y mL pH=b的稀NaOH溶液恰好完全中和。
(1)若a+b=14,则x:y= ,
(2)若a+b=13,则x:y= ,
(3)若a+b>14,则x:y= ,且x y(填“>”“<”“=”)
随堂训练
1.在室温下,等体积的酸和碱的溶液混合后, pH一定大于7的是( )
A.pH=3的硝酸和pH=11的氢氧化钾溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3的硫酸和pH=11的氢氧化钠溶液
D.pH=3的磷酸和pH=11的氢氧化钾溶液
B
2.室温下,将pH=1的盐酸加水稀释至原体积的10n倍,求稀释后溶液的pH,
若n=1,则稀释后溶液的pH= ,
若n=2,则稀释后溶液的pH= ,
若n=3,则稀释后溶液的pH= ,
若n=4,则稀释后溶液的pH= ,
将酸不断加水稀释,稀释后溶液的pH有可能大于等于7吗?
变式:室温下,将pH=13的氢氧化钠溶液加水稀释至原体积的10n倍,求稀释后溶液的pH,
若n=1,则稀释后溶液的pH= ,
若n=2,则稀释后溶液的pH= ,
若n=3,则稀释后溶液的pH= ,
若n=4,则稀释后溶液的pH= ,
将酸不断加水稀释,稀释后溶液的pH有可能小于等于7吗?
难点突破
pH的简单计算
酸碱溶液稀释的定量分析
常温下 酸碱稀释过程中pH的变化规律
稀释对象 加水稀释至 原体积的10n倍 稀释后溶液的pH
pH=a的强酸 pH=a+n
pH=a的弱酸 a
pH=b的弱碱 b-n
理解应用 根据pH与稀释倍数的线性关系知
(1)HY为强酸 MOH为强碱
(2)在图1中,水的电离程度为:D>C>A=B
在图1中,溶液导电能力为:A=B>C>D
图1
图2
(3)在图2中,体积相等、pH相同的MOH溶液和ROH溶液中和酸的能力为
ROH>MOH
中和酸的能力决定于碱中n(OH-)碱
中和碱的能力决定于酸中n(H+ )酸
典例分析
某温度下,相同pH的盐酸和醋酸分别加水稀释, pH随溶液体积变化的曲线如图所示。据图判断正确的是( )
Ⅱ为盐酸稀释时变化曲线
N点溶液的导电性比P点溶液的导
电性强
C. M点KW的数值比P点KW的数值大
D. N点酸溶液的总浓度大于M点酸溶液
的总浓度
B
