河北省邯郸市馆陶县第一中学2013-2014学年高中化学选修4专题训练一(B卷,含各地2013年期中、月考试题)
文档属性
| 名称 | 河北省邯郸市馆陶县第一中学2013-2014学年高中化学选修4专题训练一(B卷,含各地2013年期中、月考试题) |  | |
| 格式 | zip | ||
| 文件大小 | 186.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
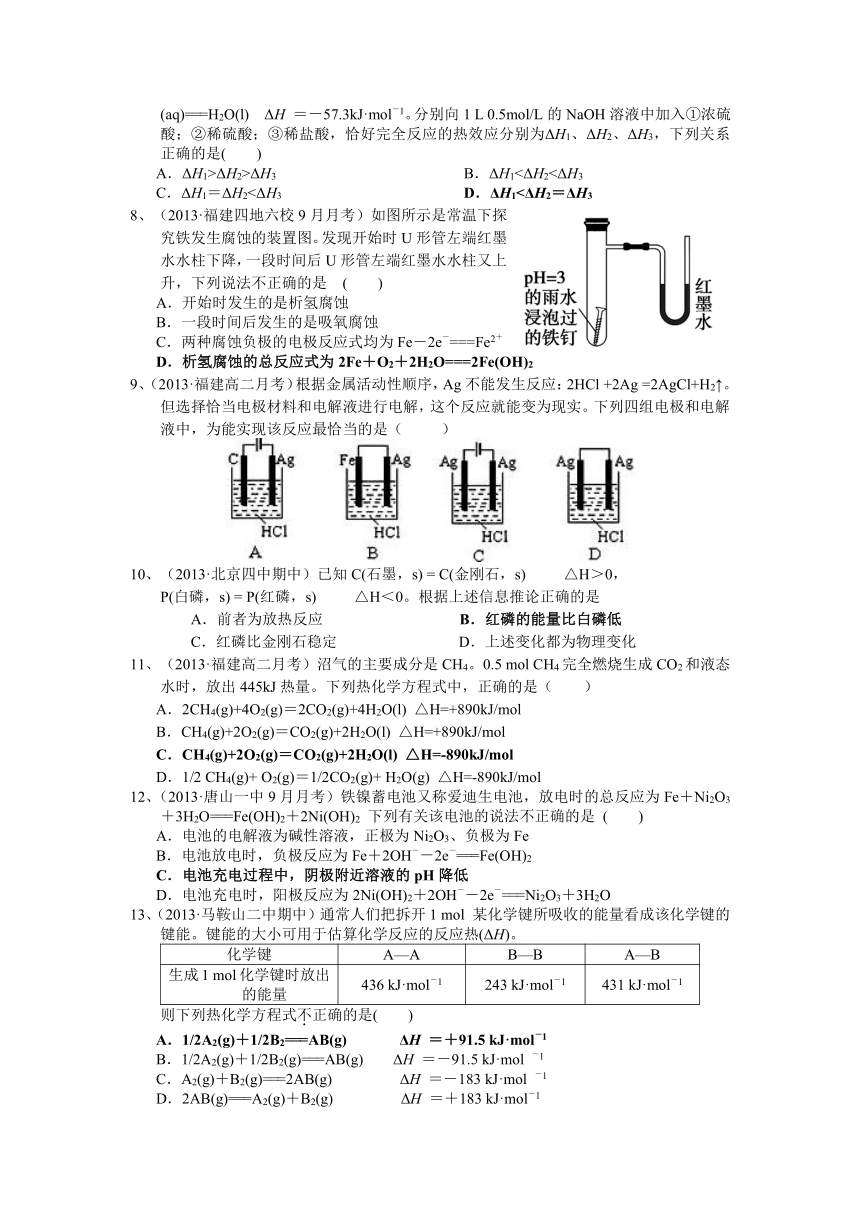
| 更新时间 | 2013-11-10 06:05:19 | ||
图片预览

文档简介
化学选修4复习
专题一测验卷(B卷)
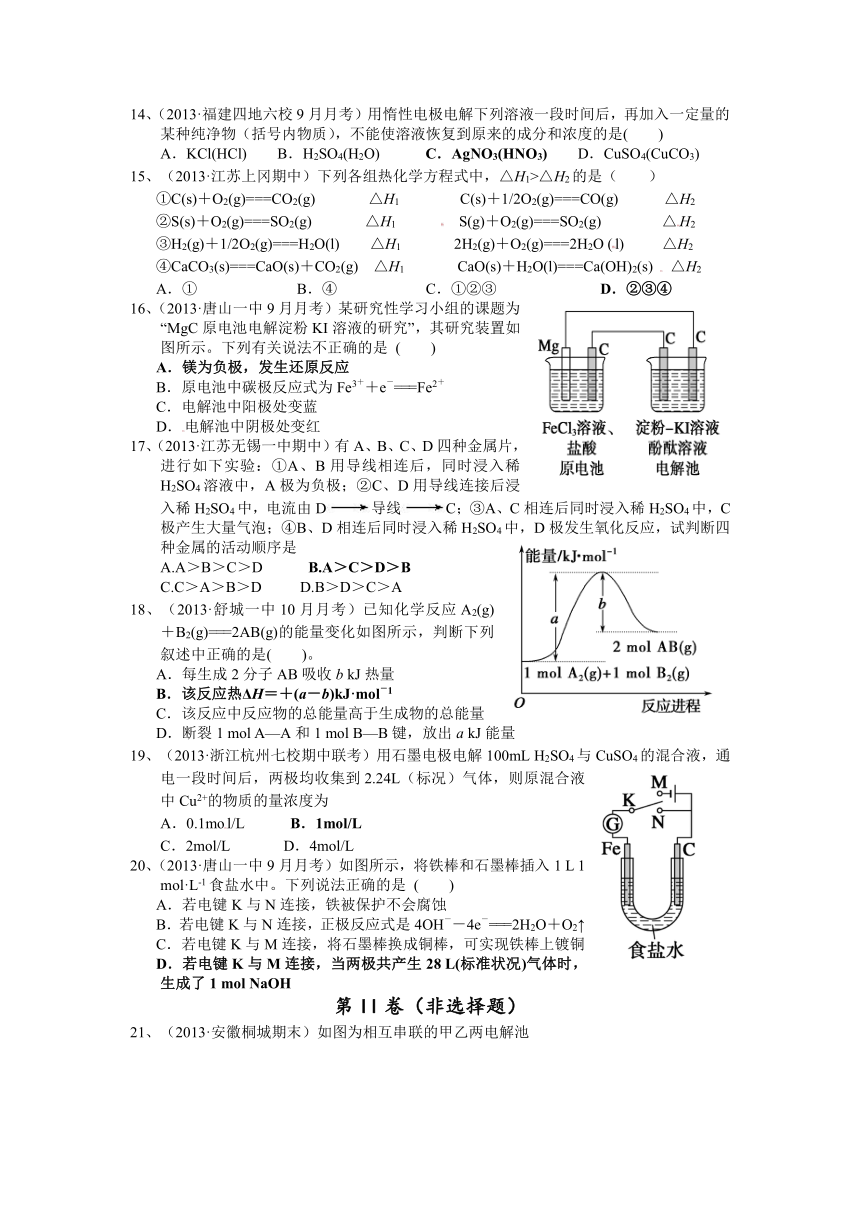
高二化学组
第I卷(选择题)
1、(2013·浙江嘉兴一中期中)以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背低碳经济的是
A.发展氢能和太阳能 B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学 D.尽量用纯液态有机物代替水作溶剂
2、(2013·北京四中期中)能源是当今社会发展的三大支柱之一。有专家提出:如果对燃料燃烧产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为
A.化学能 B.热能 C.生物能 D.电能
3、(2013·唐山一中9月月考)下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
4、(2013·福建高二月考)下列有关金属腐蚀与防护的说法正确的是( )
A.金属被腐蚀的本质是:
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
5、(2013·福建四地六校9月月考)下列变化过程。属于放热反应的是( )
①浓硫酸的稀释 ②碘的升华 ③NaOH固体溶于水 ④氢氧化钡晶体与氯化铵混合
⑤H2在Cl2中燃烧 ⑥Al在高温条件下与Fe2O3?的反应 ⑦酸碱中和反应
A.①③⑤ B.②④⑥ C.⑤⑥⑦ D.①③⑤⑥⑦
6、(2013·江苏沐阳期中)关于如右图所示装置的叙述,正确的是
A.铜是阳极,铜片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
7、(2013·马鞍山二中期中)强酸与强碱的稀溶液发生中和反应的热效应为: H+(aq)+OH-(aq)===H2O(l) ΔH =-57.3kJ·mol-1。分别向1 L 0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,下列关系正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1=ΔH2<ΔH3 D.ΔH1<ΔH2=ΔH3
8、(2013·福建四地六校9月月考)如图所示是常温下探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升,下列说法不正确的是 ( )
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-===Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O===2Fe(OH)2
9、(2013·福建高二月考)根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是( )
10、(2013·北京四中期中)已知C(石墨,s) = C(金刚石,s) △H>0, P(白磷,s) = P(红磷,s) △H<0。根据上述信息推论正确的是 A.前者为放热反应 B.红磷的能量比白磷低 C.红磷比金刚石稳定 D.上述变化都为物理变化
11、(2013·福建高二月考)沼气的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量。下列热化学方程式中,正确的是( )
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=+890kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol
D.1/2 CH4(g)+ O2(g)=1/2CO2(g)+ H2O(g) △H=-890kJ/mol
12、(2013·唐山一中9月月考)铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2 下列有关该电池的说法不正确的是 ( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O
13、(2013·马鞍山二中期中)通常人们把拆开1 mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH)。
化学键
A—A
B—B
A—B
生成1 mol化学键时放出的能量
436 kJ·mol-1
243 kJ·mol-1
431 kJ·mol-1
则下列热化学方程式不正确的是( )
A.1/2A2(g)+1/2B2===AB(g) ΔH =+91.5 kJ·mol-1
B.1/2A2(g)+1/2B2(g)===AB(g) ΔH =-91.5 kJ·mol -1
C.A2(g)+B2(g)===2AB(g) ΔH =-183 kJ·mol -1
D.2AB(g)===A2(g)+B2(g) ΔH =+183 kJ·mol-1
14、(2013·福建四地六校9月月考)用惰性电极电解下列溶液一段时间后,再加入一定量的某种纯净物(括号内物质),不能使溶液恢复到原来的成分和浓度的是( )
A.KCl(HCl) B.H2SO4(H2O) C.AgNO3(HNO3) D.CuSO4(CuCO3)
15、(2013·江苏上冈期中)下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)===CO2(g) △H1 C(s)+1/2O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+1/2O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O (l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.① B.④ C.①②③ D.②③④
16、(2013·唐山一中9月月考)某研究性学习小组的课题为“Mg C原电池电解淀粉 KI溶液的研究”,其研究装置如图所示。下列有关说法不正确的是 ( )
A.镁为负极,发生还原反应
B.原电池中碳极反应式为Fe3++e-===Fe2+
C.电解池中阳极处变蓝
D.电解池中阴极处变红
17、(2013·江苏无锡一中期中)有A、B、C、D四种金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线连接后浸入稀H2SO4中,电流由D导线C;③A、C相连后同时浸入稀H2SO4中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4中,D极发生氧化反应,试判断四种金属的活动顺序是
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>D>C>A
18、(2013·舒城一中10月月考)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )。
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
19、(2013·浙江杭州七校期中联考)用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为
A.0.1mol/L B.1mol/L
C.2mol/L D.4mol/L
20、(2013·唐山一中9月月考)如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是 ( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
第II卷(非选择题)
21、(2013·安徽桐城期末)如图为相互串联的甲乙两电解池
试回答:
(1)甲池若为用电解原理精炼铜的装置,则B是 极,材料是 ,
A电极反应为 。
(2)乙池中若滴入少量石蕊试液,电解一段时间后Fe极附近呈 色.
(3)若甲池为电解精炼铜,阴极增重6.4g,则:乙池中阳极放出的气体在标准状况下的体积为 ;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
22、(2013·福建高二月考)用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题: (1)烧杯间填满碎泡沫塑料的作用是___________________________ (2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”), 其原因是_______________________________________________________。 (3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是______________________。 实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ _____(填“相等”“不相等”),若实验操作均正确,则所求中和热________________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:__________________________________。
23、(2013·江苏无锡一中期中)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中化学反应方程式为
_____________________ 。
在X极附近观察到的现象______________________________ ②检验Y电极上反应产物的方法是______________________________ 。
③当导线中有0.1 mol的电子通过时,在标况下理论上两极可收集的气体的体积共
L
(2)如要用电解方法精炼含有少量Zn 、Fe、 Ag、Au杂质的粗铜,电解液a选用CuSO4溶液,则X电极的材料是______________,此电极反应式为______________________。
(3) 若想利用此装置在铁上镀银,则电解液a可以选用 ,Y极上的电极反应式为
24、(2012·南京师大附中期中)如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极, A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是 ,Na+移向 极(填A、B)
②B电极上的电极反应式为 ,
总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。[ PH=-lgC(H+) ]
25、(2013·江苏无锡一中期中)(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________ 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molNN键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:负极_________________________,正极_____________________________。
专题一B卷 参考答案
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
C
B
C
D
D
D
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
C
C
A
C
D
A
B
B
B
D
21、(1)阳极;粗铜;Cu2++2 e- = Cu ;(2)蓝;
(3)2.24L;0。5mol/L
22、(1)减少热量损失(2分) (2)不能(2分) ①铁会和盐酸反应 ②铁导热性好,热量损失较大(2分) (3)为了确保盐酸完全被中和(2分) 不相等(2分) 相等(2分) (4)NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) △H=-57.3kJ/mol (3分)
23、(1) ①2 H2O+2NaCl===H2↑ + Cl2↑+2NaOH;有无色的气泡冒出,溶液变红。
② 用湿润的淀粉KI试纸靠近Y极气体的出口,看其是否变蓝。
③ 2.24 L
(2) 纯铜,电极反应式为 Cu2++2e-===Cu 。
(3) AgNO3溶液, Ag- e-=== Ag+
24、(1)负 Zn-2e-=Zn2+ O2+2H2O+4e-=4OH-
(2)①溶液变红 A ②2Cl- - 2e-=Cl2↑
2NaCl+2H2O ===2NaOH+Cl2↑+H2↑
③ 12 HCl气体
(3)纯铜 Cu2++2e-=Cu 减小
25、(1) 1022kJ (2) TiO2(s)+2Cl2(g) +2C(s) ===TiCl4(l)+ 2CO(g) ΔH=-81 kJ·mol-1
(3) 724kJ
(4)化学能转化为 电能
负 极2H2-4e-==4H+,正极 O2+4e-+4H+=== 2H2O
专题一测验卷(B卷)
高二化学组
第I卷(选择题)
1、(2013·浙江嘉兴一中期中)以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背低碳经济的是
A.发展氢能和太阳能 B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学 D.尽量用纯液态有机物代替水作溶剂
2、(2013·北京四中期中)能源是当今社会发展的三大支柱之一。有专家提出:如果对燃料燃烧产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为
A.化学能 B.热能 C.生物能 D.电能
3、(2013·唐山一中9月月考)下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
4、(2013·福建高二月考)下列有关金属腐蚀与防护的说法正确的是( )
A.金属被腐蚀的本质是:
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
5、(2013·福建四地六校9月月考)下列变化过程。属于放热反应的是( )
①浓硫酸的稀释 ②碘的升华 ③NaOH固体溶于水 ④氢氧化钡晶体与氯化铵混合
⑤H2在Cl2中燃烧 ⑥Al在高温条件下与Fe2O3?的反应 ⑦酸碱中和反应
A.①③⑤ B.②④⑥ C.⑤⑥⑦ D.①③⑤⑥⑦
6、(2013·江苏沐阳期中)关于如右图所示装置的叙述,正确的是
A.铜是阳极,铜片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
7、(2013·马鞍山二中期中)强酸与强碱的稀溶液发生中和反应的热效应为: H+(aq)+OH-(aq)===H2O(l) ΔH =-57.3kJ·mol-1。分别向1 L 0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,下列关系正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1=ΔH2<ΔH3 D.ΔH1<ΔH2=ΔH3
8、(2013·福建四地六校9月月考)如图所示是常温下探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升,下列说法不正确的是 ( )
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-===Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O===2Fe(OH)2
9、(2013·福建高二月考)根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是( )
10、(2013·北京四中期中)已知C(石墨,s) = C(金刚石,s) △H>0, P(白磷,s) = P(红磷,s) △H<0。根据上述信息推论正确的是 A.前者为放热反应 B.红磷的能量比白磷低 C.红磷比金刚石稳定 D.上述变化都为物理变化
11、(2013·福建高二月考)沼气的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量。下列热化学方程式中,正确的是( )
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=+890kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol
D.1/2 CH4(g)+ O2(g)=1/2CO2(g)+ H2O(g) △H=-890kJ/mol
12、(2013·唐山一中9月月考)铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2 下列有关该电池的说法不正确的是 ( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O
13、(2013·马鞍山二中期中)通常人们把拆开1 mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH)。
化学键
A—A
B—B
A—B
生成1 mol化学键时放出的能量
436 kJ·mol-1
243 kJ·mol-1
431 kJ·mol-1
则下列热化学方程式不正确的是( )
A.1/2A2(g)+1/2B2===AB(g) ΔH =+91.5 kJ·mol-1
B.1/2A2(g)+1/2B2(g)===AB(g) ΔH =-91.5 kJ·mol -1
C.A2(g)+B2(g)===2AB(g) ΔH =-183 kJ·mol -1
D.2AB(g)===A2(g)+B2(g) ΔH =+183 kJ·mol-1
14、(2013·福建四地六校9月月考)用惰性电极电解下列溶液一段时间后,再加入一定量的某种纯净物(括号内物质),不能使溶液恢复到原来的成分和浓度的是( )
A.KCl(HCl) B.H2SO4(H2O) C.AgNO3(HNO3) D.CuSO4(CuCO3)
15、(2013·江苏上冈期中)下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)===CO2(g) △H1 C(s)+1/2O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+1/2O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O (l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.① B.④ C.①②③ D.②③④
16、(2013·唐山一中9月月考)某研究性学习小组的课题为“Mg C原电池电解淀粉 KI溶液的研究”,其研究装置如图所示。下列有关说法不正确的是 ( )
A.镁为负极,发生还原反应
B.原电池中碳极反应式为Fe3++e-===Fe2+
C.电解池中阳极处变蓝
D.电解池中阴极处变红
17、(2013·江苏无锡一中期中)有A、B、C、D四种金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线连接后浸入稀H2SO4中,电流由D导线C;③A、C相连后同时浸入稀H2SO4中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4中,D极发生氧化反应,试判断四种金属的活动顺序是
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>D>C>A
18、(2013·舒城一中10月月考)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )。
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
19、(2013·浙江杭州七校期中联考)用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为
A.0.1mol/L B.1mol/L
C.2mol/L D.4mol/L
20、(2013·唐山一中9月月考)如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是 ( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
第II卷(非选择题)
21、(2013·安徽桐城期末)如图为相互串联的甲乙两电解池
试回答:
(1)甲池若为用电解原理精炼铜的装置,则B是 极,材料是 ,
A电极反应为 。
(2)乙池中若滴入少量石蕊试液,电解一段时间后Fe极附近呈 色.
(3)若甲池为电解精炼铜,阴极增重6.4g,则:乙池中阳极放出的气体在标准状况下的体积为 ;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
22、(2013·福建高二月考)用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题: (1)烧杯间填满碎泡沫塑料的作用是___________________________ (2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”), 其原因是_______________________________________________________。 (3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是______________________。 实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ _____(填“相等”“不相等”),若实验操作均正确,则所求中和热________________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:__________________________________。
23、(2013·江苏无锡一中期中)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中化学反应方程式为
_____________________ 。
在X极附近观察到的现象______________________________ ②检验Y电极上反应产物的方法是______________________________ 。
③当导线中有0.1 mol的电子通过时,在标况下理论上两极可收集的气体的体积共
L
(2)如要用电解方法精炼含有少量Zn 、Fe、 Ag、Au杂质的粗铜,电解液a选用CuSO4溶液,则X电极的材料是______________,此电极反应式为______________________。
(3) 若想利用此装置在铁上镀银,则电解液a可以选用 ,Y极上的电极反应式为
24、(2012·南京师大附中期中)如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极, A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是 ,Na+移向 极(填A、B)
②B电极上的电极反应式为 ,
总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。[ PH=-lgC(H+) ]
25、(2013·江苏无锡一中期中)(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________ 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molNN键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:负极_________________________,正极_____________________________。
专题一B卷 参考答案
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
C
B
C
D
D
D
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
C
C
A
C
D
A
B
B
B
D
21、(1)阳极;粗铜;Cu2++2 e- = Cu ;(2)蓝;
(3)2.24L;0。5mol/L
22、(1)减少热量损失(2分) (2)不能(2分) ①铁会和盐酸反应 ②铁导热性好,热量损失较大(2分) (3)为了确保盐酸完全被中和(2分) 不相等(2分) 相等(2分) (4)NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) △H=-57.3kJ/mol (3分)
23、(1) ①2 H2O+2NaCl===H2↑ + Cl2↑+2NaOH;有无色的气泡冒出,溶液变红。
② 用湿润的淀粉KI试纸靠近Y极气体的出口,看其是否变蓝。
③ 2.24 L
(2) 纯铜,电极反应式为 Cu2++2e-===Cu 。
(3) AgNO3溶液, Ag- e-=== Ag+
24、(1)负 Zn-2e-=Zn2+ O2+2H2O+4e-=4OH-
(2)①溶液变红 A ②2Cl- - 2e-=Cl2↑
2NaCl+2H2O ===2NaOH+Cl2↑+H2↑
③ 12 HCl气体
(3)纯铜 Cu2++2e-=Cu 减小
25、(1) 1022kJ (2) TiO2(s)+2Cl2(g) +2C(s) ===TiCl4(l)+ 2CO(g) ΔH=-81 kJ·mol-1
(3) 724kJ
(4)化学能转化为 电能
负 极2H2-4e-==4H+,正极 O2+4e-+4H+=== 2H2O
