化学人教版(2019)必修第一册3.1.4 Fe2+ 和Fe3+ 的相互转化(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.4 Fe2+ 和Fe3+ 的相互转化(共17张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 00:00:00 | ||
图片预览



文档简介
(共17张PPT)
第三章 铁 金属材料
第一节 铁及其化合物
第Ⅳ课时 Fe2+和Fe3+的相互转化
掌握复习Fe2+和Fe3+的相互转化;
能够运用守恒观念解决铁及其化合物的相关计算。
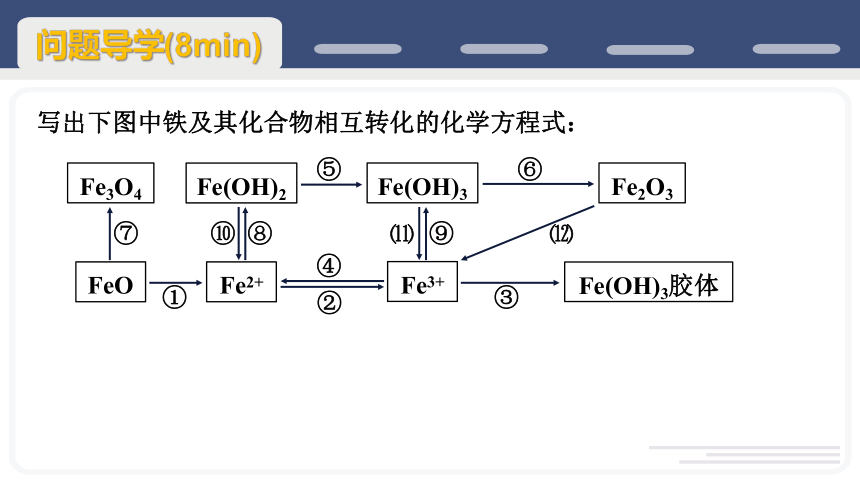
写出下图中铁及其化合物相互转化的化学方程式:
FeO
Fe2+
Fe3+
Fe(OH)3胶体
Fe(OH)2
Fe(OH)3
Fe2O3
Fe3O4
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
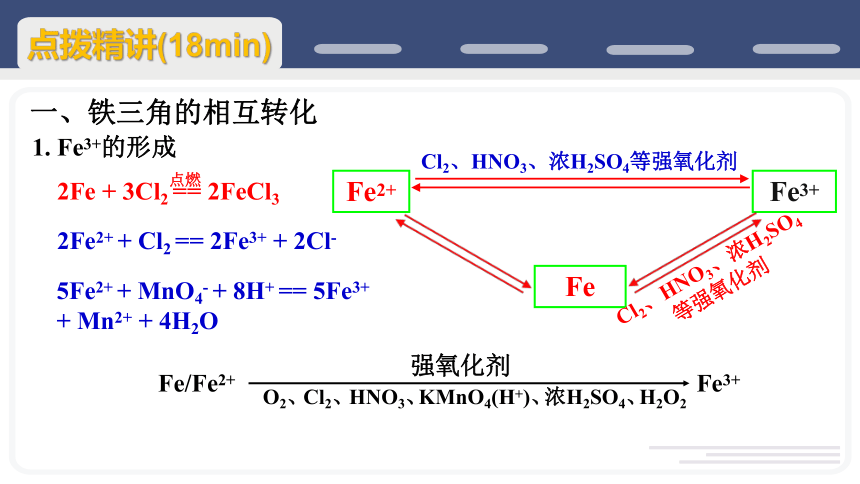
一、铁三角的相互转化
Fe2+
Fe3+
Fe
1. Fe3+的形成
Cl2、HNO3、浓H2SO4
等强氧化剂
2Fe + 3Cl2 == 2FeCl3
点燃
Cl2、
HNO3、
KMnO4(H+)、
浓H2SO4、
H2O2
O2、
Fe/Fe2+
Fe3+
强氧化剂
Cl2、HNO3、浓H2SO4等强氧化剂
2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
5Fe2+ + MnO4- + 8H+ == 5Fe3+ + Mn2+ + 4H2O
Fe2+
Fe3+
Fe
一、铁三角的相互转化
2. Fe2+的形成
H+、Cu2+、Fe3+等
弱氧化剂
Fe、Cu、I-
Fe
Fe2+
弱氧化剂
H+、
Cu2+、
Fe3+
S、
Fe + 2H+ == Fe2+ + H2↑
Fe + Cu2+ == Fe2+ + Cu
Fe + 2Fe3+ == 3Fe2+
Fe + S == FeS
△
Cu + 2Fe3+ == Cu2+ + 2Fe2+
Fe、
Cu、
I-
Ag、
Fe3+
Fe2+
弱还原剂
2Fe3+ +2I- == 2Fe2+ +I2
Fe2+
Fe3+
Fe
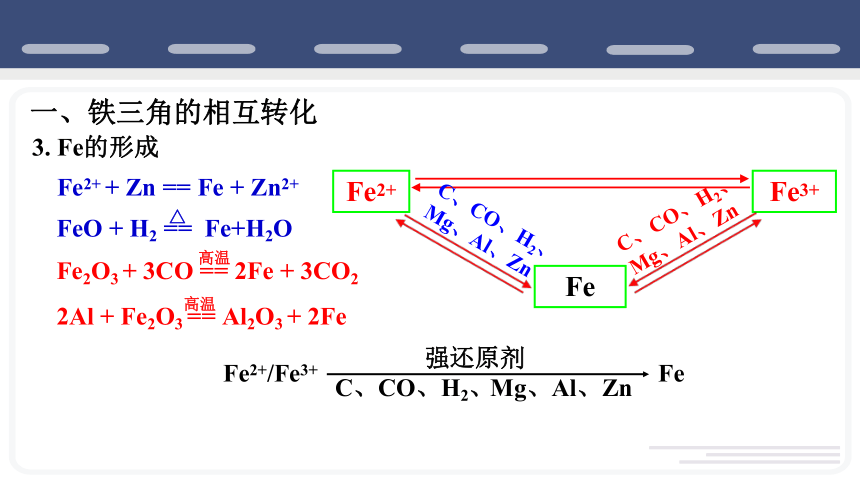
一、铁三角的相互转化
3. Fe的形成
C、CO、H2、
Mg、Al、Zn
Fe2+/Fe3+
Fe
强还原剂
C、CO、H2、
Mg、Al、Zn
高温
Fe2O3 + 3CO == 2Fe + 3CO2
2Al + Fe2O3 == Al2O3 + 2Fe
高温
C、CO、H2、
Mg、Al、Zn
FeO + H2 == Fe+H2O
△
Fe2+ + Zn == Fe + Zn2+
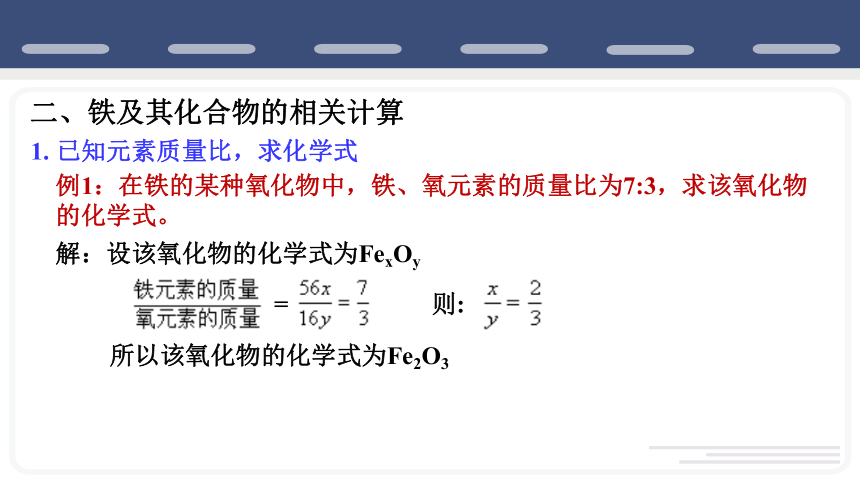
二、铁及其化合物的相关计算
1. 已知元素质量比,求化学式
例1:在铁的某种氧化物中,铁、氧元素的质量比为7:3,求该氧化物的化学式。
解:设该氧化物的化学式为FexOy
=
则:
所以该氧化物的化学式为Fe2O3
2. 利用元素的质量分数求化学式
解:设该氧化物的化学式为FexOy
例2:某铁的氧化物中,含氧元素的质量分数为30%。求化学式。
氧元素的质量分数为:
= 30%
则:
所以该氧化物的化学式为Fe2O3
3. 已知化学式,比较元素质量分数的大小
例3:在下列各种化合物中,铁元素的质量分数最小的是
A. FeO B. Fe2O3 C. Fe3O4
解法一:
FeO:铁元素的质量分数 =
Fe2O3:铁元素的质量分数 =
Fe3O4:铁元素的质量分数 =
= 78%
= 70%
= 72%
3. 已知化学式,比较元素质量分数的大小
例3:在下列各种化合物中,铁元素的质量分数最小的是
A. FeO B. Fe2O3 C. Fe3O4
解法二:观察各个化学式,上述三个化学式可以进一步转化
A. FeO B. FeO C. FeO
得出通式: FeOx
在FeOx中铁元素的质量分数=
比较铁元素质量分数的大小,只要比较x的大小就行。x越大,分式的值就越小。所以铁元素的质量分数由大到小的顺序是:A > C > B
4. 利用元素的质量求化学式
例4:在用CO还原某铁的氧化物的实验中,反应完全后,直玻璃管中的固体质量由1.60g变成1.12g,求铁的氧化物的化学式。
解:设该铁的氧化物的化学式为FexOy
氧化物的质量为1.60g,铁元素的质量为1.12g
氧元素的质量为(1.60g -1.12g)g
所以该铁的氧化物的化学式为Fe2O3
解得:
5. 利用元素守恒
例5:向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标况)气体,所得溶液加KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的混合物,能得到铁
A. 11.2g B. 2.8g C. 5.6g D. 无法计算
解:反应后溶液为FeCl2溶液,根据氯元素守恒可知:
n(FeCl2) = 0.5n(HCl) = 0.5×0.1L×1mol/L = 0.05mol,
根据铁元素守恒可知n(Fe) = n(FeCl2) = 0.05mol,质量为0.05mol×56g/mol=2.8g。
一、铁三角的相互转化
Cl2、HNO3、浓H2SO4等强氧化剂
Fe2+
Fe3+
Fe
H+、Cu2+、Fe3+
等弱氧化剂
Cl2、HNO3、浓H2SO4
等强氧化剂
Fe、Cu、I-
C、CO、H2、
Mg、Al、Zn
C、CO、H2、
Mg、Al、Zn
二、铁及其化合物的相关计算
1. 在铁的某种氧化物中,铁、氧元素的质量比为7:2,求该氧化物的化学式
A. FeO B. Fe2O3 C. Fe3O4 D. Fe5O7
2. 下列化合物中,铁元素的质量分数最小的是
A. FeCl2 B. Fe2O3 C. Fe3O4 D. FeS
3. 向一定量的Cu、Fe2O3的混合物中加入300 mL 1 mol/L的HCl溶液,恰好使混合物完全溶解,所得溶液中加入KSCN溶液后无红色出现,若用过量的CO在高温下还原相同质量的此混合物,固体的质量减少了
A. 6.4 g B. 4.8 g C. 2.4 g D. 1.6 g
【答案】AAC
4. 某学生设计了一个制取氢氧化亚铁的实验方案,实验装置见图,请分析实验过程:
(1)在B试管中加入NaOH溶液后加热煮沸1-2分钟立即加入2mL液体石蜡,该操作目的是____________________。
(2)在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉过量_________________________。
(3)连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时A试管中的现象为_____________,原因是_______________________________ 。试管B中的现象____________________________________________。
(4)若试管B中生成的氢氧化亚铁遇到空气,发生反应的化学方程式是__________________________。
(1)除去溶解在NaOH溶液中的O2,防止O2再进入溶液
(2)保证溶液中不存在Fe3+
(3)A试管中溶液经导管压入B试管 因为生成的H2产生了压强
产生白色沉淀
(4)4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
Thank you!
第三章 铁 金属材料
第一节 铁及其化合物
第Ⅳ课时 Fe2+和Fe3+的相互转化
掌握复习Fe2+和Fe3+的相互转化;
能够运用守恒观念解决铁及其化合物的相关计算。
写出下图中铁及其化合物相互转化的化学方程式:
FeO
Fe2+
Fe3+
Fe(OH)3胶体
Fe(OH)2
Fe(OH)3
Fe2O3
Fe3O4
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
一、铁三角的相互转化
Fe2+
Fe3+
Fe
1. Fe3+的形成
Cl2、HNO3、浓H2SO4
等强氧化剂
2Fe + 3Cl2 == 2FeCl3
点燃
Cl2、
HNO3、
KMnO4(H+)、
浓H2SO4、
H2O2
O2、
Fe/Fe2+
Fe3+
强氧化剂
Cl2、HNO3、浓H2SO4等强氧化剂
2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
5Fe2+ + MnO4- + 8H+ == 5Fe3+ + Mn2+ + 4H2O
Fe2+
Fe3+
Fe
一、铁三角的相互转化
2. Fe2+的形成
H+、Cu2+、Fe3+等
弱氧化剂
Fe、Cu、I-
Fe
Fe2+
弱氧化剂
H+、
Cu2+、
Fe3+
S、
Fe + 2H+ == Fe2+ + H2↑
Fe + Cu2+ == Fe2+ + Cu
Fe + 2Fe3+ == 3Fe2+
Fe + S == FeS
△
Cu + 2Fe3+ == Cu2+ + 2Fe2+
Fe、
Cu、
I-
Ag、
Fe3+
Fe2+
弱还原剂
2Fe3+ +2I- == 2Fe2+ +I2
Fe2+
Fe3+
Fe
一、铁三角的相互转化
3. Fe的形成
C、CO、H2、
Mg、Al、Zn
Fe2+/Fe3+
Fe
强还原剂
C、CO、H2、
Mg、Al、Zn
高温
Fe2O3 + 3CO == 2Fe + 3CO2
2Al + Fe2O3 == Al2O3 + 2Fe
高温
C、CO、H2、
Mg、Al、Zn
FeO + H2 == Fe+H2O
△
Fe2+ + Zn == Fe + Zn2+
二、铁及其化合物的相关计算
1. 已知元素质量比,求化学式
例1:在铁的某种氧化物中,铁、氧元素的质量比为7:3,求该氧化物的化学式。
解:设该氧化物的化学式为FexOy
=
则:
所以该氧化物的化学式为Fe2O3
2. 利用元素的质量分数求化学式
解:设该氧化物的化学式为FexOy
例2:某铁的氧化物中,含氧元素的质量分数为30%。求化学式。
氧元素的质量分数为:
= 30%
则:
所以该氧化物的化学式为Fe2O3
3. 已知化学式,比较元素质量分数的大小
例3:在下列各种化合物中,铁元素的质量分数最小的是
A. FeO B. Fe2O3 C. Fe3O4
解法一:
FeO:铁元素的质量分数 =
Fe2O3:铁元素的质量分数 =
Fe3O4:铁元素的质量分数 =
= 78%
= 70%
= 72%
3. 已知化学式,比较元素质量分数的大小
例3:在下列各种化合物中,铁元素的质量分数最小的是
A. FeO B. Fe2O3 C. Fe3O4
解法二:观察各个化学式,上述三个化学式可以进一步转化
A. FeO B. FeO C. FeO
得出通式: FeOx
在FeOx中铁元素的质量分数=
比较铁元素质量分数的大小,只要比较x的大小就行。x越大,分式的值就越小。所以铁元素的质量分数由大到小的顺序是:A > C > B
4. 利用元素的质量求化学式
例4:在用CO还原某铁的氧化物的实验中,反应完全后,直玻璃管中的固体质量由1.60g变成1.12g,求铁的氧化物的化学式。
解:设该铁的氧化物的化学式为FexOy
氧化物的质量为1.60g,铁元素的质量为1.12g
氧元素的质量为(1.60g -1.12g)g
所以该铁的氧化物的化学式为Fe2O3
解得:
5. 利用元素守恒
例5:向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标况)气体,所得溶液加KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的混合物,能得到铁
A. 11.2g B. 2.8g C. 5.6g D. 无法计算
解:反应后溶液为FeCl2溶液,根据氯元素守恒可知:
n(FeCl2) = 0.5n(HCl) = 0.5×0.1L×1mol/L = 0.05mol,
根据铁元素守恒可知n(Fe) = n(FeCl2) = 0.05mol,质量为0.05mol×56g/mol=2.8g。
一、铁三角的相互转化
Cl2、HNO3、浓H2SO4等强氧化剂
Fe2+
Fe3+
Fe
H+、Cu2+、Fe3+
等弱氧化剂
Cl2、HNO3、浓H2SO4
等强氧化剂
Fe、Cu、I-
C、CO、H2、
Mg、Al、Zn
C、CO、H2、
Mg、Al、Zn
二、铁及其化合物的相关计算
1. 在铁的某种氧化物中,铁、氧元素的质量比为7:2,求该氧化物的化学式
A. FeO B. Fe2O3 C. Fe3O4 D. Fe5O7
2. 下列化合物中,铁元素的质量分数最小的是
A. FeCl2 B. Fe2O3 C. Fe3O4 D. FeS
3. 向一定量的Cu、Fe2O3的混合物中加入300 mL 1 mol/L的HCl溶液,恰好使混合物完全溶解,所得溶液中加入KSCN溶液后无红色出现,若用过量的CO在高温下还原相同质量的此混合物,固体的质量减少了
A. 6.4 g B. 4.8 g C. 2.4 g D. 1.6 g
【答案】AAC
4. 某学生设计了一个制取氢氧化亚铁的实验方案,实验装置见图,请分析实验过程:
(1)在B试管中加入NaOH溶液后加热煮沸1-2分钟立即加入2mL液体石蜡,该操作目的是____________________。
(2)在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉过量_________________________。
(3)连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时A试管中的现象为_____________,原因是_______________________________ 。试管B中的现象____________________________________________。
(4)若试管B中生成的氢氧化亚铁遇到空气,发生反应的化学方程式是__________________________。
(1)除去溶解在NaOH溶液中的O2,防止O2再进入溶液
(2)保证溶液中不存在Fe3+
(3)A试管中溶液经导管压入B试管 因为生成的H2产生了压强
产生白色沉淀
(4)4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
Thank you!
