第1章 第2节 离子反应(共31张ppt)
文档属性
| 名称 | 第1章 第2节 离子反应(共31张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 00:00:00 | ||
图片预览








文档简介
(共31张PPT)
第一章
物质及其变化
第二节 离子反应
内容索引
学习目标
活动方案
课堂反馈
1. 认识电解质,会书写强酸、强碱和可溶性盐的电离方程式。
2. 通过实验事实认识离子反应及其发生的条件,能正确书写有关离子方程式。
1. 带电粒子在电场作用下定向移动,可以形成电流。为什么金属能导电,而木棒、橡胶不能导电?
【答案】 金属内有可自由移动的电子,在电场作用下定向移动,形成电流。而木棒、橡胶中没有可自由移动的带电粒子。
活动一:认识电解质的电离
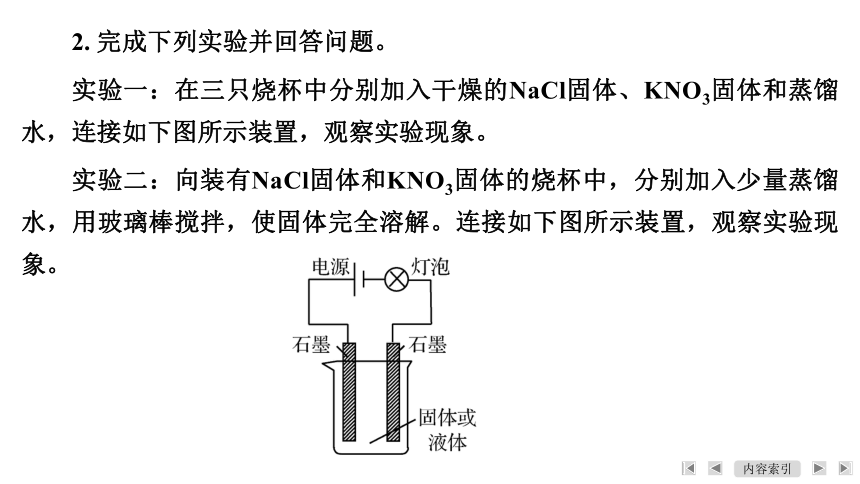
2. 完成下列实验并回答问题。
实验一:在三只烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,连接如下图所示装置,观察实验现象。
实验二:向装有NaCl固体和KNO3固体的烧杯中,分别加入少量蒸馏水,用玻璃棒搅拌,使固体完全溶解。连接如下图所示装置,观察实验现象。
(1) 实验一、二中分别观察到什么实验现象?当灯泡发光说明什么问题?
【答案】 实验一中灯泡都不发光,实验二中灯泡都发光。实验二中灯泡发光说明NaCl溶液和KNO3溶液中存在可自由移动的带电粒子。
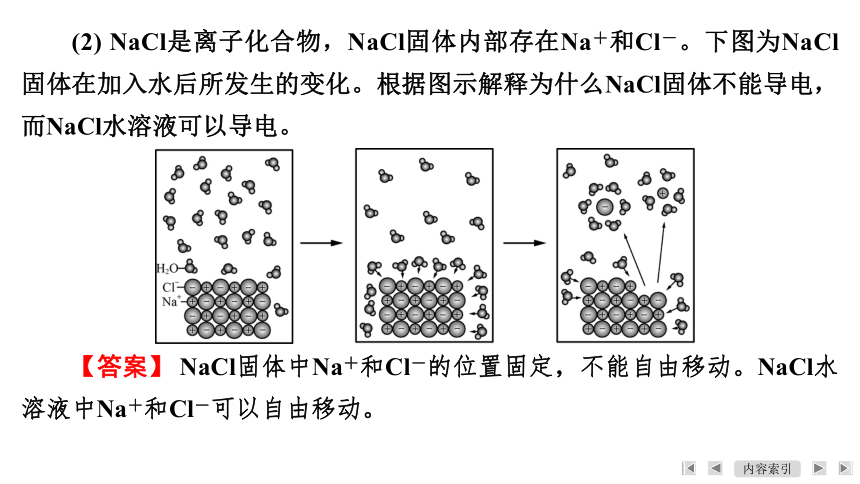
(2) NaCl是离子化合物,NaCl固体内部存在Na+和Cl-。下图为NaCl固体在加入水后所发生的变化。根据图示解释为什么NaCl固体不能导电,而NaCl水溶液可以导电。
【答案】 NaCl固体中Na+和Cl-的位置固定,不能自由移动。NaCl水溶液中Na+和Cl-可以自由移动。
(3) 我们在初中做过盐酸、NaOH溶液的导电性实验。将NaCl固体和KNO3固体加热至熔化,也能导电。这种在水溶液或熔融状态下能够导电的化合物叫作电解质。根据实验判断,哪些物质属于电解质,它们分别代表哪些类型的物质?
【答案】 NaCl、KNO3、HCl、NaOH和水都是电解质。它们分别代表盐、盐、酸、碱和水。
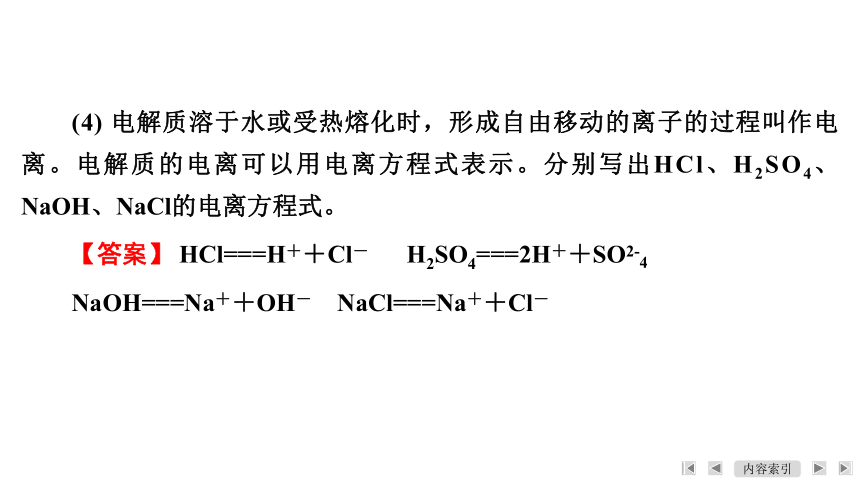
(4) 电解质溶于水或受热熔化时,形成自由移动的离子的过程叫作电离。电解质的电离可以用电离方程式表示。分别写出HCl、H2SO4、NaOH、NaCl的电离方程式。
【答案】 HCl===H++Cl- H2SO4===2H++SO2-4
NaOH===Na++OH- NaCl===Na++Cl-
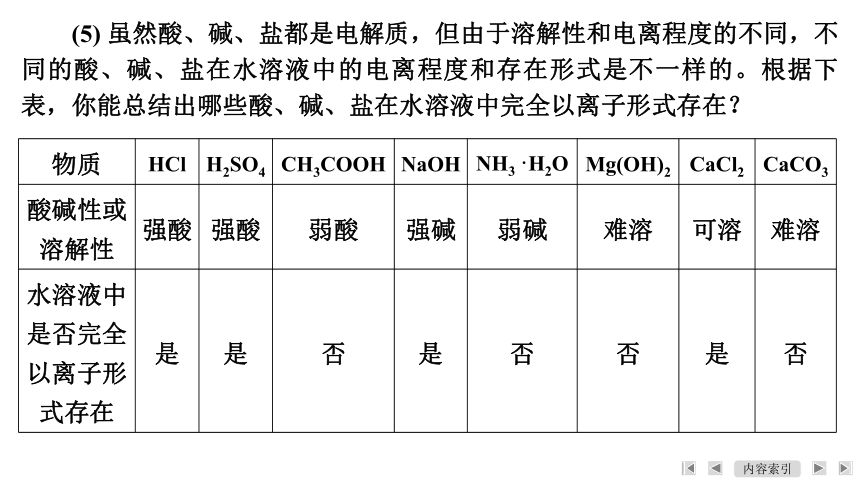
(5) 虽然酸、碱、盐都是电解质,但由于溶解性和电离程度的不同,不同的酸、碱、盐在水溶液中的电离程度和存在形式是不一样的。根据下表,你能总结出哪些酸、碱、盐在水溶液中完全以离子形式存在?
物质 HCl H2SO4 CH3COOH NaOH NH3·H2O Mg(OH)2 CaCl2 CaCO3
酸碱性或溶解性 强酸 强酸 弱酸 强碱 弱碱 难溶 可溶 难溶
水溶液中是否完全以离子形式存在 是 是 否 是 否 否 是 否
【答案】 强酸、强碱、可溶性盐在水溶液中完全电离,以离子形式存在。
1. 完成下列4组实验,观察并记录产生的现象,并仿照NaOH和HCl的反应,分析发生变化和没有变化的离子,用实际参加反应的离子符号来表示化学反应(即离子方程式)。下图是氢氧化钠溶液和盐酸反应实质的微观示意图(供分析参考)。
活动二:探究离子反应的条件,正确书写离子方程式
组别 溶液中
的溶质 实验现象 发生变
化的离子 没有变
化的离子 离子方程式
(1) NaOH(含酚酞)和HCl 红色褪去 H+、OH- Na+、Cl- H++OH-===H2O
NaOH(含酚酞)和H2SO4
(2) CuSO4和NaOH
CuCl2和NaOH
红色褪去
H+、OH-
蓝色沉淀
Cu2+、OH-
蓝色沉淀
Cu2+、OH-
组别 溶液中
的溶质 实验现象 发生变
化的离子 没有变
化的离子 离子方程式
(3) CuSO4和BaCl2
Na2SO4和BaCl2
(4) Na2CO3和HCl
K2CO3和H2SO4
白色沉淀
白色沉淀
产生气泡
产生气泡
2. 根据上述实验,归纳得出酸、碱、盐相互间发生反应的条件是什么?
【答案】 反应中要有沉淀、气体或水生成。
1. 以“H++OH-===H2O”为例,说说离子方程式的意义与化学方程式有什么不同?
【答案】 离子方程式“H++OH-===H2O”既可以表示氢氧化钠与盐酸这个具体的中和反应,也可以表示其他强酸与强碱发生反应,生成可溶性盐的一类中和反应。即离子方程式既可以表示某一个具体的反应,还可以表示同一类型的离子反应,而化学方程式只可表示具体的反应。
活动三:理解离子方程式的意义与书写规范
2. 仔细观察下列离子方程式,结合你写的离子方程式,思考下列问题。
①锌与稀硫酸反应制取氢气:Zn+2H+===Zn2++H2↑
②用稀盐酸除去铁表面的铁锈:Fe2O3+6H+===2Fe3++3H2O
③将二氧化碳通入澄清石灰水中:CO2+Ca2++2OH-===CaCO3↓+H2O
④氯气置换出溴化钠溶液中的溴:Cl2+2Br-===Br2+2Cl-
⑤氨水(弱碱)与醋酸(弱酸)混合:NH3·H2O+CH3COOH===CH3COO-+NH+4+H2O
(1) 讨论书写离子方程式时,哪些类型的物质应改写成离子形式?哪些物质直接写分子式(或化学式)?
【答案】 强酸、强碱、可溶性盐等写成离子形式;而单质、氧化物、气体、难溶性物质、弱酸、弱碱等直接用分子式(或化学式)表示。
(2) 你还发现了离子方程式书写的哪些规律?
【答案】 离子方程式书写时要注意电荷守恒(反应物所带电荷总数与生成物的电荷总数相等)与质量守恒(反应物与生成物的各元素原子总数相等)。
3. 根据离子方程式的书写规则,直接写出下列反应的离子方程式。
(1) 铜丝投入硝酸银溶液中。
【答案】 Cu+2Ag+===Cu2++2Ag
(2) 碳酸钙与盐酸反应制取二氧化碳。
【答案】 CaCO3+2H+===Ca2++H2O+CO2↑
(3) 氢氧化铜溶于稀硫酸中。
【答案】 Cu(OH)2+2H+===Cu2++2H2O
(4) 硫酸铜溶液与氢氧化钡溶液混合。
2
4
5
1
3
7
6
D
2
4
5
1
3
7
6
B
2
4
5
1
3
7
6
A
2
4
5
1
3
7
6
4. 一化学兴趣小组设计了如图所示的化学实验,按照图1接好线路发现灯泡不亮,按照图2接好线路发现灯泡亮,该实验中纯水不导电,由此得出的结论正确的是( )
图1 图2
A. NaCl溶液是电解质
B. NaCl固体中不含离子
C. NaCl在水溶液中电离出了可自由移动的离子
D. NaCl溶液中水电离出大量的离子
C
2
4
5
1
3
7
6
5. 写出下列反应的离子方程式:
(1) 氢氧化钡溶液与氯化铜溶液:
______________________________________。
(2) 金属铝溶于稀盐酸:__________________________________。
(3) 氧化铜中加稀硫酸:__________________________________。
(4) 氢氧化钡溶液和稀硫酸:
_______________________________________________________。
(5) 铝片与硝酸汞溶液:______________________________________。
2
4
5
1
3
7
6
6. 某含铁废渣(主要成分为Fe、Fe2O3,此外还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
(1) 写出“酸溶”时发生反应的离子方程式:
①_____________________________________;
②_____________________________________。
2
4
5
1
3
7
6
(2) “沉淀”时发生反应的离子方程式为________________________。
(3) 上述流程中,“还原”的目的是将Fe3+转化为Fe2+。写出该“还原”过程发生反应的离子方程式:_________________________。
2
4
5
1
3
7
6
7. 下图表示硅酸钾溶液与盐酸溶液反应的微观过程,其本质是硅酸钾电离出的阴离子(Ⅰ)与盐酸电离出的阳离子(Ⅱ)反应生成沉淀。
(1) Ⅰ、Ⅱ的离子符号分别为________________。
(2) 写出硅酸钾溶液与盐酸溶液反应的化学方程式:________________ _____________________________。
谢谢观看
Thank you for watching
第一章
物质及其变化
第二节 离子反应
内容索引
学习目标
活动方案
课堂反馈
1. 认识电解质,会书写强酸、强碱和可溶性盐的电离方程式。
2. 通过实验事实认识离子反应及其发生的条件,能正确书写有关离子方程式。
1. 带电粒子在电场作用下定向移动,可以形成电流。为什么金属能导电,而木棒、橡胶不能导电?
【答案】 金属内有可自由移动的电子,在电场作用下定向移动,形成电流。而木棒、橡胶中没有可自由移动的带电粒子。
活动一:认识电解质的电离
2. 完成下列实验并回答问题。
实验一:在三只烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,连接如下图所示装置,观察实验现象。
实验二:向装有NaCl固体和KNO3固体的烧杯中,分别加入少量蒸馏水,用玻璃棒搅拌,使固体完全溶解。连接如下图所示装置,观察实验现象。
(1) 实验一、二中分别观察到什么实验现象?当灯泡发光说明什么问题?
【答案】 实验一中灯泡都不发光,实验二中灯泡都发光。实验二中灯泡发光说明NaCl溶液和KNO3溶液中存在可自由移动的带电粒子。
(2) NaCl是离子化合物,NaCl固体内部存在Na+和Cl-。下图为NaCl固体在加入水后所发生的变化。根据图示解释为什么NaCl固体不能导电,而NaCl水溶液可以导电。
【答案】 NaCl固体中Na+和Cl-的位置固定,不能自由移动。NaCl水溶液中Na+和Cl-可以自由移动。
(3) 我们在初中做过盐酸、NaOH溶液的导电性实验。将NaCl固体和KNO3固体加热至熔化,也能导电。这种在水溶液或熔融状态下能够导电的化合物叫作电解质。根据实验判断,哪些物质属于电解质,它们分别代表哪些类型的物质?
【答案】 NaCl、KNO3、HCl、NaOH和水都是电解质。它们分别代表盐、盐、酸、碱和水。
(4) 电解质溶于水或受热熔化时,形成自由移动的离子的过程叫作电离。电解质的电离可以用电离方程式表示。分别写出HCl、H2SO4、NaOH、NaCl的电离方程式。
【答案】 HCl===H++Cl- H2SO4===2H++SO2-4
NaOH===Na++OH- NaCl===Na++Cl-
(5) 虽然酸、碱、盐都是电解质,但由于溶解性和电离程度的不同,不同的酸、碱、盐在水溶液中的电离程度和存在形式是不一样的。根据下表,你能总结出哪些酸、碱、盐在水溶液中完全以离子形式存在?
物质 HCl H2SO4 CH3COOH NaOH NH3·H2O Mg(OH)2 CaCl2 CaCO3
酸碱性或溶解性 强酸 强酸 弱酸 强碱 弱碱 难溶 可溶 难溶
水溶液中是否完全以离子形式存在 是 是 否 是 否 否 是 否
【答案】 强酸、强碱、可溶性盐在水溶液中完全电离,以离子形式存在。
1. 完成下列4组实验,观察并记录产生的现象,并仿照NaOH和HCl的反应,分析发生变化和没有变化的离子,用实际参加反应的离子符号来表示化学反应(即离子方程式)。下图是氢氧化钠溶液和盐酸反应实质的微观示意图(供分析参考)。
活动二:探究离子反应的条件,正确书写离子方程式
组别 溶液中
的溶质 实验现象 发生变
化的离子 没有变
化的离子 离子方程式
(1) NaOH(含酚酞)和HCl 红色褪去 H+、OH- Na+、Cl- H++OH-===H2O
NaOH(含酚酞)和H2SO4
(2) CuSO4和NaOH
CuCl2和NaOH
红色褪去
H+、OH-
蓝色沉淀
Cu2+、OH-
蓝色沉淀
Cu2+、OH-
组别 溶液中
的溶质 实验现象 发生变
化的离子 没有变
化的离子 离子方程式
(3) CuSO4和BaCl2
Na2SO4和BaCl2
(4) Na2CO3和HCl
K2CO3和H2SO4
白色沉淀
白色沉淀
产生气泡
产生气泡
2. 根据上述实验,归纳得出酸、碱、盐相互间发生反应的条件是什么?
【答案】 反应中要有沉淀、气体或水生成。
1. 以“H++OH-===H2O”为例,说说离子方程式的意义与化学方程式有什么不同?
【答案】 离子方程式“H++OH-===H2O”既可以表示氢氧化钠与盐酸这个具体的中和反应,也可以表示其他强酸与强碱发生反应,生成可溶性盐的一类中和反应。即离子方程式既可以表示某一个具体的反应,还可以表示同一类型的离子反应,而化学方程式只可表示具体的反应。
活动三:理解离子方程式的意义与书写规范
2. 仔细观察下列离子方程式,结合你写的离子方程式,思考下列问题。
①锌与稀硫酸反应制取氢气:Zn+2H+===Zn2++H2↑
②用稀盐酸除去铁表面的铁锈:Fe2O3+6H+===2Fe3++3H2O
③将二氧化碳通入澄清石灰水中:CO2+Ca2++2OH-===CaCO3↓+H2O
④氯气置换出溴化钠溶液中的溴:Cl2+2Br-===Br2+2Cl-
⑤氨水(弱碱)与醋酸(弱酸)混合:NH3·H2O+CH3COOH===CH3COO-+NH+4+H2O
(1) 讨论书写离子方程式时,哪些类型的物质应改写成离子形式?哪些物质直接写分子式(或化学式)?
【答案】 强酸、强碱、可溶性盐等写成离子形式;而单质、氧化物、气体、难溶性物质、弱酸、弱碱等直接用分子式(或化学式)表示。
(2) 你还发现了离子方程式书写的哪些规律?
【答案】 离子方程式书写时要注意电荷守恒(反应物所带电荷总数与生成物的电荷总数相等)与质量守恒(反应物与生成物的各元素原子总数相等)。
3. 根据离子方程式的书写规则,直接写出下列反应的离子方程式。
(1) 铜丝投入硝酸银溶液中。
【答案】 Cu+2Ag+===Cu2++2Ag
(2) 碳酸钙与盐酸反应制取二氧化碳。
【答案】 CaCO3+2H+===Ca2++H2O+CO2↑
(3) 氢氧化铜溶于稀硫酸中。
【答案】 Cu(OH)2+2H+===Cu2++2H2O
(4) 硫酸铜溶液与氢氧化钡溶液混合。
2
4
5
1
3
7
6
D
2
4
5
1
3
7
6
B
2
4
5
1
3
7
6
A
2
4
5
1
3
7
6
4. 一化学兴趣小组设计了如图所示的化学实验,按照图1接好线路发现灯泡不亮,按照图2接好线路发现灯泡亮,该实验中纯水不导电,由此得出的结论正确的是( )
图1 图2
A. NaCl溶液是电解质
B. NaCl固体中不含离子
C. NaCl在水溶液中电离出了可自由移动的离子
D. NaCl溶液中水电离出大量的离子
C
2
4
5
1
3
7
6
5. 写出下列反应的离子方程式:
(1) 氢氧化钡溶液与氯化铜溶液:
______________________________________。
(2) 金属铝溶于稀盐酸:__________________________________。
(3) 氧化铜中加稀硫酸:__________________________________。
(4) 氢氧化钡溶液和稀硫酸:
_______________________________________________________。
(5) 铝片与硝酸汞溶液:______________________________________。
2
4
5
1
3
7
6
6. 某含铁废渣(主要成分为Fe、Fe2O3,此外还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
(1) 写出“酸溶”时发生反应的离子方程式:
①_____________________________________;
②_____________________________________。
2
4
5
1
3
7
6
(2) “沉淀”时发生反应的离子方程式为________________________。
(3) 上述流程中,“还原”的目的是将Fe3+转化为Fe2+。写出该“还原”过程发生反应的离子方程式:_________________________。
2
4
5
1
3
7
6
7. 下图表示硅酸钾溶液与盐酸溶液反应的微观过程,其本质是硅酸钾电离出的阴离子(Ⅰ)与盐酸电离出的阳离子(Ⅱ)反应生成沉淀。
(1) Ⅰ、Ⅱ的离子符号分别为________________。
(2) 写出硅酸钾溶液与盐酸溶液反应的化学方程式:________________ _____________________________。
谢谢观看
Thank you for watching
