第1章 第3节 课题2 氧化还原反应的基本规律(共30张ppt)
文档属性
| 名称 | 第1章 第3节 课题2 氧化还原反应的基本规律(共30张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 00:00:00 | ||
图片预览











文档简介
(共30张PPT)
第一章
物质及其变化
第三节 氧化还原反应
课题2 氧化还原反应的基本规律
内容索引
学习目标
活动方案
课堂反馈
1. 通过探究,认识氧化还原反应中的几个重要规律。
2. 学会用得失电子守恒配平简单的氧化还原反应方程式。
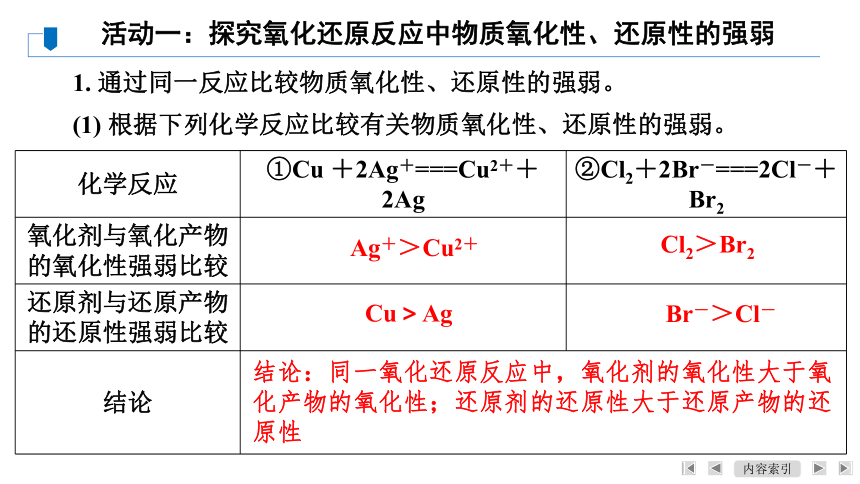
1. 通过同一反应比较物质氧化性、还原性的强弱。
(1) 根据下列化学反应比较有关物质氧化性、还原性的强弱。
活动一:探究氧化还原反应中物质氧化性、还原性的强弱
化学反应 ①Cu +2Ag+===Cu2++2Ag ②Cl2+2Br-===2Cl-+Br2
氧化剂与氧化产物的氧化性强弱比较
还原剂与还原产物的还原性强弱比较
结论
Ag+>Cu2+
Cl2>Br2
Cu>Ag
Br->Cl-
结论:同一氧化还原反应中,氧化剂的氧化性大于氧
化产物的氧化性;还原剂的还原性大于还原产物的还
原性
(2) 已知氧化性:Cl2>Fe3+>I2。试判断下列氧化还原反应能否发生。
①Cl2+2Fe2+===2Cl-+2Fe3+ ②2Fe2++I2===2Fe3++2I- ③Cl2+2I-===2Cl-+I2
【答案】 ①和③能发生,②不能发生。
2. 通过不同反应比较物质氧化性、还原性的强弱。
(1) 铜能溶于稀硝酸,不能溶于稀盐酸。
比较氧化性:HCl______HNO3。
(2) 化学工作者分别用S、Cl2与Fe反应,其实验结果如下:
<
<
>
1. 有化合价升高,一定有化合价降低。
根据元素化合价变化的规律等知识,推测下列反应的部分产物(无须配平):
(1) 在催化剂作用下,汽车尾气的净化反应之一:NO2+CO―→N2+__________。
活动二:探究氧化还原反应中元素化合价变化的规律
CO2
2. 同种元素不同价态之间发生氧化还原反应时,两种价态只可以向中间靠近,最多都变成中间的一个相同价态,化合价升降不可以出现“交叉”现象。
(1) 回答下列问题,体验同种元素不同价态之间发生氧化还原反应的化合价变化规律。
①S+2H2SO4(浓)===3SO2↑+2H2O中:氧化产物是_________,还原产物是__________。
②2K2S+K2SO3+3H2SO4===3S↓+3K2SO4+3H2O中:氧化产物是______,还原产物是______。
SO2
SO2
S
S
③H2S+H2SO4(浓)===S↓+SO2+2H2O中:氧化产物是______,还原产物是__________。
(2) 根据上述你所发现的规律,写出下列反应的离子方程式。
①向氯化铁溶液中加入铁粉:____________________________。
②酸性条件下,将氯化钠与次氯酸钠溶液混合:__________________ ___________________________。
S
SO2
3. 化合价升高(还原剂失电子)与化合价降低(氧化剂得电子)的定量关系。
【答案】 均为6个。
【答案】 均为2个。
(3) 根据上述实例分析,请你对氧化还原反应中电子得失情况总结出一条规律。
【答案】 在氧化还原反应中,还原剂失去的电子总数等于氧化剂得到的电子总数,简称“得失电子守恒”。
1. 氧化还原反应化学方程式的配平方法。
(1) 以____Cu+____HNO3(浓)===____Cu(NO3)2+____NO2↑+____H2O的配平为例:
第一步:分析氧化剂、还原剂、氧化产物、还原产物的“纯粹”性。该反应中“纯粹”的物质有__________________________________。
说明:若氧化剂全部被还原或还原剂全部被氧化,则为“纯粹”的。否则为“不纯粹”的(如本例中HNO3中的N)。氧化产物和还原产物是否“纯粹”可以用同样的方法将反应逆过来看。
活动三:学习氧化还原反应基本规律的简单应用
第二步:选择“纯粹”的氧化剂(或还原产物)、还原剂(或氧化产物)中任意2个,计算反应或生成1个该粒子时得失电子的数目。
-2e- +1e-
____Cu+____HNO3(浓)===____Cu(NO3)2+____NO2↑+____H2O
第三步:根据“电子得失总数相等”可知,n(Cu)∶n(NO2)=1∶2。
______Cu+____HNO3(浓)===____Cu(NO3)2+______NO2↑+____H2O
第四步:根据“原子守恒”确定其他化学计量数,并检验。
______Cu+______HNO3(浓)===______Cu(NO3)2+______NO2↑+______H2O
1
2
1
4
1
2
2
(2) 案例巩固。
说明:实际书写方程式时,“1”可以省去。
1
4
1
4
2
4
5
4
6
3
6
2
1
3
2. 氧化还原反应离子方程式的配平方法。
2
5
1
5
6
1
14
6
2
7
1
3
4
2
3
2
2
4
5
1
3
7
6
8
C
2
4
5
1
3
7
6
8
2. 在KClO3+6HCl===KCl+3Cl2↑+3H2O反应中,被氧化与被还原的氯原子个数比为( )
A. 1∶6 B. 6∶1
C. 1∶5 D. 5∶1
D
2
4
5
1
3
7
6
8
3. 根据下列反应判断,各组物质的氧化性由强到弱顺序正确的是
( )
①Cu+2FeCl3===2FeCl2+CuCl2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
A. KMnO4、FeCl3、Cl2、CuCl2
B. Cl2、FeCl3、KMnO4、CuCl2
C. KMnO4、Cl2、FeCl3、CuCl2
D. CuCl2、FeCl3、Cl2、KMnO4
C
2
4
5
1
3
7
6
8
4. 在8NH3+3Cl2===N2+6NH4Cl反应中,如果有3 个Cl2分子参加了反应,则被氧化的NH3的分子数是( )
A. 1 B. 2
C. 6 D. 8
B
2
4
5
1
3
7
6
8
5. Fe与盐酸反应生成FeCl2,而Fe在Cl2中燃烧则生成FeCl3。下列说法正确的是( )
A. 反应中Fe均作氧化剂
B. Cl2的氧化性比盐酸的氧化性强
C. Fe在Cl2中燃烧,Fe和Cl2的化学计量数之比为3∶2
D. 反应等量的铁,两个反应转移电子的总数相等
B
2
4
5
1
3
7
6
8
D
2
4
5
1
3
7
6
8
7. 配平下列氧化还原反应方程式:
2
4
1
4
2
5
6
2
10
8
3
4
1
3
6
2
4
1
3
7
6
8
5
13.5
2
4
1
3
7
6
8
5
(2) 事实上,金属镁比铝能更快消除水体中氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式:________________________ ________________________________________。
②假设国际现货市场每吨镁粉为1 730美元左右,每吨铝粉的价格为3 585美元左右,从价效比的角度出发,请通过计算分析,应选用哪种金属清除水体中的氮元素经济上更合算?
2
4
1
3
7
6
8
5
谢谢观看
Thank you for watching
第一章
物质及其变化
第三节 氧化还原反应
课题2 氧化还原反应的基本规律
内容索引
学习目标
活动方案
课堂反馈
1. 通过探究,认识氧化还原反应中的几个重要规律。
2. 学会用得失电子守恒配平简单的氧化还原反应方程式。
1. 通过同一反应比较物质氧化性、还原性的强弱。
(1) 根据下列化学反应比较有关物质氧化性、还原性的强弱。
活动一:探究氧化还原反应中物质氧化性、还原性的强弱
化学反应 ①Cu +2Ag+===Cu2++2Ag ②Cl2+2Br-===2Cl-+Br2
氧化剂与氧化产物的氧化性强弱比较
还原剂与还原产物的还原性强弱比较
结论
Ag+>Cu2+
Cl2>Br2
Cu>Ag
Br->Cl-
结论:同一氧化还原反应中,氧化剂的氧化性大于氧
化产物的氧化性;还原剂的还原性大于还原产物的还
原性
(2) 已知氧化性:Cl2>Fe3+>I2。试判断下列氧化还原反应能否发生。
①Cl2+2Fe2+===2Cl-+2Fe3+ ②2Fe2++I2===2Fe3++2I- ③Cl2+2I-===2Cl-+I2
【答案】 ①和③能发生,②不能发生。
2. 通过不同反应比较物质氧化性、还原性的强弱。
(1) 铜能溶于稀硝酸,不能溶于稀盐酸。
比较氧化性:HCl______HNO3。
(2) 化学工作者分别用S、Cl2与Fe反应,其实验结果如下:
<
<
>
1. 有化合价升高,一定有化合价降低。
根据元素化合价变化的规律等知识,推测下列反应的部分产物(无须配平):
(1) 在催化剂作用下,汽车尾气的净化反应之一:NO2+CO―→N2+__________。
活动二:探究氧化还原反应中元素化合价变化的规律
CO2
2. 同种元素不同价态之间发生氧化还原反应时,两种价态只可以向中间靠近,最多都变成中间的一个相同价态,化合价升降不可以出现“交叉”现象。
(1) 回答下列问题,体验同种元素不同价态之间发生氧化还原反应的化合价变化规律。
①S+2H2SO4(浓)===3SO2↑+2H2O中:氧化产物是_________,还原产物是__________。
②2K2S+K2SO3+3H2SO4===3S↓+3K2SO4+3H2O中:氧化产物是______,还原产物是______。
SO2
SO2
S
S
③H2S+H2SO4(浓)===S↓+SO2+2H2O中:氧化产物是______,还原产物是__________。
(2) 根据上述你所发现的规律,写出下列反应的离子方程式。
①向氯化铁溶液中加入铁粉:____________________________。
②酸性条件下,将氯化钠与次氯酸钠溶液混合:__________________ ___________________________。
S
SO2
3. 化合价升高(还原剂失电子)与化合价降低(氧化剂得电子)的定量关系。
【答案】 均为6个。
【答案】 均为2个。
(3) 根据上述实例分析,请你对氧化还原反应中电子得失情况总结出一条规律。
【答案】 在氧化还原反应中,还原剂失去的电子总数等于氧化剂得到的电子总数,简称“得失电子守恒”。
1. 氧化还原反应化学方程式的配平方法。
(1) 以____Cu+____HNO3(浓)===____Cu(NO3)2+____NO2↑+____H2O的配平为例:
第一步:分析氧化剂、还原剂、氧化产物、还原产物的“纯粹”性。该反应中“纯粹”的物质有__________________________________。
说明:若氧化剂全部被还原或还原剂全部被氧化,则为“纯粹”的。否则为“不纯粹”的(如本例中HNO3中的N)。氧化产物和还原产物是否“纯粹”可以用同样的方法将反应逆过来看。
活动三:学习氧化还原反应基本规律的简单应用
第二步:选择“纯粹”的氧化剂(或还原产物)、还原剂(或氧化产物)中任意2个,计算反应或生成1个该粒子时得失电子的数目。
-2e- +1e-
____Cu+____HNO3(浓)===____Cu(NO3)2+____NO2↑+____H2O
第三步:根据“电子得失总数相等”可知,n(Cu)∶n(NO2)=1∶2。
______Cu+____HNO3(浓)===____Cu(NO3)2+______NO2↑+____H2O
第四步:根据“原子守恒”确定其他化学计量数,并检验。
______Cu+______HNO3(浓)===______Cu(NO3)2+______NO2↑+______H2O
1
2
1
4
1
2
2
(2) 案例巩固。
说明:实际书写方程式时,“1”可以省去。
1
4
1
4
2
4
5
4
6
3
6
2
1
3
2. 氧化还原反应离子方程式的配平方法。
2
5
1
5
6
1
14
6
2
7
1
3
4
2
3
2
2
4
5
1
3
7
6
8
C
2
4
5
1
3
7
6
8
2. 在KClO3+6HCl===KCl+3Cl2↑+3H2O反应中,被氧化与被还原的氯原子个数比为( )
A. 1∶6 B. 6∶1
C. 1∶5 D. 5∶1
D
2
4
5
1
3
7
6
8
3. 根据下列反应判断,各组物质的氧化性由强到弱顺序正确的是
( )
①Cu+2FeCl3===2FeCl2+CuCl2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
A. KMnO4、FeCl3、Cl2、CuCl2
B. Cl2、FeCl3、KMnO4、CuCl2
C. KMnO4、Cl2、FeCl3、CuCl2
D. CuCl2、FeCl3、Cl2、KMnO4
C
2
4
5
1
3
7
6
8
4. 在8NH3+3Cl2===N2+6NH4Cl反应中,如果有3 个Cl2分子参加了反应,则被氧化的NH3的分子数是( )
A. 1 B. 2
C. 6 D. 8
B
2
4
5
1
3
7
6
8
5. Fe与盐酸反应生成FeCl2,而Fe在Cl2中燃烧则生成FeCl3。下列说法正确的是( )
A. 反应中Fe均作氧化剂
B. Cl2的氧化性比盐酸的氧化性强
C. Fe在Cl2中燃烧,Fe和Cl2的化学计量数之比为3∶2
D. 反应等量的铁,两个反应转移电子的总数相等
B
2
4
5
1
3
7
6
8
D
2
4
5
1
3
7
6
8
7. 配平下列氧化还原反应方程式:
2
4
1
4
2
5
6
2
10
8
3
4
1
3
6
2
4
1
3
7
6
8
5
13.5
2
4
1
3
7
6
8
5
(2) 事实上,金属镁比铝能更快消除水体中氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式:________________________ ________________________________________。
②假设国际现货市场每吨镁粉为1 730美元左右,每吨铝粉的价格为3 585美元左右,从价效比的角度出发,请通过计算分析,应选用哪种金属清除水体中的氮元素经济上更合算?
2
4
1
3
7
6
8
5
谢谢观看
Thank you for watching
