第2章 第1节 课题1 钠(共20张ppt)
文档属性
| 名称 | 第2章 第1节 课题1 钠(共20张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 923.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 19:42:40 | ||
图片预览








文档简介
(共20张PPT)
第二章
海水中的重要元素——
钠和氯
第一节 钠及其化合物
课题1 钠
内容索引
学习目标
活动方案
课堂反馈
1. 认识钠的物理性质和化学性质。
2. 能从钠和水反应的实验推理出钠的部分物理性质。
3. 能从钠的结构理解钠单质性质活泼的原因。
1. 工业上金属钠的包装要求如下:
外包装采用铁桶,内包装为双层聚乙烯塑料袋,包装时应该将袋内空气排净后扎紧袋口,还要严防水进入包装桶内……
你能猜想金属钠为什么要这样包装吗?
【答案】 金属钠易与空气、水发生反应。
活动一:实验探究金属钠与氧气的反应
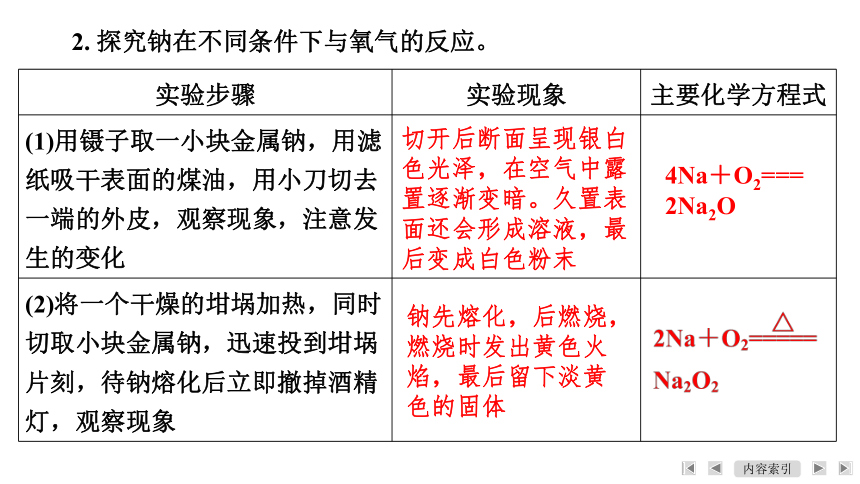
2. 探究钠在不同条件下与氧气的反应。
实验步骤 实验现象 主要化学方程式
(1)用镊子取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的外皮,观察现象,注意发生的变化
(2)将一个干燥的坩埚加热,同时切取小块金属钠,迅速投到坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象
切开后断面呈现银白
色光泽,在空气中露
置逐渐变暗。久置表
面还会形成溶液,最
后变成白色粉末
4Na+O2===
2Na2O
钠先熔化,后燃烧,
燃烧时发出黄色火
焰,最后留下淡黄
色的固体
实验说明什么条件会对该反应的产物有影响?
【答案】 说明温度对该反应的产物有影响。
1. 完成下列实验,观察并记录实验现象,根据现象推理实验结论。
活动二:探究钠与水的反应
实验步骤 实验现象 实验结论
向一盛有水的烧杯中滴加几滴酚酞溶液,然后投入一小块(绿豆大小)金属钠,观察现象
钠浮在水面,熔成小球并在液
面上迅速游动;钠球周围有水
雾,有时可能有火花或伴有爆
鸣声;钠球在反应中逐渐变小,
最后消失;无色溶液变红
金属钠的密度小于水
的密度;反应产生气
体且为放热反应;生
成物之一为氢氧化钠
2. 该反应中生成的气体是什么,可以通过什么方法验证?如果不通过实验的方法,你能通过什么方法推理得到?
【答案】 氢气 可由现象中“火花”“爆鸣声”证明。
也可根据氧化还原反应规律推测。
3. 写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目。
【答案】
1. 画出钠的原子结构示意图,解释单质钠性质活泼的原因。
【答案】 钠原子最外电子层只有1个电子,在化学反应中该电子很容易失去,因此钠的化学性质活泼,表现出很强的还原性。
2. 猜想钠和硫酸铜溶液反应可能的产物,并通过实验验证。
【答案】 猜想一:生成Cu和Na2SO4
猜想二:生成Cu(OH)2、H2、Na2SO4
将一小块钠投入装有适量硫酸铜溶液的烧杯中,产生气泡并出现蓝色絮状沉淀,猜想二正确。
活动三:理解金属钠性质活泼的原因
3. 工业上利用金属钠和TiCl4反应制取金属Ti,该反应应在什么条件下进行?
【答案】 反应条件:干燥、惰性气体保护、反应物液态。
2
4
5
1
3
6
1. 下列关于钠的叙述不正确的是( )
A. 钠燃烧时生成氧化钠
B. 钠燃烧时发出黄色火焰
C. 钠具有很强的还原性
D. 钠原子的最外层上只有1个电子
A
2
4
5
1
3
6
2. 下列有关钠的说法不正确的是( )
A. 钠在自然界中主要以化合态形式存在
B. 实验室取用后剩余的钠要放回原试剂瓶
C. 钠的密度大于煤油且不与煤油反应,可将少量钠保存在煤油中
D. 钠性质活泼,可以与硫酸铜溶液反应,置换出铜
D
2
4
5
1
3
6
3. 将一小块钠投入盛有5 mL饱和澄清石灰水的试管中,不可能观察到的现象是( )
A. 钠熔化成小球并在液面上游动
B. 发出“嘶嘶”的响声
C. 溶液变浑浊
D. 溶液底部有银白色物质生成
D
2
4
5
1
3
6
4. 等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气中(常温)充分反应,则下列说法正确的是( )
A. 第一块钠失去的电子多
B. 两块钠失去电子一样多
C. 第二块钠反应产物质量较大
D. 两块钠反应产物质量一样大
B
2
4
5
1
3
6
B
2
4
5
1
3
6
6. 下列是常用的加热仪器。
A B C
(1) 写出上述仪器的名称:A________,B______,C______。
(2) 可直接加热的仪器是________(填字母,下同)。
(3) 根据实验要求,选择适当的仪器。
金属Na与水反应,选______;
饱和食盐水制得NaCl晶体,选______;
金属Na在不同温度下与氧气反应,选______。
B
蒸发皿
坩埚
烧杯
AB
C
A
谢谢观看
Thank you for watching
第二章
海水中的重要元素——
钠和氯
第一节 钠及其化合物
课题1 钠
内容索引
学习目标
活动方案
课堂反馈
1. 认识钠的物理性质和化学性质。
2. 能从钠和水反应的实验推理出钠的部分物理性质。
3. 能从钠的结构理解钠单质性质活泼的原因。
1. 工业上金属钠的包装要求如下:
外包装采用铁桶,内包装为双层聚乙烯塑料袋,包装时应该将袋内空气排净后扎紧袋口,还要严防水进入包装桶内……
你能猜想金属钠为什么要这样包装吗?
【答案】 金属钠易与空气、水发生反应。
活动一:实验探究金属钠与氧气的反应
2. 探究钠在不同条件下与氧气的反应。
实验步骤 实验现象 主要化学方程式
(1)用镊子取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的外皮,观察现象,注意发生的变化
(2)将一个干燥的坩埚加热,同时切取小块金属钠,迅速投到坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象
切开后断面呈现银白
色光泽,在空气中露
置逐渐变暗。久置表
面还会形成溶液,最
后变成白色粉末
4Na+O2===
2Na2O
钠先熔化,后燃烧,
燃烧时发出黄色火
焰,最后留下淡黄
色的固体
实验说明什么条件会对该反应的产物有影响?
【答案】 说明温度对该反应的产物有影响。
1. 完成下列实验,观察并记录实验现象,根据现象推理实验结论。
活动二:探究钠与水的反应
实验步骤 实验现象 实验结论
向一盛有水的烧杯中滴加几滴酚酞溶液,然后投入一小块(绿豆大小)金属钠,观察现象
钠浮在水面,熔成小球并在液
面上迅速游动;钠球周围有水
雾,有时可能有火花或伴有爆
鸣声;钠球在反应中逐渐变小,
最后消失;无色溶液变红
金属钠的密度小于水
的密度;反应产生气
体且为放热反应;生
成物之一为氢氧化钠
2. 该反应中生成的气体是什么,可以通过什么方法验证?如果不通过实验的方法,你能通过什么方法推理得到?
【答案】 氢气 可由现象中“火花”“爆鸣声”证明。
也可根据氧化还原反应规律推测。
3. 写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目。
【答案】
1. 画出钠的原子结构示意图,解释单质钠性质活泼的原因。
【答案】 钠原子最外电子层只有1个电子,在化学反应中该电子很容易失去,因此钠的化学性质活泼,表现出很强的还原性。
2. 猜想钠和硫酸铜溶液反应可能的产物,并通过实验验证。
【答案】 猜想一:生成Cu和Na2SO4
猜想二:生成Cu(OH)2、H2、Na2SO4
将一小块钠投入装有适量硫酸铜溶液的烧杯中,产生气泡并出现蓝色絮状沉淀,猜想二正确。
活动三:理解金属钠性质活泼的原因
3. 工业上利用金属钠和TiCl4反应制取金属Ti,该反应应在什么条件下进行?
【答案】 反应条件:干燥、惰性气体保护、反应物液态。
2
4
5
1
3
6
1. 下列关于钠的叙述不正确的是( )
A. 钠燃烧时生成氧化钠
B. 钠燃烧时发出黄色火焰
C. 钠具有很强的还原性
D. 钠原子的最外层上只有1个电子
A
2
4
5
1
3
6
2. 下列有关钠的说法不正确的是( )
A. 钠在自然界中主要以化合态形式存在
B. 实验室取用后剩余的钠要放回原试剂瓶
C. 钠的密度大于煤油且不与煤油反应,可将少量钠保存在煤油中
D. 钠性质活泼,可以与硫酸铜溶液反应,置换出铜
D
2
4
5
1
3
6
3. 将一小块钠投入盛有5 mL饱和澄清石灰水的试管中,不可能观察到的现象是( )
A. 钠熔化成小球并在液面上游动
B. 发出“嘶嘶”的响声
C. 溶液变浑浊
D. 溶液底部有银白色物质生成
D
2
4
5
1
3
6
4. 等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气中(常温)充分反应,则下列说法正确的是( )
A. 第一块钠失去的电子多
B. 两块钠失去电子一样多
C. 第二块钠反应产物质量较大
D. 两块钠反应产物质量一样大
B
2
4
5
1
3
6
B
2
4
5
1
3
6
6. 下列是常用的加热仪器。
A B C
(1) 写出上述仪器的名称:A________,B______,C______。
(2) 可直接加热的仪器是________(填字母,下同)。
(3) 根据实验要求,选择适当的仪器。
金属Na与水反应,选______;
饱和食盐水制得NaCl晶体,选______;
金属Na在不同温度下与氧气反应,选______。
B
蒸发皿
坩埚
烧杯
AB
C
A
谢谢观看
Thank you for watching
