第2章 第2节 课题1 氯气(共26张ppt)
文档属性
| 名称 | 第2章 第2节 课题1 氯气(共26张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 19:44:21 | ||
图片预览






文档简介
(共26张PPT)
第二章
海水中的重要元素——
钠和氯
第二节 氯及其化合物
课题1 氯气
内容索引
学习目标
活动方案
课堂反馈
1. 认识氯气的性质和实验室制法。
2. 了解漂白粉的生产原理
1. 阅读材料,归纳出氯气的物理性质。
18世纪70年代,瑞典化学家舍勒发现在加热条件下软锰矿(主要成分为MnO2)能溶于浓盐酸,并立即冒出一种令人窒息具有强烈刺激性气味的黄绿色气体(同时生成MnCl2和水)。他用这种气体做了多次实验,发现它可溶于水,使水略有酸味;具有漂白作用,能漂白有色花朵和绿叶;还能腐蚀金属;在这种气体中的昆虫会立即死去。直到1810年,英国化学家戴维确认这种气体是一种新元素组成的单质——氯气。
【答案】 黄绿色、有刺激性气味的气体,有毒,密度大(由相对分子质量也可知)。
活动一:认识实验室生成氯气的方法
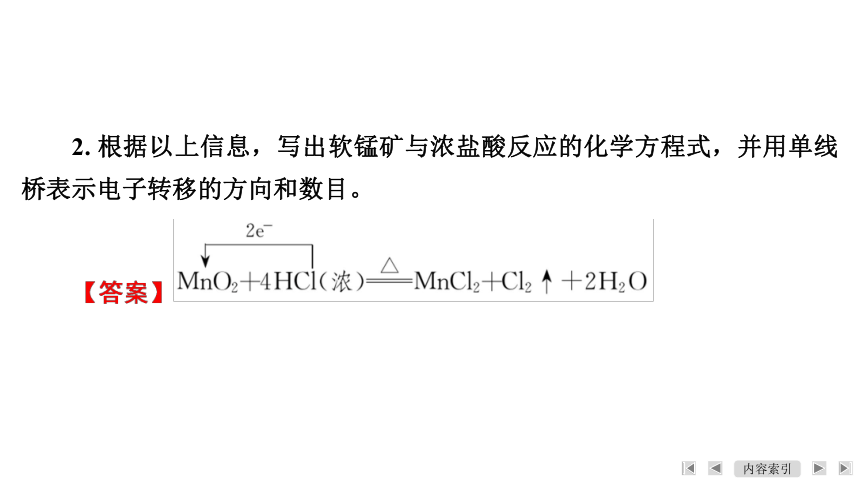
2. 根据以上信息,写出软锰矿与浓盐酸反应的化学方程式,并用单线桥表示电子转移的方向和数目。
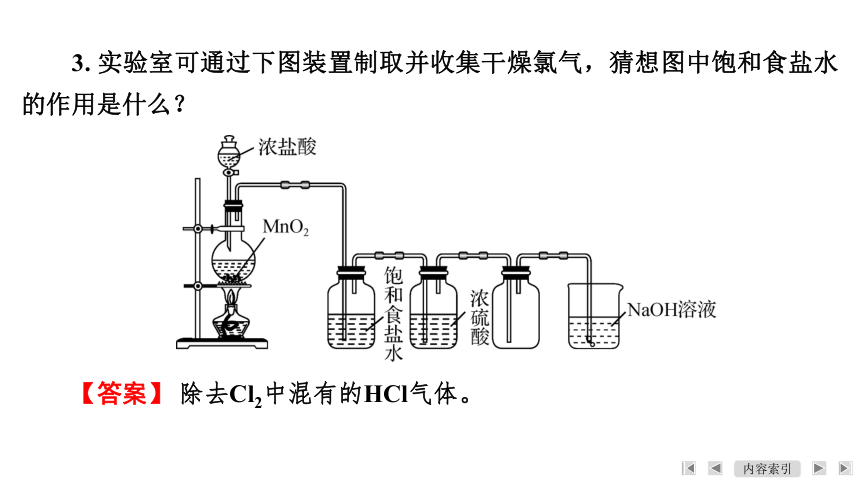
3. 实验室可通过下图装置制取并收集干燥氯气,猜想图中饱和食盐水的作用是什么?
【答案】 除去Cl2中混有的HCl气体。
1. 探究氯气的化学性质。
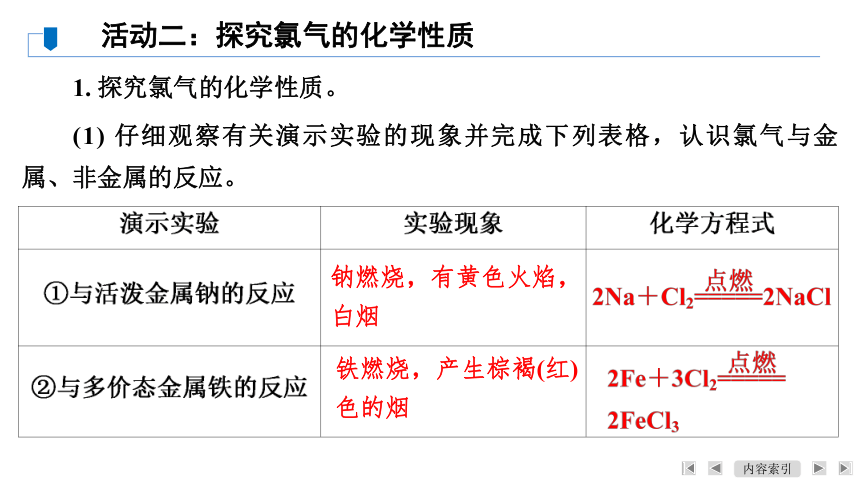
(1) 仔细观察有关演示实验的现象并完成下列表格,认识氯气与金属、非金属的反应。
活动二:探究氯气的化学性质
钠燃烧,有黄色火焰,
白烟
铁燃烧,产生棕褐(红)
色的烟
铜燃烧,产生棕黄色
的烟
苍白色火焰,瓶口出
现白雾
(2) 阅读下面的材料,认识氯气与水和碱的反应。
在京沪高速淮安段,曾经发生一起槽罐车交通事故,车上装载的35吨液氯快速泄漏,造成事故地周围的村庄中中毒且死亡者达27人,事故附近的翠绿的麦田变成了浅黄色。
右图为赶到现场的消防队员向槽罐车周围的 空中喷洒NaOH稀溶液,吸收空气中的氯气。稍 后赶到的大吊车将槽罐吊放到附近的水塘中,消 防队员向水塘中加入大量生石灰,处理残留在槽 罐中的氯气。
①“事故附近的翠绿的麦田变成了浅黄色”原因是氯气与水发生反应,生成具有强氧化性的HClO起漂白作用。写出氯气与水发生反应的化学方程式。
②写出Cl2与NaOH溶液发生反应的化学方程式;消防队员向水塘中加入大量生石灰的目的是什么?
【答案】 Cl2+2NaOH===NaCl+NaClO+H2O
生石灰与水反应生成氢氧化钙,氢氧化钙能与氯气反应。
③根据氯气的性质,小组讨论交流,遇到氯气泄漏时应急处理办法有哪些?
【答案】 遇到氯气泄漏时应逆风向跑向更高的地方;可用衣物或毛巾沾水,捂住口鼻;拨打急救电话,请医务人员和消防人员到场实施急救处理等。
2. 完成如图所示的实验,记录实验现象,由实验现象可以得出什么结论?
【答案】 干燥的氯气不能使有色物质褪色,“潮湿”的氯气能使有色物质褪色,氯气与水反应的生成物中存在具有“漂白性”的物质。
3. 氯是一种重要的“成盐元素”,在自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。画出氯的原子结构示意图。结合氯元素在自然界的存在,你认为氯气的化学性质主要表现为氧化性还是还原性,性质活泼的原因是什么?
【答案】 氯原子的结构示意图: ,氯原子的最外层有7个电子,易得到电子,氯气主要表现氧化性。
1. 氯气的下列用途可能应用了氯气的什么性质?
(1) 工业上制取盐酸。
【答案】 氢气在氯气中燃烧生成HCl。
(2) 通入到田鼠洞中进行灭鼠。
【答案】 有毒,密度比空气大。
(3) 生产重要的金属刻蚀剂氯化铁。
【答案】 氯气与铁的反应。
活动三:了解氯气的用途
2. 工业上采用氯气和石灰乳反应的方法制造漂白粉。
(1) 仿照氯气与NaOH的反应,写出该反应的化学方程式。
【答案】 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
(2) 漂白粉的有效成分是什么?
【答案】 漂白粉的有效成分是Ca(ClO)2。
2
4
5
1
3
6
1. 下列氯化物中,既能由金属和Cl2直接化合制得,又能由金属和盐酸反应制得的是( )
A. CuCl2 B. MgCl2
C. FeCl2 D. FeCl3
B
2
4
5
1
3
6
2. 下列关于Cl2性质的说法正确的是( )
A. 难溶于水的无色气体
B. 不能与非金属单质发生反应
C. 与Cu反应得CuCl
D. 可以与熟石灰的浊液反应
D
2
4
5
1
3
6
3. 使用漂白粉时,为了增强漂白能力可在漂白粉溶液中加入少量的
( )
A. 白醋 B. 白酒
C. 食盐 D. 苏打粉
A
2
4
5
1
3
6
4. 下列关于燃烧的说法不正确的是( )
A. 燃烧一定伴有发光现象
B. 燃烧一定要有氧气参加
C. 燃烧一定是氧化还原反应
D. 燃烧一定会放出热量
B
2
4
5
1
3
6
5. 18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,制得了氯气。舍勒制氯气的方法至今还是实验室中制取氯气的主要方法之一。
现用下图所示的装置模拟生产无水氯化铁的过程。
2
4
5
1
3
6
(1) 制取无水氯化铁的实验中,A中反应的化学方程式(已知:MnO2被还原为MnCl2)为____________________________________________,装置B中加入的试剂是________。
(2) C中的实验现象为____________________,D中发生反应的离子方程式为____________________________________________。
(3) 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是______(填字母)。
浓硫酸
固体变成棕褐(红)色
C
2
4
5
1
3
6
6. 某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO离子的物质的量之比是1∶2,则Cl2与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为______。
11∶3
谢谢观看
Thank you for watching
第二章
海水中的重要元素——
钠和氯
第二节 氯及其化合物
课题1 氯气
内容索引
学习目标
活动方案
课堂反馈
1. 认识氯气的性质和实验室制法。
2. 了解漂白粉的生产原理
1. 阅读材料,归纳出氯气的物理性质。
18世纪70年代,瑞典化学家舍勒发现在加热条件下软锰矿(主要成分为MnO2)能溶于浓盐酸,并立即冒出一种令人窒息具有强烈刺激性气味的黄绿色气体(同时生成MnCl2和水)。他用这种气体做了多次实验,发现它可溶于水,使水略有酸味;具有漂白作用,能漂白有色花朵和绿叶;还能腐蚀金属;在这种气体中的昆虫会立即死去。直到1810年,英国化学家戴维确认这种气体是一种新元素组成的单质——氯气。
【答案】 黄绿色、有刺激性气味的气体,有毒,密度大(由相对分子质量也可知)。
活动一:认识实验室生成氯气的方法
2. 根据以上信息,写出软锰矿与浓盐酸反应的化学方程式,并用单线桥表示电子转移的方向和数目。
3. 实验室可通过下图装置制取并收集干燥氯气,猜想图中饱和食盐水的作用是什么?
【答案】 除去Cl2中混有的HCl气体。
1. 探究氯气的化学性质。
(1) 仔细观察有关演示实验的现象并完成下列表格,认识氯气与金属、非金属的反应。
活动二:探究氯气的化学性质
钠燃烧,有黄色火焰,
白烟
铁燃烧,产生棕褐(红)
色的烟
铜燃烧,产生棕黄色
的烟
苍白色火焰,瓶口出
现白雾
(2) 阅读下面的材料,认识氯气与水和碱的反应。
在京沪高速淮安段,曾经发生一起槽罐车交通事故,车上装载的35吨液氯快速泄漏,造成事故地周围的村庄中中毒且死亡者达27人,事故附近的翠绿的麦田变成了浅黄色。
右图为赶到现场的消防队员向槽罐车周围的 空中喷洒NaOH稀溶液,吸收空气中的氯气。稍 后赶到的大吊车将槽罐吊放到附近的水塘中,消 防队员向水塘中加入大量生石灰,处理残留在槽 罐中的氯气。
①“事故附近的翠绿的麦田变成了浅黄色”原因是氯气与水发生反应,生成具有强氧化性的HClO起漂白作用。写出氯气与水发生反应的化学方程式。
②写出Cl2与NaOH溶液发生反应的化学方程式;消防队员向水塘中加入大量生石灰的目的是什么?
【答案】 Cl2+2NaOH===NaCl+NaClO+H2O
生石灰与水反应生成氢氧化钙,氢氧化钙能与氯气反应。
③根据氯气的性质,小组讨论交流,遇到氯气泄漏时应急处理办法有哪些?
【答案】 遇到氯气泄漏时应逆风向跑向更高的地方;可用衣物或毛巾沾水,捂住口鼻;拨打急救电话,请医务人员和消防人员到场实施急救处理等。
2. 完成如图所示的实验,记录实验现象,由实验现象可以得出什么结论?
【答案】 干燥的氯气不能使有色物质褪色,“潮湿”的氯气能使有色物质褪色,氯气与水反应的生成物中存在具有“漂白性”的物质。
3. 氯是一种重要的“成盐元素”,在自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。画出氯的原子结构示意图。结合氯元素在自然界的存在,你认为氯气的化学性质主要表现为氧化性还是还原性,性质活泼的原因是什么?
【答案】 氯原子的结构示意图: ,氯原子的最外层有7个电子,易得到电子,氯气主要表现氧化性。
1. 氯气的下列用途可能应用了氯气的什么性质?
(1) 工业上制取盐酸。
【答案】 氢气在氯气中燃烧生成HCl。
(2) 通入到田鼠洞中进行灭鼠。
【答案】 有毒,密度比空气大。
(3) 生产重要的金属刻蚀剂氯化铁。
【答案】 氯气与铁的反应。
活动三:了解氯气的用途
2. 工业上采用氯气和石灰乳反应的方法制造漂白粉。
(1) 仿照氯气与NaOH的反应,写出该反应的化学方程式。
【答案】 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
(2) 漂白粉的有效成分是什么?
【答案】 漂白粉的有效成分是Ca(ClO)2。
2
4
5
1
3
6
1. 下列氯化物中,既能由金属和Cl2直接化合制得,又能由金属和盐酸反应制得的是( )
A. CuCl2 B. MgCl2
C. FeCl2 D. FeCl3
B
2
4
5
1
3
6
2. 下列关于Cl2性质的说法正确的是( )
A. 难溶于水的无色气体
B. 不能与非金属单质发生反应
C. 与Cu反应得CuCl
D. 可以与熟石灰的浊液反应
D
2
4
5
1
3
6
3. 使用漂白粉时,为了增强漂白能力可在漂白粉溶液中加入少量的
( )
A. 白醋 B. 白酒
C. 食盐 D. 苏打粉
A
2
4
5
1
3
6
4. 下列关于燃烧的说法不正确的是( )
A. 燃烧一定伴有发光现象
B. 燃烧一定要有氧气参加
C. 燃烧一定是氧化还原反应
D. 燃烧一定会放出热量
B
2
4
5
1
3
6
5. 18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,制得了氯气。舍勒制氯气的方法至今还是实验室中制取氯气的主要方法之一。
现用下图所示的装置模拟生产无水氯化铁的过程。
2
4
5
1
3
6
(1) 制取无水氯化铁的实验中,A中反应的化学方程式(已知:MnO2被还原为MnCl2)为____________________________________________,装置B中加入的试剂是________。
(2) C中的实验现象为____________________,D中发生反应的离子方程式为____________________________________________。
(3) 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是______(填字母)。
浓硫酸
固体变成棕褐(红)色
C
2
4
5
1
3
6
6. 某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO离子的物质的量之比是1∶2,则Cl2与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为______。
11∶3
谢谢观看
Thank you for watching
