第2章 第2节 课题2 氯水成分的实验探究(共25张ppt)
文档属性
| 名称 | 第2章 第2节 课题2 氯水成分的实验探究(共25张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 19:46:24 | ||
图片预览







文档简介
(共25张PPT)
第二章
海水中的重要元素——
钠和氯
第二节 氯及其化合物
课题2 氯水成分的实验探究
内容索引
学习目标
活动方案
课堂反馈
1. 掌握Cl-等常见离子的检验方法。
2. 能设计实验进行氯水成分的探究。
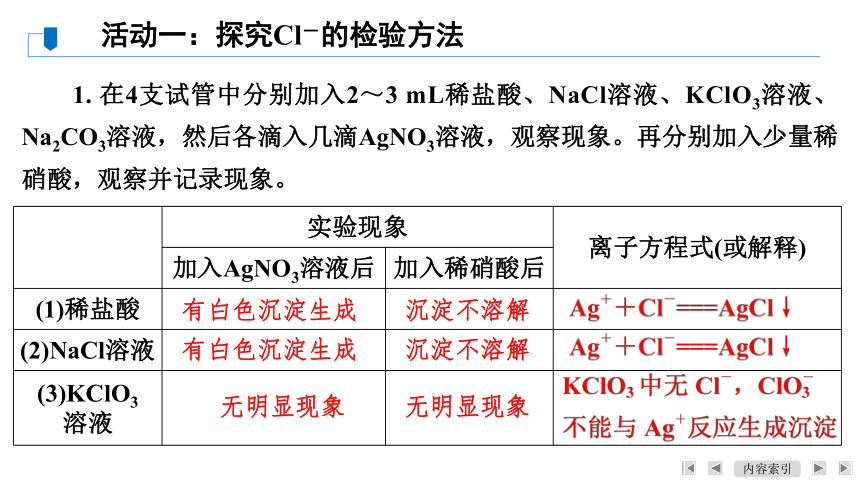
1. 在4支试管中分别加入2~3 mL稀盐酸、NaCl溶液、KClO3溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察并记录现象。
活动一:探究Cl-的检验方法
实验现象 离子方程式(或解释)
加入AgNO3溶液后 加入稀硝酸后
(1)稀盐酸
(2)NaCl溶液
(3)KClO3
溶液
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀不溶解
无明显现象
无明显现象
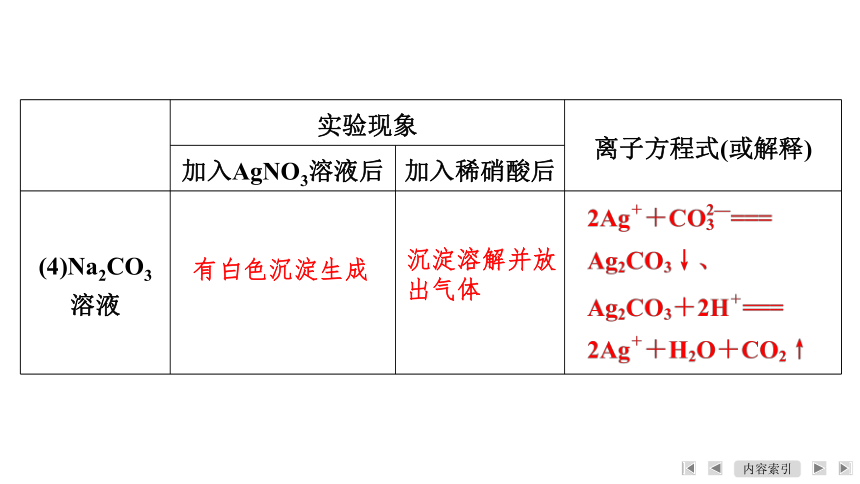
实验现象 离子方程式(或解释)
加入AgNO3溶液后 加入稀硝酸后
(4)Na2CO3溶液
有白色沉淀生成
沉淀溶解并放
出气体
2. 根据上述实验现象,小组交流归纳Cl-的检验方法。
【答案】 先在待检验的溶液中加入适量稀硝酸,无明显现象再加入少量硝酸银溶液,有白色沉淀生成,说明溶液中有Cl-,否则无Cl-(或先在待检验溶液中加入少量硝酸银溶液,有白色沉淀生成,再加入适量稀硝酸,若白色沉淀不溶解,说明溶液中有Cl-,否则无Cl-)。
1. 根据氯气与水反应的原理,猜想氯水中溶质的成分有哪些?
【答案】 氯水中含有H+、Cl-等离子和HClO、Cl2等分子。
2. 提供下列物品,设计实验方案,探究氯水中起漂白作用的粒子。
实验用品:干燥氯气、新制氯水、NaCl溶液、稀硫酸、红布条、镊子、试管若干。
活动二:探究氯水的漂白原理
方案 现象 结论
(1)在干燥氯气中放入红布条 氯水中有漂白能力的粒子为____________
(2)在NaCl溶液中放入红布条
(3)在稀硫酸中放入红布条
(4)在新制氯水中放入红布条
红色布条不褪色
起漂白作用的不是
氯气
红色布条不褪色
Cl-没有漂白作用
红色布条不褪色
H+没有漂白作用
红色布条褪色
新制氯水中含具有
漂白能力的粒子
HClO
实验室提供下列实验用品:氯水、Na2CO3粉末、AgNO3溶液、稀硝酸、有色布条、药匙、试管等。
请你应用上述实验用品,设计检验氯水中含有的粒子的实验方案,进行试验并补充完成下列实验报告。
活动三:探究氯水中溶质的成分
实验步骤 实验现象 实验结论
1. 观察试剂瓶中氯水的颜色
氯水中存在Cl-
溶液呈浅黄绿色
氯水中存在Cl2
2. 向氯水中滴加AgNO3
溶液,再滴加稀硝酸
产生白色沉淀,白色沉
淀不溶于稀硝酸
实验步骤 实验现象 实验结论
氯水中存在H+
氯水中存在具有强氧化性的HClO
3. 向氯水中加入
Na2CO3粉末
有无色气体产生
4. 向氯水中投入一小
块有色布条
有色布条褪色
1. 利用数字化实验,采集到密闭容器中氯水光照时,氯水的pH、氯离子的浓度和氧气的体积分数随时间的变化如下图所示。由图像可以得出哪些结论?
活动四:探究氯水在光照条件下的变化
【答案】 随着时间推移,溶液的pH减小,酸性增强;氯离子浓度增大(生成H+和Cl-);还有氧气生成。
2. 氯水见光分解的实验可在下图装置中完成。实验时,在容器内充满氯水,经日光照射后,可看到有气泡徐徐上升。为验证所产生的气体为氧气,应如何操作?
【答案】 一段时间后,用带火星的木条靠近活塞尖嘴处,打开活塞,可观察到木条复燃。
3. 氯水光照时,只有次氯酸发生了反应,写出该反应的化学方程式。久置氯水与新制氯水相比,溶质的性质将发生哪些变化?
4. 为什么漂白剂常用次氯酸盐而不直接用氯水?
【答案】 因为HClO不稳定,易分解,难以保存,使用不便,效果不好,而漂白粉、漂白精较稳定,使用和保存方便。
2
4
5
1
3
7
6
8
1. 下列物质不能使干燥有色布条褪色的是( )
A. Cl2 B. 氯水
C. NaClO溶液 D. 漂白粉溶液
A
2
4
5
1
3
7
6
8
2. 潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,是因为它们均含有( )
A. 氯气 B. 次氯酸
C. 氯离子 D. 氯化氢
B
2
4
5
1
3
7
6
8
3. 用氯气消毒的自来水配制下列溶液:①NaOH、②AgNO3、③Na2CO3时,会使配制的溶液变质的是( )
A. 只有①② B. 只有②③
C. 只有①③ D. 全部
D
2
4
5
1
3
7
6
8
4. 如下图所示,a处通入Cl2,当打开b阀时,c处的干燥红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )
A. NaOH溶液 B. 浓硫酸
C. Ca(OH)2溶液 D. 食盐水
D
2
4
5
1
3
7
6
8
5. 下列离子方程式书写正确的是( )
A. 次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2=== CaCO3↓+2HClO
B. 氢氧化钠溶液吸收氯气:Cl2+2OH-===Cl-+ClO-+H2O
C. 盐酸和硝酸银溶液反应:HCl+Ag+===AgCl↓+H+
D. 氯气通入水中:Cl2+H2O===2H++Cl-+ClO-
B
2
4
5
1
3
7
6
8
6. 浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O,若用久存的漂白粉与浓盐酸反应,所制得的气体中,可能含有的下列气体是( )
①CO2 ②HCl ③Cl2
A. ①②③ B. ②③
C. ①③ D. ①②
A
2
4
5
1
3
7
6
8
7. 在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法错误的是( )
A. 氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
B. 加入有色布条后,有色布条褪色,说明有HClO分子存在
C. 加入含有NaOH的酚酞溶液,红色褪去,说明有H+存在
D. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
C
2
4
1
3
7
6
8
5
8. 久置的氯水和新制的氯水相比较,下列结论不正确的是( )
A. 颜色不同
B. 漂白能力相同
C. pH不同
D. 加AgNO3溶液都能生成白色沉淀
B
谢谢观看
Thank you for watching
第二章
海水中的重要元素——
钠和氯
第二节 氯及其化合物
课题2 氯水成分的实验探究
内容索引
学习目标
活动方案
课堂反馈
1. 掌握Cl-等常见离子的检验方法。
2. 能设计实验进行氯水成分的探究。
1. 在4支试管中分别加入2~3 mL稀盐酸、NaCl溶液、KClO3溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察并记录现象。
活动一:探究Cl-的检验方法
实验现象 离子方程式(或解释)
加入AgNO3溶液后 加入稀硝酸后
(1)稀盐酸
(2)NaCl溶液
(3)KClO3
溶液
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀不溶解
无明显现象
无明显现象
实验现象 离子方程式(或解释)
加入AgNO3溶液后 加入稀硝酸后
(4)Na2CO3溶液
有白色沉淀生成
沉淀溶解并放
出气体
2. 根据上述实验现象,小组交流归纳Cl-的检验方法。
【答案】 先在待检验的溶液中加入适量稀硝酸,无明显现象再加入少量硝酸银溶液,有白色沉淀生成,说明溶液中有Cl-,否则无Cl-(或先在待检验溶液中加入少量硝酸银溶液,有白色沉淀生成,再加入适量稀硝酸,若白色沉淀不溶解,说明溶液中有Cl-,否则无Cl-)。
1. 根据氯气与水反应的原理,猜想氯水中溶质的成分有哪些?
【答案】 氯水中含有H+、Cl-等离子和HClO、Cl2等分子。
2. 提供下列物品,设计实验方案,探究氯水中起漂白作用的粒子。
实验用品:干燥氯气、新制氯水、NaCl溶液、稀硫酸、红布条、镊子、试管若干。
活动二:探究氯水的漂白原理
方案 现象 结论
(1)在干燥氯气中放入红布条 氯水中有漂白能力的粒子为____________
(2)在NaCl溶液中放入红布条
(3)在稀硫酸中放入红布条
(4)在新制氯水中放入红布条
红色布条不褪色
起漂白作用的不是
氯气
红色布条不褪色
Cl-没有漂白作用
红色布条不褪色
H+没有漂白作用
红色布条褪色
新制氯水中含具有
漂白能力的粒子
HClO
实验室提供下列实验用品:氯水、Na2CO3粉末、AgNO3溶液、稀硝酸、有色布条、药匙、试管等。
请你应用上述实验用品,设计检验氯水中含有的粒子的实验方案,进行试验并补充完成下列实验报告。
活动三:探究氯水中溶质的成分
实验步骤 实验现象 实验结论
1. 观察试剂瓶中氯水的颜色
氯水中存在Cl-
溶液呈浅黄绿色
氯水中存在Cl2
2. 向氯水中滴加AgNO3
溶液,再滴加稀硝酸
产生白色沉淀,白色沉
淀不溶于稀硝酸
实验步骤 实验现象 实验结论
氯水中存在H+
氯水中存在具有强氧化性的HClO
3. 向氯水中加入
Na2CO3粉末
有无色气体产生
4. 向氯水中投入一小
块有色布条
有色布条褪色
1. 利用数字化实验,采集到密闭容器中氯水光照时,氯水的pH、氯离子的浓度和氧气的体积分数随时间的变化如下图所示。由图像可以得出哪些结论?
活动四:探究氯水在光照条件下的变化
【答案】 随着时间推移,溶液的pH减小,酸性增强;氯离子浓度增大(生成H+和Cl-);还有氧气生成。
2. 氯水见光分解的实验可在下图装置中完成。实验时,在容器内充满氯水,经日光照射后,可看到有气泡徐徐上升。为验证所产生的气体为氧气,应如何操作?
【答案】 一段时间后,用带火星的木条靠近活塞尖嘴处,打开活塞,可观察到木条复燃。
3. 氯水光照时,只有次氯酸发生了反应,写出该反应的化学方程式。久置氯水与新制氯水相比,溶质的性质将发生哪些变化?
4. 为什么漂白剂常用次氯酸盐而不直接用氯水?
【答案】 因为HClO不稳定,易分解,难以保存,使用不便,效果不好,而漂白粉、漂白精较稳定,使用和保存方便。
2
4
5
1
3
7
6
8
1. 下列物质不能使干燥有色布条褪色的是( )
A. Cl2 B. 氯水
C. NaClO溶液 D. 漂白粉溶液
A
2
4
5
1
3
7
6
8
2. 潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,是因为它们均含有( )
A. 氯气 B. 次氯酸
C. 氯离子 D. 氯化氢
B
2
4
5
1
3
7
6
8
3. 用氯气消毒的自来水配制下列溶液:①NaOH、②AgNO3、③Na2CO3时,会使配制的溶液变质的是( )
A. 只有①② B. 只有②③
C. 只有①③ D. 全部
D
2
4
5
1
3
7
6
8
4. 如下图所示,a处通入Cl2,当打开b阀时,c处的干燥红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )
A. NaOH溶液 B. 浓硫酸
C. Ca(OH)2溶液 D. 食盐水
D
2
4
5
1
3
7
6
8
5. 下列离子方程式书写正确的是( )
A. 次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2=== CaCO3↓+2HClO
B. 氢氧化钠溶液吸收氯气:Cl2+2OH-===Cl-+ClO-+H2O
C. 盐酸和硝酸银溶液反应:HCl+Ag+===AgCl↓+H+
D. 氯气通入水中:Cl2+H2O===2H++Cl-+ClO-
B
2
4
5
1
3
7
6
8
6. 浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O,若用久存的漂白粉与浓盐酸反应,所制得的气体中,可能含有的下列气体是( )
①CO2 ②HCl ③Cl2
A. ①②③ B. ②③
C. ①③ D. ①②
A
2
4
5
1
3
7
6
8
7. 在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法错误的是( )
A. 氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
B. 加入有色布条后,有色布条褪色,说明有HClO分子存在
C. 加入含有NaOH的酚酞溶液,红色褪去,说明有H+存在
D. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
C
2
4
1
3
7
6
8
5
8. 久置的氯水和新制的氯水相比较,下列结论不正确的是( )
A. 颜色不同
B. 漂白能力相同
C. pH不同
D. 加AgNO3溶液都能生成白色沉淀
B
谢谢观看
Thank you for watching
