第2章 第3节 课题2 以物质的量为中心的其他物理量(共25张ppt)
文档属性
| 名称 | 第2章 第3节 课题2 以物质的量为中心的其他物理量(共25张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 00:00:00 | ||
图片预览








文档简介
(共25张PPT)
第二章
海水中的重要元素——
钠和氯
第三节 物质的量
课题 2 以物质的量为中心的
其他物理量
内容索引
学习目标
活动方案
课堂反馈
1. 了解气体摩尔体积、物质的量浓度的含义。
2. 进一步寻找物质的质量、摩尔质量、物质的粒子数、物质的量、气体摩尔体积、物质的量浓度等之间的关系。
3. 能应用以上物理量进行简单的化学计算。
1. 探究1 mol不同聚集状态物质的体积。
我们已经知道:1 mol任何粒子集合体所含粒子数目都相同,但1 mol粒子的质量一般都不相同。请你根据下表中的数据,探究1 mol物质的体积是否相同。(结果均保留两位小数)
活动一:通过化学事实探究气体摩尔体积概念
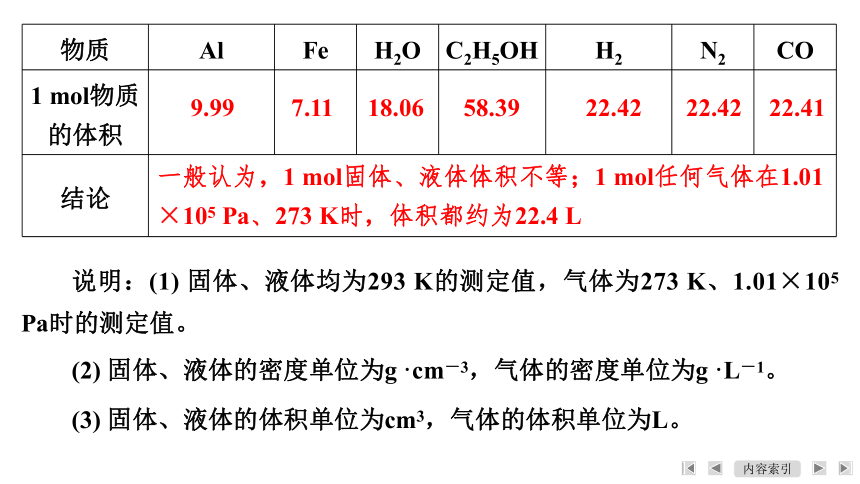
物质 Al Fe H2O C2H5OH H2 N2 CO
摩尔质量/(g·mol-1) 26.98 55.85 18.02 46.07 2.016 28.02 28.01
密度 2.7 7.86 0.998 0.789 0.089 9 1.25 1.25
物质 Al Fe H2O C2H5OH H2 N2 CO
1 mol物质的体积
结论
9.99
7.11
18.06
58.39
22.42
22.42
22.41
一般认为,1 mol固体、液体体积不等;1 mol任何气体在1.01
×105 Pa、273 K时,体积都约为22.4 L
说明:(1) 固体、液体均为293 K的测定值,气体为273 K、1.01×105 Pa时的测定值。
(2) 固体、液体的密度单位为g·cm-3,气体的密度单位为g·L-1。
(3) 固体、液体的体积单位为cm3,气体的体积单位为L。
2. 认识气体摩尔体积的概念。
(1) 猜想影响1 mol物质体积的因素。
请你从微观角度,结合下图解释、分析影响1 mol固体、液体、气体体积的因素分别是什么?
固体 液体 气体
【答案】 1 mol固体、液体的影响因素有:粒子的大小和粒子的数量,1 mol气体体积的影响因素是粒子间的距离和粒子的数量。
(2) 为什么相同温度和压强下,1 mol任何气体体积几乎相等?
【答案】 因为相同温度和压强下,气体分子间的距离几乎相等。
3. 大量的科学实验研究表明:在标准状况(273 K、1.01×105 Pa)下,1 mol任何气体所占的体积都约为22.4 L,即在标准状况下,气体摩尔体积(符号:Vm)约为22.4 L·mol-1。找出气体的体积(V)、气体的物质的量(n)、气体摩尔体积(Vm)之间的关系,并讨论影响气体摩尔体积的因素。
1. 为什么要引入“物质的量浓度”?
某工厂排放的废水1 L中含有0.198 g H2SO4,原来采用NaOH溶液处理,通过调节流量阀,使最终排出的溶液呈中性(如下图所示)。现改用KOH溶液处理以得到钾肥。假如你是工程师,请你协助解决下列问题。
活动二:通过实例理解“物质的量浓度”的含义
(1) 若KOH溶液中溶质质量分数与原来所用NaOH溶液中溶质质量分数相同(假设两种碱溶液的密度相同),在废水流量不变的情况下,如何调节碱液流量?
【答案】 加大碱液的流量。
(2) 如果不调节碱液流量阀的流量,为使最终排出的溶液呈中性,碱液中的溶质KOH的量要满足什么条件?
【答案】 单位体积内KOH的物质的量与NaOH的物质的量相同。
2. 认识物质的量浓度的概念。
物质的量浓度(符号:c,单位: mol·L-1)表示单位体积溶液里所含 溶质的物质的量。右图是一张体检 报告单,其中有6项指标是用物质的 量浓度表示的。请你仔细观察,回 答下列问题。
(1) 指出用物质的量浓度表示的6项指标的项目序号。
【答案】 5、12、13、14、15、16
(2) 已知葡萄糖的分子式为C6H12O6。若某体检者1 L 血液中葡萄糖的检测结果是5.0×10-3 mol·L-1,则该体检者每升血液中含有葡萄糖的质量是______________。
(3) 将10 g NaOH固体溶解在水中,配成500 mL溶液,所得溶液中溶质的物质的量浓度是________________________。
0.9 g
0.5 mol·L-1
1. 通过计算独立解决下列问题。
(1) 实验室需要制取标准状况下的氢气4.48 L。至少需要称取金属锌的质量是__________;需要量取4 mol·L-1的盐酸体积是_______________。
(2) 标准状况下,用水吸收氨气后制得物质的量浓度为12.0 mol·L-1 的氨水。试计算制取 1 L上述氨水需要吸收氨气的体积是_____________。
2. 将你解决问题的思维过程与同学分享,将对你有启发的思路记录下来。
【答案】 略。
活动三:通过以物质的量为中心的物理量解决实际问题
13 g
100 mL
268.8 L
2
4
5
1
3
7
6
8
1. 下列有关物理量相应的单位表达错误的是( )
A. 阿伏加德罗常数/mol-1
B. 气体摩尔体积/(L·mol-1)
C. 摩尔质量/g
D. 物质的量浓度/(mol·L-1)
C
2
4
5
1
3
7
6
8
2. 下列溶液中,Cl-的物质的量浓度与25 mL 1 mol·L-1 AlCl3 溶液中Cl-的物质的量浓度相等的是( )
A. 150 mL 3 mol·L-1 NaCl溶液
B. 75 mL 2 mol·L-1 MgCl2 溶液
C. 150 mL 0.5 mol·L-1 KCl溶液
D. 50 mL 0.5 mol·L-1 FeCl3 溶液
A
2
4
5
1
3
7
6
8
3. 下列说法正确的是( )
A. 等体积的H2 和N2 的分子数相同
B. 等分子数的O2 和O3 的质量相同
C. 等物质的量的CO和CH4 的体积相同
D. 等质量的N2 和C2H4 的物质的量相同
D
2
4
5
1
3
7
6
8
4. 下列判断正确的是( )
A. 2 g H2 含有的氢原子数约为6.02×1023
B. 标准状况下,22.4 L CO2 含有的分子数约为6.02×1023
C. 常温常压下,2.24 L H2O 含有的电子数约为6.02×1023
D. 1 L 1 mol·L-1 MgCl2 溶液中含有的氯离子数约为6.02×1023
B
2
4
5
1
3
7
6
8
5. 同温同压下,向两个密闭容器中分别充入等质量的O2、O3气体,下列说法正确的是( )
A. 两种气体的物质的量之比为3∶2
B. 两种气体的体积之比为2∶3
C. 两种气体的分子数相等
D. 两种气体的密度之比是3∶2
A
2
4
5
1
3
7
6
8
6. 现有14.4 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。
(1) 该混合气体的平均摩尔质量为__________________。
(2) 混合气体中碳原子的个数为________________。
(3) 将混合气体依次通过下列装置,最后收集在气球中(实验在标准状况下进行)。
①气球中收集到的气体的摩尔质量为___________________。
②气球的体积为____________L。
36 g·mol-1
2.408×1023
28 g·mol-1
4.48
2
4
5
1
3
7
6
8
7. 实验室中常用浓硫酸的质量分数为98%,密度为1.84 g·cm-3。计算该浓硫酸的物质的量浓度是多少?
2
4
1
3
7
6
8
5
8. 把1.1 g铝、铁混合物溶于过量200 mL 5 mol·L-1盐酸中,反应后盐酸浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。计算:
(1) 反应中消耗HCl的物质的量:n(HCl)=____________________。
(2) 该混合物中铝、铁的物质的量:n(Al)=____________________、n(Fe)=____________________。
(3) 产生氢气(标准状况下):V(H2)=________________。
0.08 mol
0.02 mol
0.01 mol
896 mL
谢谢观看
Thank you for watching
第二章
海水中的重要元素——
钠和氯
第三节 物质的量
课题 2 以物质的量为中心的
其他物理量
内容索引
学习目标
活动方案
课堂反馈
1. 了解气体摩尔体积、物质的量浓度的含义。
2. 进一步寻找物质的质量、摩尔质量、物质的粒子数、物质的量、气体摩尔体积、物质的量浓度等之间的关系。
3. 能应用以上物理量进行简单的化学计算。
1. 探究1 mol不同聚集状态物质的体积。
我们已经知道:1 mol任何粒子集合体所含粒子数目都相同,但1 mol粒子的质量一般都不相同。请你根据下表中的数据,探究1 mol物质的体积是否相同。(结果均保留两位小数)
活动一:通过化学事实探究气体摩尔体积概念
物质 Al Fe H2O C2H5OH H2 N2 CO
摩尔质量/(g·mol-1) 26.98 55.85 18.02 46.07 2.016 28.02 28.01
密度 2.7 7.86 0.998 0.789 0.089 9 1.25 1.25
物质 Al Fe H2O C2H5OH H2 N2 CO
1 mol物质的体积
结论
9.99
7.11
18.06
58.39
22.42
22.42
22.41
一般认为,1 mol固体、液体体积不等;1 mol任何气体在1.01
×105 Pa、273 K时,体积都约为22.4 L
说明:(1) 固体、液体均为293 K的测定值,气体为273 K、1.01×105 Pa时的测定值。
(2) 固体、液体的密度单位为g·cm-3,气体的密度单位为g·L-1。
(3) 固体、液体的体积单位为cm3,气体的体积单位为L。
2. 认识气体摩尔体积的概念。
(1) 猜想影响1 mol物质体积的因素。
请你从微观角度,结合下图解释、分析影响1 mol固体、液体、气体体积的因素分别是什么?
固体 液体 气体
【答案】 1 mol固体、液体的影响因素有:粒子的大小和粒子的数量,1 mol气体体积的影响因素是粒子间的距离和粒子的数量。
(2) 为什么相同温度和压强下,1 mol任何气体体积几乎相等?
【答案】 因为相同温度和压强下,气体分子间的距离几乎相等。
3. 大量的科学实验研究表明:在标准状况(273 K、1.01×105 Pa)下,1 mol任何气体所占的体积都约为22.4 L,即在标准状况下,气体摩尔体积(符号:Vm)约为22.4 L·mol-1。找出气体的体积(V)、气体的物质的量(n)、气体摩尔体积(Vm)之间的关系,并讨论影响气体摩尔体积的因素。
1. 为什么要引入“物质的量浓度”?
某工厂排放的废水1 L中含有0.198 g H2SO4,原来采用NaOH溶液处理,通过调节流量阀,使最终排出的溶液呈中性(如下图所示)。现改用KOH溶液处理以得到钾肥。假如你是工程师,请你协助解决下列问题。
活动二:通过实例理解“物质的量浓度”的含义
(1) 若KOH溶液中溶质质量分数与原来所用NaOH溶液中溶质质量分数相同(假设两种碱溶液的密度相同),在废水流量不变的情况下,如何调节碱液流量?
【答案】 加大碱液的流量。
(2) 如果不调节碱液流量阀的流量,为使最终排出的溶液呈中性,碱液中的溶质KOH的量要满足什么条件?
【答案】 单位体积内KOH的物质的量与NaOH的物质的量相同。
2. 认识物质的量浓度的概念。
物质的量浓度(符号:c,单位: mol·L-1)表示单位体积溶液里所含 溶质的物质的量。右图是一张体检 报告单,其中有6项指标是用物质的 量浓度表示的。请你仔细观察,回 答下列问题。
(1) 指出用物质的量浓度表示的6项指标的项目序号。
【答案】 5、12、13、14、15、16
(2) 已知葡萄糖的分子式为C6H12O6。若某体检者1 L 血液中葡萄糖的检测结果是5.0×10-3 mol·L-1,则该体检者每升血液中含有葡萄糖的质量是______________。
(3) 将10 g NaOH固体溶解在水中,配成500 mL溶液,所得溶液中溶质的物质的量浓度是________________________。
0.9 g
0.5 mol·L-1
1. 通过计算独立解决下列问题。
(1) 实验室需要制取标准状况下的氢气4.48 L。至少需要称取金属锌的质量是__________;需要量取4 mol·L-1的盐酸体积是_______________。
(2) 标准状况下,用水吸收氨气后制得物质的量浓度为12.0 mol·L-1 的氨水。试计算制取 1 L上述氨水需要吸收氨气的体积是_____________。
2. 将你解决问题的思维过程与同学分享,将对你有启发的思路记录下来。
【答案】 略。
活动三:通过以物质的量为中心的物理量解决实际问题
13 g
100 mL
268.8 L
2
4
5
1
3
7
6
8
1. 下列有关物理量相应的单位表达错误的是( )
A. 阿伏加德罗常数/mol-1
B. 气体摩尔体积/(L·mol-1)
C. 摩尔质量/g
D. 物质的量浓度/(mol·L-1)
C
2
4
5
1
3
7
6
8
2. 下列溶液中,Cl-的物质的量浓度与25 mL 1 mol·L-1 AlCl3 溶液中Cl-的物质的量浓度相等的是( )
A. 150 mL 3 mol·L-1 NaCl溶液
B. 75 mL 2 mol·L-1 MgCl2 溶液
C. 150 mL 0.5 mol·L-1 KCl溶液
D. 50 mL 0.5 mol·L-1 FeCl3 溶液
A
2
4
5
1
3
7
6
8
3. 下列说法正确的是( )
A. 等体积的H2 和N2 的分子数相同
B. 等分子数的O2 和O3 的质量相同
C. 等物质的量的CO和CH4 的体积相同
D. 等质量的N2 和C2H4 的物质的量相同
D
2
4
5
1
3
7
6
8
4. 下列判断正确的是( )
A. 2 g H2 含有的氢原子数约为6.02×1023
B. 标准状况下,22.4 L CO2 含有的分子数约为6.02×1023
C. 常温常压下,2.24 L H2O 含有的电子数约为6.02×1023
D. 1 L 1 mol·L-1 MgCl2 溶液中含有的氯离子数约为6.02×1023
B
2
4
5
1
3
7
6
8
5. 同温同压下,向两个密闭容器中分别充入等质量的O2、O3气体,下列说法正确的是( )
A. 两种气体的物质的量之比为3∶2
B. 两种气体的体积之比为2∶3
C. 两种气体的分子数相等
D. 两种气体的密度之比是3∶2
A
2
4
5
1
3
7
6
8
6. 现有14.4 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。
(1) 该混合气体的平均摩尔质量为__________________。
(2) 混合气体中碳原子的个数为________________。
(3) 将混合气体依次通过下列装置,最后收集在气球中(实验在标准状况下进行)。
①气球中收集到的气体的摩尔质量为___________________。
②气球的体积为____________L。
36 g·mol-1
2.408×1023
28 g·mol-1
4.48
2
4
5
1
3
7
6
8
7. 实验室中常用浓硫酸的质量分数为98%,密度为1.84 g·cm-3。计算该浓硫酸的物质的量浓度是多少?
2
4
1
3
7
6
8
5
8. 把1.1 g铝、铁混合物溶于过量200 mL 5 mol·L-1盐酸中,反应后盐酸浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。计算:
(1) 反应中消耗HCl的物质的量:n(HCl)=____________________。
(2) 该混合物中铝、铁的物质的量:n(Al)=____________________、n(Fe)=____________________。
(3) 产生氢气(标准状况下):V(H2)=________________。
0.08 mol
0.02 mol
0.01 mol
896 mL
谢谢观看
Thank you for watching
