第2章 第3节 课题3 配制一定物质的量浓度的溶液(共24张ppt)
文档属性
| 名称 | 第2章 第3节 课题3 配制一定物质的量浓度的溶液(共24张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 851.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 19:47:40 | ||
图片预览








文档简介
(共24张PPT)
第二章
海水中的重要元素——
钠和氯
第三节 物质的量
课题 3 配制一定物质的
量浓度的溶液
内容索引
学习目标
活动方案
课堂反馈
1. 知道物质的量浓度的单位“mol·L-1”的含义。
2. 认识配制准确的一定物质的量浓度溶液所用的仪器——容量瓶。
3. 能准确配制一定物质的量浓度的溶液。
1. 实验室提供下列必须使用的实验用品:
NaOH固体、蒸馏水;托盘天平(砝码)、小烧杯、250 mL烧杯、玻璃棒、100 mL量筒。
(1) 请你设计配制100 mL物质的量浓度约为2 mol·L-1 NaOH溶液的实验方案。
【答案】 用托盘天平在小烧杯中称取8 g NaOH固体,再用100 mL量筒量取100 mL蒸馏水,用一部分蒸馏水溶解NaOH固体后转移到250 mL 烧杯中,并洗涤小烧杯,洗涤液与剩余蒸馏水一瓶转移至250 mL 烧杯中,同时用玻璃棒不断搅拌使溶液混合均匀。
活动一:设计粗略配制一定物质的量浓度溶液的方案
(2) 上述方案所配溶液物质的量浓度是粗略的。除了托盘天平与量筒的精度较低外,你认为还有什么原因?
【答案】 8 g NaOH固体与100 mL蒸馏水混合后的体积不是100 mL。
2. 将上述实验用品中的“NaOH固体”换成“5 mol·L-1 NaOH溶液”,其他实验用品不变。
(1) 请你重新设计一个配制100 mL物质的量浓度约为2 mol·L-1 NaOH溶液的实验方案。
【答案】 用100 mL量筒量取40 mL 5 mol·L-1NaOH溶液,倒入250 mL烧杯中,再用同一量筒取60 mL蒸馏水,慢慢倒入烧杯中,同时用玻璃棒不断搅拌。
(2) 上述所配溶液物质的量浓度同样是粗略的,试分析原因。
【答案】 量筒的精度较低,40 mL 5 mol·L-1NaOH溶液与60 mL蒸馏水混合后的体积不是100 mL。
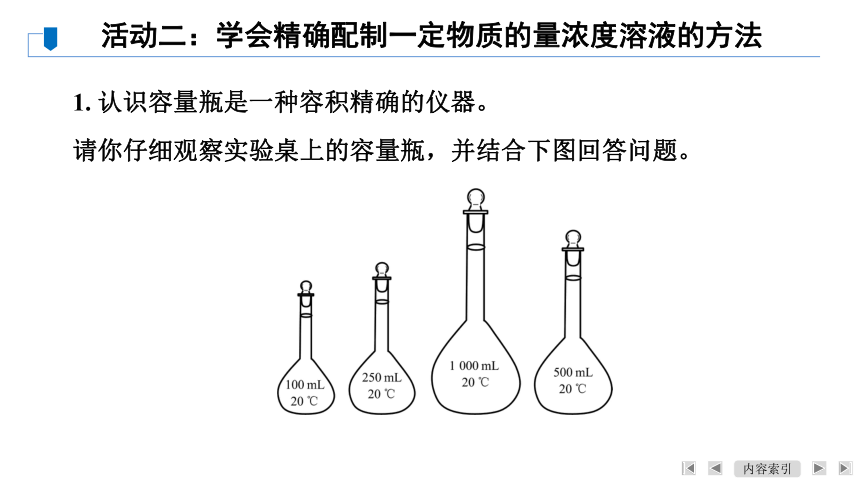
1. 认识容量瓶是一种容积精确的仪器。
请你仔细观察实验桌上的容量瓶,并结合下图回答问题。
活动二:学会精确配制一定物质的量浓度溶液的方法
(1) 说说容量瓶常见的规格有哪些?容量瓶上除了标有规格、刻度线外,还有什么标记?猜想一下该标记的含义是什么?
【答案】 100 mL、250 mL、500 mL、1 000 mL等;还有温度的标记;转入到容量瓶中的溶液温度应在20 ℃左右。
(2) 实验室需要使用240 mL的某浓度的NaOH溶液,配制时应选用何种规格的容量瓶?
【答案】 250 mL的容量瓶。
(3) 使用容量瓶应先“检漏”:向容量瓶中注入一定量的蒸馏水,将容量瓶倒置,观察是否漏水,然后将瓶塞旋转180°,再检查一次。按上述方法检查一下提供给你的容量瓶是否漏水。
2. 精确配制250 mL 0.100 mol·L-1 Na2CO3溶液。
为配制250 mL 0.100 mol·L-1 Na2CO3 溶液,请你与同伴根据下列实验步骤,合作完成实验。
①计算:所需Na2CO3固体的质量m(Na2CO3)=___________。
②称量:用电子天平(或分析天平)准确称取Na2CO3 固体。若用托盘天平称量Na2CO3 固体时,你所称量的质量是多少?
【答案】 2.7 g
2.65 g
③溶解:将Na2CO3 固体放入烧杯中,用适量的蒸馏水溶解。Na2CO3 固体溶解后,是否可以直接进行下一步的操作?为什么?
【答案】 不可以。因为Na2CO3 固体溶解放热,所得溶液必须冷却到室温再转移。
④转移:将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤玻璃棒和烧杯内壁2~3次,洗涤液也注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀。将烧杯中的溶液注入容量瓶还需使用什么仪器?若其他操作均正确,上述洗涤液不注入容量瓶,最终对所配得溶液的浓度会产生什么影响?
【答案】 还需使用玻璃棒。所配得的溶液浓度偏低。
⑤定容:将蒸馏水注入容量瓶,至液面……盖好瓶塞,反复上下颠倒,摇匀(保留待用)。补充完整上述步骤中“……”部分的具体操作。
【答案】 距容量瓶刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切。
1. 实验探究所配Na2CO3 溶液的物质的量浓度是否准确。
下表是不同温度下0.100 mol·L-1 Na2CO3 溶液的pH测定值:
在老师的指导下,用合适的方法准确测定你所配制的Na2CO3 溶液的pH。
本组所配Na2CO3 溶液的pH为__________,对照上述数据可知:其物质的量浓度__________(填“基本准确”“偏大”或“偏小”)。
【答案】 略。
活动三:分析配制一定物质的量浓度溶液的误差
温度/℃ 10 15 20 25 30 35
pH测定值 11.64 11.62 11.59 11.55 11.50 11.43
2. (1) 若所配Na2CO3 溶液的物质的量浓度不准确,其可能的原因是________(若实验结果“基本准确”,请协助其他小组分析)。
A. 天平的砝码沾有其他物质或生锈(未脱落)
B. 所称量的Na2CO3 固体部分吸收了空气中的水分
C. 溶解过程中,搅拌时有部分液体溅出
D. Na2CO3 固体溶解时,未冷却至室温(较高温度下,溶液密度偏小),即进行后续“转移”与“定容”操作
E. 转移操作时,未用少量蒸馏水洗涤烧杯内壁2~3次
F. 定容前,容量瓶中含有少量蒸馏水
G. 定容时,仰视刻度线,使溶液的体积偏大
H. 定容摇匀后,发现液面下降,又加水至刻度线
【答案】 若结果偏大,则选AD;若结果偏小,则选BCEGH。
(2) 除了上述选项中导致测定结果不准确的原因外,请补充说明实验过程中,还可能有什么原因会导致实验误差?
建议表达句式:实验过程中的××操作,使测得的××增加(或××减小),也可能导致实验结果××。
【答案】 略。
2
4
1
3
1. 在容量瓶的使用方法中,下列操作正确的是( )
A. 使用容量瓶前检查它是否漏水
B. 容量瓶用蒸馏水洗净后,再用待配液润洗
C. 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm 处,再用胶头滴管滴加蒸馏水至刻度线
D. 浓硫酸稀释后,应马上转移到容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
A
2
4
1
3
2. 欲配制1 L含0.5 mol NaCl、0.16 mol KCl、0.24 mol K2SO4的混合溶液,现用Na2SO4代替K2SO4来进行配制,则所需NaCl、KCl、Na2SO4三种固体的物质的量分别为( )
A. 0.32 mol、0.01 mol、0.12 mol
B. 0.02 mol、0.64 mol、0.24 mol
C. 0.66 mol、0.48 mol、0.25 mol
D. 0.50 mol、0.16 mol、0.24 mol
B
2
4
1
3
3. 下列叙述正确的是( )
A. 1.00 mol·L-1 的任何NaOH溶液中,NaOH的物质的量均为1 mol
B. 将4 g NaOH固体溶于100 mL水中,所得溶液为1.00 mol·L-1 NaOH溶液
C. 称取4.00 g NaOH固体溶于水,配成100 mL溶液,其物质的量浓度为1.00 mol·L-1
D. 称取4.00 g NaOH固体,放入100 mL容量瓶中,加水溶解并稀释至刻度,配制1.00 mol·L-1 的NaOH溶液
C
2
4
1
3
4. 下图为配制250 mL 0.2 mol·L-1 Na2CO3溶液的示意图。
2
4
1
3
(1) ①中称得Na2CO3__________g。
(2) 玻璃棒在②③两步中的作用分别是_____、_____。
(3) 若出现如下情况,判断对所配溶液浓度有何影响(填“偏高”“偏低”或“无影响”)。
A. 某同学在第⑧步观察液面时仰视:_____;
B. 没有进行操作步骤④和⑤:_____;
C. 在第⑤步不慎有少量液体流到容量瓶外:_____;
D. 在步骤①中,药品放在右盘,砝码放在左盘(使用了游码):____。
5.3
搅拌
引流
偏低
偏低
偏低
偏低
谢谢观看
Thank you for watching
第二章
海水中的重要元素——
钠和氯
第三节 物质的量
课题 3 配制一定物质的
量浓度的溶液
内容索引
学习目标
活动方案
课堂反馈
1. 知道物质的量浓度的单位“mol·L-1”的含义。
2. 认识配制准确的一定物质的量浓度溶液所用的仪器——容量瓶。
3. 能准确配制一定物质的量浓度的溶液。
1. 实验室提供下列必须使用的实验用品:
NaOH固体、蒸馏水;托盘天平(砝码)、小烧杯、250 mL烧杯、玻璃棒、100 mL量筒。
(1) 请你设计配制100 mL物质的量浓度约为2 mol·L-1 NaOH溶液的实验方案。
【答案】 用托盘天平在小烧杯中称取8 g NaOH固体,再用100 mL量筒量取100 mL蒸馏水,用一部分蒸馏水溶解NaOH固体后转移到250 mL 烧杯中,并洗涤小烧杯,洗涤液与剩余蒸馏水一瓶转移至250 mL 烧杯中,同时用玻璃棒不断搅拌使溶液混合均匀。
活动一:设计粗略配制一定物质的量浓度溶液的方案
(2) 上述方案所配溶液物质的量浓度是粗略的。除了托盘天平与量筒的精度较低外,你认为还有什么原因?
【答案】 8 g NaOH固体与100 mL蒸馏水混合后的体积不是100 mL。
2. 将上述实验用品中的“NaOH固体”换成“5 mol·L-1 NaOH溶液”,其他实验用品不变。
(1) 请你重新设计一个配制100 mL物质的量浓度约为2 mol·L-1 NaOH溶液的实验方案。
【答案】 用100 mL量筒量取40 mL 5 mol·L-1NaOH溶液,倒入250 mL烧杯中,再用同一量筒取60 mL蒸馏水,慢慢倒入烧杯中,同时用玻璃棒不断搅拌。
(2) 上述所配溶液物质的量浓度同样是粗略的,试分析原因。
【答案】 量筒的精度较低,40 mL 5 mol·L-1NaOH溶液与60 mL蒸馏水混合后的体积不是100 mL。
1. 认识容量瓶是一种容积精确的仪器。
请你仔细观察实验桌上的容量瓶,并结合下图回答问题。
活动二:学会精确配制一定物质的量浓度溶液的方法
(1) 说说容量瓶常见的规格有哪些?容量瓶上除了标有规格、刻度线外,还有什么标记?猜想一下该标记的含义是什么?
【答案】 100 mL、250 mL、500 mL、1 000 mL等;还有温度的标记;转入到容量瓶中的溶液温度应在20 ℃左右。
(2) 实验室需要使用240 mL的某浓度的NaOH溶液,配制时应选用何种规格的容量瓶?
【答案】 250 mL的容量瓶。
(3) 使用容量瓶应先“检漏”:向容量瓶中注入一定量的蒸馏水,将容量瓶倒置,观察是否漏水,然后将瓶塞旋转180°,再检查一次。按上述方法检查一下提供给你的容量瓶是否漏水。
2. 精确配制250 mL 0.100 mol·L-1 Na2CO3溶液。
为配制250 mL 0.100 mol·L-1 Na2CO3 溶液,请你与同伴根据下列实验步骤,合作完成实验。
①计算:所需Na2CO3固体的质量m(Na2CO3)=___________。
②称量:用电子天平(或分析天平)准确称取Na2CO3 固体。若用托盘天平称量Na2CO3 固体时,你所称量的质量是多少?
【答案】 2.7 g
2.65 g
③溶解:将Na2CO3 固体放入烧杯中,用适量的蒸馏水溶解。Na2CO3 固体溶解后,是否可以直接进行下一步的操作?为什么?
【答案】 不可以。因为Na2CO3 固体溶解放热,所得溶液必须冷却到室温再转移。
④转移:将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤玻璃棒和烧杯内壁2~3次,洗涤液也注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀。将烧杯中的溶液注入容量瓶还需使用什么仪器?若其他操作均正确,上述洗涤液不注入容量瓶,最终对所配得溶液的浓度会产生什么影响?
【答案】 还需使用玻璃棒。所配得的溶液浓度偏低。
⑤定容:将蒸馏水注入容量瓶,至液面……盖好瓶塞,反复上下颠倒,摇匀(保留待用)。补充完整上述步骤中“……”部分的具体操作。
【答案】 距容量瓶刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切。
1. 实验探究所配Na2CO3 溶液的物质的量浓度是否准确。
下表是不同温度下0.100 mol·L-1 Na2CO3 溶液的pH测定值:
在老师的指导下,用合适的方法准确测定你所配制的Na2CO3 溶液的pH。
本组所配Na2CO3 溶液的pH为__________,对照上述数据可知:其物质的量浓度__________(填“基本准确”“偏大”或“偏小”)。
【答案】 略。
活动三:分析配制一定物质的量浓度溶液的误差
温度/℃ 10 15 20 25 30 35
pH测定值 11.64 11.62 11.59 11.55 11.50 11.43
2. (1) 若所配Na2CO3 溶液的物质的量浓度不准确,其可能的原因是________(若实验结果“基本准确”,请协助其他小组分析)。
A. 天平的砝码沾有其他物质或生锈(未脱落)
B. 所称量的Na2CO3 固体部分吸收了空气中的水分
C. 溶解过程中,搅拌时有部分液体溅出
D. Na2CO3 固体溶解时,未冷却至室温(较高温度下,溶液密度偏小),即进行后续“转移”与“定容”操作
E. 转移操作时,未用少量蒸馏水洗涤烧杯内壁2~3次
F. 定容前,容量瓶中含有少量蒸馏水
G. 定容时,仰视刻度线,使溶液的体积偏大
H. 定容摇匀后,发现液面下降,又加水至刻度线
【答案】 若结果偏大,则选AD;若结果偏小,则选BCEGH。
(2) 除了上述选项中导致测定结果不准确的原因外,请补充说明实验过程中,还可能有什么原因会导致实验误差?
建议表达句式:实验过程中的××操作,使测得的××增加(或××减小),也可能导致实验结果××。
【答案】 略。
2
4
1
3
1. 在容量瓶的使用方法中,下列操作正确的是( )
A. 使用容量瓶前检查它是否漏水
B. 容量瓶用蒸馏水洗净后,再用待配液润洗
C. 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm 处,再用胶头滴管滴加蒸馏水至刻度线
D. 浓硫酸稀释后,应马上转移到容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
A
2
4
1
3
2. 欲配制1 L含0.5 mol NaCl、0.16 mol KCl、0.24 mol K2SO4的混合溶液,现用Na2SO4代替K2SO4来进行配制,则所需NaCl、KCl、Na2SO4三种固体的物质的量分别为( )
A. 0.32 mol、0.01 mol、0.12 mol
B. 0.02 mol、0.64 mol、0.24 mol
C. 0.66 mol、0.48 mol、0.25 mol
D. 0.50 mol、0.16 mol、0.24 mol
B
2
4
1
3
3. 下列叙述正确的是( )
A. 1.00 mol·L-1 的任何NaOH溶液中,NaOH的物质的量均为1 mol
B. 将4 g NaOH固体溶于100 mL水中,所得溶液为1.00 mol·L-1 NaOH溶液
C. 称取4.00 g NaOH固体溶于水,配成100 mL溶液,其物质的量浓度为1.00 mol·L-1
D. 称取4.00 g NaOH固体,放入100 mL容量瓶中,加水溶解并稀释至刻度,配制1.00 mol·L-1 的NaOH溶液
C
2
4
1
3
4. 下图为配制250 mL 0.2 mol·L-1 Na2CO3溶液的示意图。
2
4
1
3
(1) ①中称得Na2CO3__________g。
(2) 玻璃棒在②③两步中的作用分别是_____、_____。
(3) 若出现如下情况,判断对所配溶液浓度有何影响(填“偏高”“偏低”或“无影响”)。
A. 某同学在第⑧步观察液面时仰视:_____;
B. 没有进行操作步骤④和⑤:_____;
C. 在第⑤步不慎有少量液体流到容量瓶外:_____;
D. 在步骤①中,药品放在右盘,砝码放在左盘(使用了游码):____。
5.3
搅拌
引流
偏低
偏低
偏低
偏低
谢谢观看
Thank you for watching
