第3章 第1节 铁及其化合物(共32张ppt)
文档属性
| 名称 | 第3章 第1节 铁及其化合物(共32张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 19:48:07 | ||
图片预览










文档简介
(共32张PPT)
第三章
铁 金属材料
第一节 铁及其化合物
内容索引
学习目标
活动方案
课堂反馈
1. 了解铁的重要性质。
2. 了解铁的重要化合物的性质。
3. 了解Fe(OH)2和Fe(OH)3的制备。
1.回忆铁与一些物质的反应,完成下列问题。
(1) 写出铁在氯气、氧气中燃烧的化学方程式。
活动一:认识铁的化学性质
(2) 写出铁与盐酸、硫酸铜反应的离子方程式。
【答案】 Fe+2H+===Fe2++H2↑
Fe+Cu2+===Fe2++Cu
(3) 铁与不同物质反应时,可能会被氧化为+2价或+3价,这与什么因素有关?
【答案】 铁与不同物质反应时,可能会被氧化为+2价或+3价,这跟氧化剂的氧化性强弱有关。
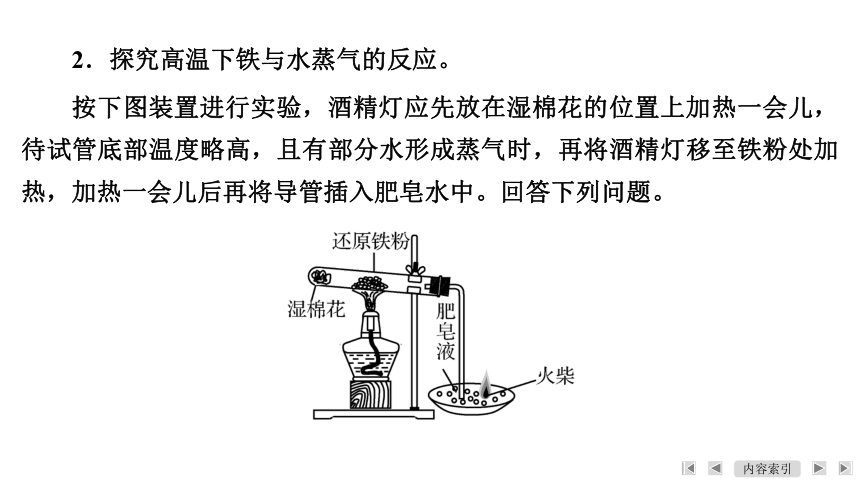
2.探究高温下铁与水蒸气的反应。
按下图装置进行实验,酒精灯应先放在湿棉花的位置上加热一会儿,待试管底部温度略高,且有部分水形成蒸气时,再将酒精灯移至铁粉处加热,加热一会儿后再将导管插入肥皂水中。回答下列问题。
(1) 实验结束时,应如何操作?
【答案】 先从肥皂水中撤出导管,再移去燃着的酒精灯。
(2) 点燃导管口放出的气体有何现象?
【答案】 可听到爆鸣声或可以看到气体燃烧,火焰呈淡蓝色。
(3) 反应后生成黑色磁性氧化物,写出发生反应的化学方程式。
(4) 在钢铁生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,这是为什么?
【答案】 如果不充分的干燥,炽热的铁水或钢水会与水反应,并生产氢气,存在安全隐患。
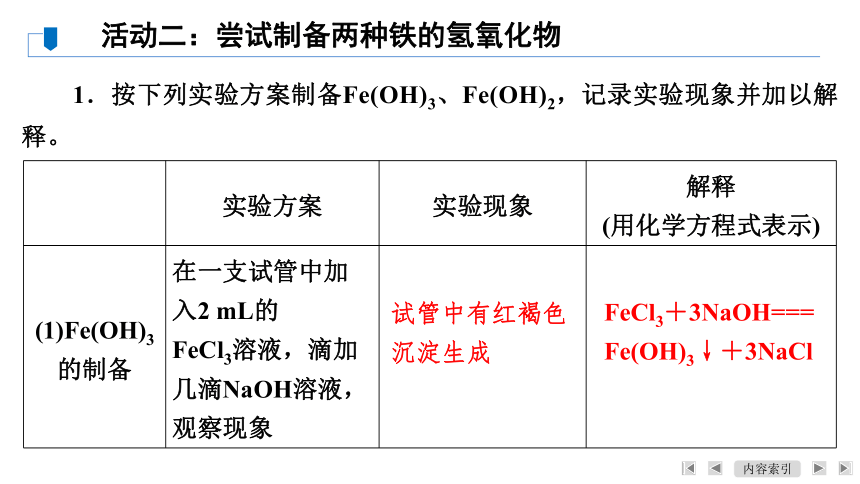
1.按下列实验方案制备Fe(OH)3、Fe(OH)2,记录实验现象并加以解释。
活动二:尝试制备两种铁的氢氧化物
实验方案 实验现象 解释
(用化学方程式表示)
(1)Fe(OH)3的制备 在一支试管中加入2 mL的
FeCl3溶液,滴加几滴NaOH溶液,观察现象
试管中有红褐色
沉淀生成
FeCl3+3NaOH===
Fe(OH)3↓+3NaCl
实验方案 实验现象 解释
(用化学方程式表示)
(2)Fe(OH)2的制备 在一支试管中加入2 mL的
FeCl2溶液,滴加几滴NaOH溶液,观察现象
试管中有灰白色沉淀生成,既而迅速变成灰绿色,最后变成红褐色
FeCl2+2NaOH===
Fe(OH)2↓+2NaCl;
4Fe(OH)2+O2+
2H2O===4Fe(OH)3
2.制备较纯净的Fe(OH)2。
实验室制备Fe(OH)2,因其易被空气氧化,很难观察到明显的Fe(OH)2的白色沉淀。
现将实验(如右图所示)进行如下改进:
(1) 先将NaOH溶液加热煮沸,目的是_______________________。
(2) 将长滴管伸入FeSO4溶液液面以下再滴加NaOH,其优点是______ ___________________________________。
赶跑其中溶有的氧气
防止
空气随NaOH溶液的加入进入溶液
(3) 在FeSO4溶液上方加一层煤油的目的是_______________________ ____。
(4) 将反应后的悬浊液倒在滤纸上,看到的现象是什么?
【答案】 白色沉淀立即变成灰绿色,最后变成红褐色。
防止空气与FeSO4溶液接
触
1.实验探究Fe2O3中铁元素的化合价。
实验试剂:Fe2O3、盐酸溶液、NaOH溶液、KSCN溶液。
已知:Fe3+与KSCN溶液会变成红色。
活动三:探究Fe2+和Fe3+的检验方法
实验方案 实验现象 解释(用离子方程式表示)
方案一:取少量Fe2O3于试管中,滴加稀盐酸至固体全部溶解后,再加入NaOH溶液
红色粉末逐渐溶解,溶液呈黄色,滴加NaOH溶液,有红褐色沉淀生成
Fe2O3+6H+===2Fe3++3H2O;
Fe3++3OH-===Fe(OH)3↓
实验方案 实验现象 解释(用离子方程式表示)
方案二:取少量Fe2O3于试管中,滴加稀盐酸至固体全部溶解后,再滴加几滴KSCN溶液
红色粉末逐渐溶解,溶液呈黄色,滴加KSCN溶液后溶液变为红色
Fe2O3+6H+===2Fe3++3H2O;
Fe3++3SCN-===Fe(SCN)3
2.设计一个简单的实验方案,探究FeO中铁元素的化合价。
实验试剂:FeO、盐酸溶液、NaOH溶液、KSCN溶液、氯水。
已知:Cl2能将Fe2+氧化为Fe3+。
【答案】 方案一:取少量FeO于试管中,滴加稀盐酸至固体全部溶解后,再加入NaOH溶液,出现灰白色沉淀,迅速变成灰绿色,最终变为红褐色,说明FeO中铁元素的化合价为+2价。
方案二:取少量FeO于试管中,滴加稀盐酸至固体全部溶解后,滴加几滴KSCN溶液,无明显现象,再加入新制的氯水,溶液变成红色,说明FeO中铁元素的化合价为+2价。
活动四:实验探究Fe2+和Fe3+的相互转化
实验方案 实验现象 解释
(用离子方程式表示)
(1)取3 mL FeCl3的稀溶液加入试管中,加入铜粉,振荡,向反应后的溶液中滴加KSCN溶液
(2)取3 mL FeCl3的稀溶液加入试管中,加入铁粉,振荡,向反应后的溶液中滴加KSCN溶液
铜粉逐渐溶解,溶液变为蓝绿色,滴加KSCN溶液无明显现象
Cu+2Fe3+ ===Cu2++2Fe2+
铁粉逐渐溶解,溶液变成浅绿色,滴加KSCN溶液无明显现象
2Fe3++Fe===3Fe2+
实验方案 实验现象 解释
(用离子方程式表示)
(3)取(1)中的上清液,向其中滴加少量氯水
(4)取(2)中的上清液,向其中滴加少量盐酸和双氧水
溶液变成红色
2Fe2++Cl2===2Fe3++2Cl- ;
Fe3++3SCN-===Fe(SCN)3
溶液变成红色
2Fe2++H2O2+2H+===2Fe3++2H2O;
Fe3++3SCN-===Fe(SCN)3
1.请在价类二维图中填充相关物质[Fe 、Fe2O3、FeO、Fe2+、 Fe3+、Fe(OH)2、Fe(OH)3],并用箭头表示其中的物质转化(转化需注明反应条件和反应物)。
活动五:利用价类二维图整理铁及其化合物的相互转化
并实现物质的转化
【答案】
2.设计以Fe3O4为原料制取Fe2O3的流程图,可以不止一种。
2
4
5
1
3
1.某溶液中加入KSCN溶液无明显现象,再滴加氯水,立即变成红色,说明原溶液中一定含有( )
A.Fe3+ B.Fe2+
C.Cu2+ D.Zn2+
B
2
4
5
1
3
2.下列说法错误的是( )
A.仅用KSCN可以检验Fe2+
B.仅用NaOH可以检验Fe3+
C.通过化合反应可以得到Fe(OH)3
D.通过化合反应可以得到FeCl2
A
2
4
5
1
3
3.王老师在课堂上用下图装置演示铁与水蒸气的反应。
2
4
5
1
3
(1) 装置A、C的作用分别是___________________________________、______________。
(2) 装置B中发生的反应为_____________________________________ (写出化学方程式)。
(3) 检验产生气体的方法是_____________________________________ _______________________。
作为水蒸气发生器(或用来产生水蒸气)
干燥产生的氢气
将试管D管口向下移近酒精灯,若听到爆
鸣声,说明有氢气产生
2
4
5
1
3
4.在右图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2。
(1) 在试管Ⅰ、Ⅱ里加入的试剂分别是______________、____________。
(2) 为了制得白色Fe(OH)2沉淀,应确保实验在无氧状态下进行。在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是__________ ___________________________________________________________。
(3) 这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________ ______________________________________________________________。
稀硫酸、铁屑
NaOH溶液
检验试管
Ⅱ出口处排出的H2的纯度,当排出的H2纯净时,再夹紧止水夹
试管Ⅰ
中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
2
4
5
1
3
5.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题。
(1) 分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________________。
(2) 甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。FeCl2溶液与氯水反应的离子方程式为________________ _______________。
(3) 乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_______________________________________。
防止Fe2+被氧化
2Fe2++Cl2===
2Fe3++2Cl-
隔绝空气(或排除氧气对实验的影响)
2
4
5
1
3
(4) 丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于2支试管中进行如下实验:
已知:K3[Fe(CN)6]能与Fe2+生成蓝色沉淀。
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀。
实验②的目的是检验还原产物,该还原产物是_______(填离子符号);
由实验可知,两溶液混合发生反应的离子方程式为_________________ _____________。
Fe2+
2Fe3++2I-===I2
+2Fe2+
2
4
5
1
3
(5) 丁组同学向盛有H2O2溶液的试管中加入几滴盐酸酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______________________ _____________。
H2O2+2Fe2++2H+===
2Fe3++2H2O
谢谢观看
Thank you for watching
第三章
铁 金属材料
第一节 铁及其化合物
内容索引
学习目标
活动方案
课堂反馈
1. 了解铁的重要性质。
2. 了解铁的重要化合物的性质。
3. 了解Fe(OH)2和Fe(OH)3的制备。
1.回忆铁与一些物质的反应,完成下列问题。
(1) 写出铁在氯气、氧气中燃烧的化学方程式。
活动一:认识铁的化学性质
(2) 写出铁与盐酸、硫酸铜反应的离子方程式。
【答案】 Fe+2H+===Fe2++H2↑
Fe+Cu2+===Fe2++Cu
(3) 铁与不同物质反应时,可能会被氧化为+2价或+3价,这与什么因素有关?
【答案】 铁与不同物质反应时,可能会被氧化为+2价或+3价,这跟氧化剂的氧化性强弱有关。
2.探究高温下铁与水蒸气的反应。
按下图装置进行实验,酒精灯应先放在湿棉花的位置上加热一会儿,待试管底部温度略高,且有部分水形成蒸气时,再将酒精灯移至铁粉处加热,加热一会儿后再将导管插入肥皂水中。回答下列问题。
(1) 实验结束时,应如何操作?
【答案】 先从肥皂水中撤出导管,再移去燃着的酒精灯。
(2) 点燃导管口放出的气体有何现象?
【答案】 可听到爆鸣声或可以看到气体燃烧,火焰呈淡蓝色。
(3) 反应后生成黑色磁性氧化物,写出发生反应的化学方程式。
(4) 在钢铁生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,这是为什么?
【答案】 如果不充分的干燥,炽热的铁水或钢水会与水反应,并生产氢气,存在安全隐患。
1.按下列实验方案制备Fe(OH)3、Fe(OH)2,记录实验现象并加以解释。
活动二:尝试制备两种铁的氢氧化物
实验方案 实验现象 解释
(用化学方程式表示)
(1)Fe(OH)3的制备 在一支试管中加入2 mL的
FeCl3溶液,滴加几滴NaOH溶液,观察现象
试管中有红褐色
沉淀生成
FeCl3+3NaOH===
Fe(OH)3↓+3NaCl
实验方案 实验现象 解释
(用化学方程式表示)
(2)Fe(OH)2的制备 在一支试管中加入2 mL的
FeCl2溶液,滴加几滴NaOH溶液,观察现象
试管中有灰白色沉淀生成,既而迅速变成灰绿色,最后变成红褐色
FeCl2+2NaOH===
Fe(OH)2↓+2NaCl;
4Fe(OH)2+O2+
2H2O===4Fe(OH)3
2.制备较纯净的Fe(OH)2。
实验室制备Fe(OH)2,因其易被空气氧化,很难观察到明显的Fe(OH)2的白色沉淀。
现将实验(如右图所示)进行如下改进:
(1) 先将NaOH溶液加热煮沸,目的是_______________________。
(2) 将长滴管伸入FeSO4溶液液面以下再滴加NaOH,其优点是______ ___________________________________。
赶跑其中溶有的氧气
防止
空气随NaOH溶液的加入进入溶液
(3) 在FeSO4溶液上方加一层煤油的目的是_______________________ ____。
(4) 将反应后的悬浊液倒在滤纸上,看到的现象是什么?
【答案】 白色沉淀立即变成灰绿色,最后变成红褐色。
防止空气与FeSO4溶液接
触
1.实验探究Fe2O3中铁元素的化合价。
实验试剂:Fe2O3、盐酸溶液、NaOH溶液、KSCN溶液。
已知:Fe3+与KSCN溶液会变成红色。
活动三:探究Fe2+和Fe3+的检验方法
实验方案 实验现象 解释(用离子方程式表示)
方案一:取少量Fe2O3于试管中,滴加稀盐酸至固体全部溶解后,再加入NaOH溶液
红色粉末逐渐溶解,溶液呈黄色,滴加NaOH溶液,有红褐色沉淀生成
Fe2O3+6H+===2Fe3++3H2O;
Fe3++3OH-===Fe(OH)3↓
实验方案 实验现象 解释(用离子方程式表示)
方案二:取少量Fe2O3于试管中,滴加稀盐酸至固体全部溶解后,再滴加几滴KSCN溶液
红色粉末逐渐溶解,溶液呈黄色,滴加KSCN溶液后溶液变为红色
Fe2O3+6H+===2Fe3++3H2O;
Fe3++3SCN-===Fe(SCN)3
2.设计一个简单的实验方案,探究FeO中铁元素的化合价。
实验试剂:FeO、盐酸溶液、NaOH溶液、KSCN溶液、氯水。
已知:Cl2能将Fe2+氧化为Fe3+。
【答案】 方案一:取少量FeO于试管中,滴加稀盐酸至固体全部溶解后,再加入NaOH溶液,出现灰白色沉淀,迅速变成灰绿色,最终变为红褐色,说明FeO中铁元素的化合价为+2价。
方案二:取少量FeO于试管中,滴加稀盐酸至固体全部溶解后,滴加几滴KSCN溶液,无明显现象,再加入新制的氯水,溶液变成红色,说明FeO中铁元素的化合价为+2价。
活动四:实验探究Fe2+和Fe3+的相互转化
实验方案 实验现象 解释
(用离子方程式表示)
(1)取3 mL FeCl3的稀溶液加入试管中,加入铜粉,振荡,向反应后的溶液中滴加KSCN溶液
(2)取3 mL FeCl3的稀溶液加入试管中,加入铁粉,振荡,向反应后的溶液中滴加KSCN溶液
铜粉逐渐溶解,溶液变为蓝绿色,滴加KSCN溶液无明显现象
Cu+2Fe3+ ===Cu2++2Fe2+
铁粉逐渐溶解,溶液变成浅绿色,滴加KSCN溶液无明显现象
2Fe3++Fe===3Fe2+
实验方案 实验现象 解释
(用离子方程式表示)
(3)取(1)中的上清液,向其中滴加少量氯水
(4)取(2)中的上清液,向其中滴加少量盐酸和双氧水
溶液变成红色
2Fe2++Cl2===2Fe3++2Cl- ;
Fe3++3SCN-===Fe(SCN)3
溶液变成红色
2Fe2++H2O2+2H+===2Fe3++2H2O;
Fe3++3SCN-===Fe(SCN)3
1.请在价类二维图中填充相关物质[Fe 、Fe2O3、FeO、Fe2+、 Fe3+、Fe(OH)2、Fe(OH)3],并用箭头表示其中的物质转化(转化需注明反应条件和反应物)。
活动五:利用价类二维图整理铁及其化合物的相互转化
并实现物质的转化
【答案】
2.设计以Fe3O4为原料制取Fe2O3的流程图,可以不止一种。
2
4
5
1
3
1.某溶液中加入KSCN溶液无明显现象,再滴加氯水,立即变成红色,说明原溶液中一定含有( )
A.Fe3+ B.Fe2+
C.Cu2+ D.Zn2+
B
2
4
5
1
3
2.下列说法错误的是( )
A.仅用KSCN可以检验Fe2+
B.仅用NaOH可以检验Fe3+
C.通过化合反应可以得到Fe(OH)3
D.通过化合反应可以得到FeCl2
A
2
4
5
1
3
3.王老师在课堂上用下图装置演示铁与水蒸气的反应。
2
4
5
1
3
(1) 装置A、C的作用分别是___________________________________、______________。
(2) 装置B中发生的反应为_____________________________________ (写出化学方程式)。
(3) 检验产生气体的方法是_____________________________________ _______________________。
作为水蒸气发生器(或用来产生水蒸气)
干燥产生的氢气
将试管D管口向下移近酒精灯,若听到爆
鸣声,说明有氢气产生
2
4
5
1
3
4.在右图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2。
(1) 在试管Ⅰ、Ⅱ里加入的试剂分别是______________、____________。
(2) 为了制得白色Fe(OH)2沉淀,应确保实验在无氧状态下进行。在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是__________ ___________________________________________________________。
(3) 这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________ ______________________________________________________________。
稀硫酸、铁屑
NaOH溶液
检验试管
Ⅱ出口处排出的H2的纯度,当排出的H2纯净时,再夹紧止水夹
试管Ⅰ
中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
2
4
5
1
3
5.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题。
(1) 分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________________。
(2) 甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。FeCl2溶液与氯水反应的离子方程式为________________ _______________。
(3) 乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_______________________________________。
防止Fe2+被氧化
2Fe2++Cl2===
2Fe3++2Cl-
隔绝空气(或排除氧气对实验的影响)
2
4
5
1
3
(4) 丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于2支试管中进行如下实验:
已知:K3[Fe(CN)6]能与Fe2+生成蓝色沉淀。
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀。
实验②的目的是检验还原产物,该还原产物是_______(填离子符号);
由实验可知,两溶液混合发生反应的离子方程式为_________________ _____________。
Fe2+
2Fe3++2I-===I2
+2Fe2+
2
4
5
1
3
(5) 丁组同学向盛有H2O2溶液的试管中加入几滴盐酸酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______________________ _____________。
H2O2+2Fe2++2H+===
2Fe3++2H2O
谢谢观看
Thank you for watching
