第3章 第2节 课题2 物质的量在化学方程式计算中的应用(共26张ppt)
文档属性
| 名称 | 第3章 第2节 课题2 物质的量在化学方程式计算中的应用(共26张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 874.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
第三章
铁 金属材料
第二节 金属材料
课题2 物质的量在化学方程式计算
中的应用
内容索引
学习目标
活动方案
课堂反馈
1.能熟练掌握以物质的量为中心的不同物理量之间的换算。
2.能选择应用不同的方法进行物质的量在化学方程式中的应用计算。
3.掌握常见守恒法在计算中的应用。
4.体会定量研究的方法对研究和学习化学的重要作用。
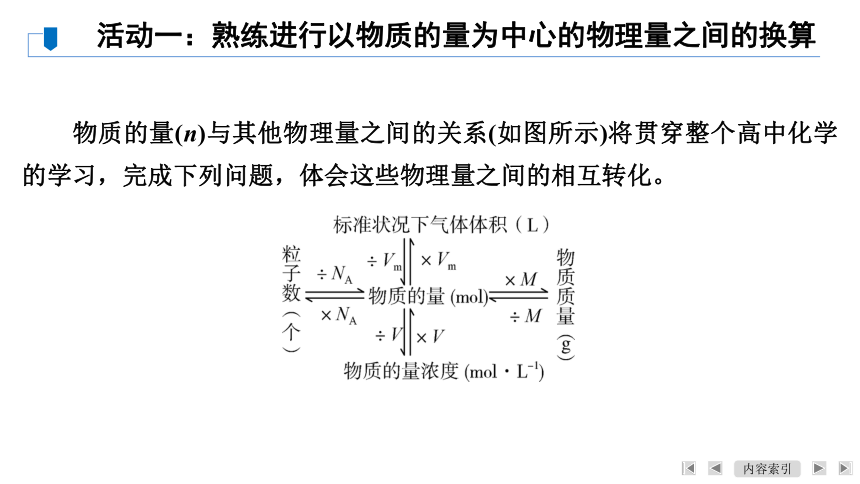
物质的量(n)与其他物理量之间的关系(如图所示)将贯穿整个高中化学的学习,完成下列问题,体会这些物理量之间的相互转化。
活动一:熟练进行以物质的量为中心的物理量之间的换算
1.下列说法正确的有_______________(填序号)。
(1) 28 g N2中的N原子的物质的量:n(N)=1 mol。
(2) 标准状况下,22.4 L O3中所含氧元素的质量:m(O)=48 g。
(3) 7.4 g Ca(OH)2溶于水,所得OH-的物质的量浓度:c(OH-)=0.2 mol·L-1。
(4) 配制1 L 0.5 mol·L-1的盐酸,需要HCl(g)的质量:m(HCl)=18.25 g。
(5) 标准状况下,11.2 L H2中的电子数:N(e-)=6.02×1023。
(2)(4)(5)
2.若血浆中K+的质量浓度是0.195 g·L-1,则K+的物质的量浓度是多少?
【答案】 5×10-3 mol·L-1
1.学习利用化学方程式进行化学反应中的计算。
(1) 向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,计算:
①NaOH溶液的物质的量浓度。
②生成H2在标准状况下的体积。
【答案】 ①c(NaOH)=0.8 mol·L-1
②V(H2)=13.44 L
活动二:寻找反应体系中反应物与生成物之间的定量关系
(2) 高锰酸钾纯度的测定:称取1.080 g 样品,溶解后定容于100 mL的容量瓶中,摇匀。取浓度为0.200 0 mol·L-1 H2C2O4标准溶液 20.00 mL,加入稀硫酸酸化,用高锰酸钾溶液平行滴定三次,平均消耗的体积为24.48 mL。计算该样品的纯度(列出算式即可)。
2.探究运用各种守恒关系在化学计算中的应用。
(1) 应用原子守恒计算。
工业上用CaCO3质量分数为90%的石灰石生产纯净的生石灰。
①该石灰石100 kg 完全分解产生V(CO2)=_________L(标准状况下)。
②石灰窑中,该石灰石100 kg 与焦炭混合焙烧,产生CO2 29 120 L(标准状况下),如果石灰石完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量n(焦炭) =______mol。
(提示:通过分析碳原子的“来龙去脉”,根据碳原子守恒解题)
20 160
400
(2) 应用电荷守恒计算。
在a L硫酸铝和硫酸铵的混合溶液中加入b mol氯化钡,恰好使溶液中的硫酸根离子完全沉淀,若加入足量强碱并加热可得到c mol氨气。
b mol
c mol
(3) 应用电子守恒计算。
用滴定法测定摩尔盐(NH4)2Fe(SO4)2产品中Fe2+的含量:称取4.0 g样品,溶于水,加入适量稀硫酸,用0.2 mol·L-1 KMnO4溶液滴定,达到终点时,消耗10.00 mL KMnO4溶液。
②该产品中铁元素的质量分数为__________。
③应用电子守恒仿照①,找出其他类似关系式:___________________ ________________________________________。
n(Fe2+)
14%
5n(Mn2+)=n(Fe3+)、5n(Mn2+)=n(Fe2+)
独立完成下列问题,将你的独特解法与大家分享。
1.过氧化钠能与水发生反应:2Na2O2+2H2O===4NaOH+O2↑,该反应也可以用于实验室制取氧气。某同学用该反应制取标准状况下1.12 L 氧气。
(1) 至少需要称取过氧化钠的质量m(Na2O2)=__________。
(2) 若反应所得氢氧化钠溶液的体积是200 mL,该溶液中c(NaOH)=_____________。
活动三:选择合适的策略定量解决有关实际问题
7.8 g
1 mol·L-1
2.某复盐[KxFey(SO4)m](铁元素的化合价为+3)其组成可用如下方法测定:
准确称取1.148 g样品配成100 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体1.864 g。滤液以淀粉为指示剂,用0.125 0 mol·L-1的KI溶液滴定,消耗32.00 mL KI,至终点。请计算(写出计算过程):
已知:Fe3++I-——Fe2++I2(未配平)。
(2) 消耗的KI溶液中的n(K+)。
(3) 确定该复盐的化学式。
(2) n(K+)=0.004 mol
(3) KFe(SO4)2
2
4
5
1
3
7
6
8
1.下列金属在适当条件下与水作用均能生成气体。当它们分别与足量水作用消耗等物质的量的物质时,生成的气体在标准状况下所占体积最大的是( )
A.钠 B.钾
C.镁 D.铁
D
2
4
5
1
3
7
6
8
2.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应所生成的气体在相同状况下体积相等时,反应中消耗的铝的物质的量之比是
( )
A.3∶1 B.2∶1
C.1∶1 D.1∶3
C
2
4
5
1
3
7
6
8
3.在实验室中,可用二氧化锰和浓盐酸反应制取Cl2,当有36.5 g HCl被氧化时,可生成Cl2( )
A.35.5 g B.36.5 g
C.71 g D.73 g
A
2
4
5
1
3
7
6
8
4.20 mL 0.05 mol·L-1某金属氯化物恰好与20 mL 0.1 mol·L-1 AgNO3溶液完全反应.则该氯化物的化学式为( )
A.RCl B.RCl2
C.RCl3 D.RCl4
B
2
4
5
1
3
7
6
8
5.32 g Cu与足量稀硝酸完全反应,产物有Cu(NO3)2、NO、H2O,则生成NO( )
A
2
4
5
1
3
7
6
8
A.+4 B.+3
C.+2 D.+1
A
2
4
5
1
3
7
6
8
7.为测定某铜器表面Cux(OH)yClz(Cu元素为+2价,x、y、z为正整数)的组成,现进行如下实验:取少量Cux(OH)yClz,将其完全溶解于稀硝酸中,将所得溶液分成两等份。向其中一份滴加足量AgNO3溶液,将所得沉淀过滤、洗涤、干燥,得到固体0.143 5 g;向另一份中加入0.100 0 mol·L-1 EDTA(已知Cu2+与EDTA反应的化学计量数比为1∶1),恰好完全反应时消耗EDTA 20 mL。则Cux(OH)yClz的化学式中y的值为( )
A.1 B.2
C.3 D.4
C
2
4
1
3
7
6
8
5
8.实验室测定水泥样品中钙含量的过程如下图所示:
45.0%
谢谢观看
Thank you for watching
第三章
铁 金属材料
第二节 金属材料
课题2 物质的量在化学方程式计算
中的应用
内容索引
学习目标
活动方案
课堂反馈
1.能熟练掌握以物质的量为中心的不同物理量之间的换算。
2.能选择应用不同的方法进行物质的量在化学方程式中的应用计算。
3.掌握常见守恒法在计算中的应用。
4.体会定量研究的方法对研究和学习化学的重要作用。
物质的量(n)与其他物理量之间的关系(如图所示)将贯穿整个高中化学的学习,完成下列问题,体会这些物理量之间的相互转化。
活动一:熟练进行以物质的量为中心的物理量之间的换算
1.下列说法正确的有_______________(填序号)。
(1) 28 g N2中的N原子的物质的量:n(N)=1 mol。
(2) 标准状况下,22.4 L O3中所含氧元素的质量:m(O)=48 g。
(3) 7.4 g Ca(OH)2溶于水,所得OH-的物质的量浓度:c(OH-)=0.2 mol·L-1。
(4) 配制1 L 0.5 mol·L-1的盐酸,需要HCl(g)的质量:m(HCl)=18.25 g。
(5) 标准状况下,11.2 L H2中的电子数:N(e-)=6.02×1023。
(2)(4)(5)
2.若血浆中K+的质量浓度是0.195 g·L-1,则K+的物质的量浓度是多少?
【答案】 5×10-3 mol·L-1
1.学习利用化学方程式进行化学反应中的计算。
(1) 向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,计算:
①NaOH溶液的物质的量浓度。
②生成H2在标准状况下的体积。
【答案】 ①c(NaOH)=0.8 mol·L-1
②V(H2)=13.44 L
活动二:寻找反应体系中反应物与生成物之间的定量关系
(2) 高锰酸钾纯度的测定:称取1.080 g 样品,溶解后定容于100 mL的容量瓶中,摇匀。取浓度为0.200 0 mol·L-1 H2C2O4标准溶液 20.00 mL,加入稀硫酸酸化,用高锰酸钾溶液平行滴定三次,平均消耗的体积为24.48 mL。计算该样品的纯度(列出算式即可)。
2.探究运用各种守恒关系在化学计算中的应用。
(1) 应用原子守恒计算。
工业上用CaCO3质量分数为90%的石灰石生产纯净的生石灰。
①该石灰石100 kg 完全分解产生V(CO2)=_________L(标准状况下)。
②石灰窑中,该石灰石100 kg 与焦炭混合焙烧,产生CO2 29 120 L(标准状况下),如果石灰石完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量n(焦炭) =______mol。
(提示:通过分析碳原子的“来龙去脉”,根据碳原子守恒解题)
20 160
400
(2) 应用电荷守恒计算。
在a L硫酸铝和硫酸铵的混合溶液中加入b mol氯化钡,恰好使溶液中的硫酸根离子完全沉淀,若加入足量强碱并加热可得到c mol氨气。
b mol
c mol
(3) 应用电子守恒计算。
用滴定法测定摩尔盐(NH4)2Fe(SO4)2产品中Fe2+的含量:称取4.0 g样品,溶于水,加入适量稀硫酸,用0.2 mol·L-1 KMnO4溶液滴定,达到终点时,消耗10.00 mL KMnO4溶液。
②该产品中铁元素的质量分数为__________。
③应用电子守恒仿照①,找出其他类似关系式:___________________ ________________________________________。
n(Fe2+)
14%
5n(Mn2+)=n(Fe3+)、5n(Mn2+)=n(Fe2+)
独立完成下列问题,将你的独特解法与大家分享。
1.过氧化钠能与水发生反应:2Na2O2+2H2O===4NaOH+O2↑,该反应也可以用于实验室制取氧气。某同学用该反应制取标准状况下1.12 L 氧气。
(1) 至少需要称取过氧化钠的质量m(Na2O2)=__________。
(2) 若反应所得氢氧化钠溶液的体积是200 mL,该溶液中c(NaOH)=_____________。
活动三:选择合适的策略定量解决有关实际问题
7.8 g
1 mol·L-1
2.某复盐[KxFey(SO4)m](铁元素的化合价为+3)其组成可用如下方法测定:
准确称取1.148 g样品配成100 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体1.864 g。滤液以淀粉为指示剂,用0.125 0 mol·L-1的KI溶液滴定,消耗32.00 mL KI,至终点。请计算(写出计算过程):
已知:Fe3++I-——Fe2++I2(未配平)。
(2) 消耗的KI溶液中的n(K+)。
(3) 确定该复盐的化学式。
(2) n(K+)=0.004 mol
(3) KFe(SO4)2
2
4
5
1
3
7
6
8
1.下列金属在适当条件下与水作用均能生成气体。当它们分别与足量水作用消耗等物质的量的物质时,生成的气体在标准状况下所占体积最大的是( )
A.钠 B.钾
C.镁 D.铁
D
2
4
5
1
3
7
6
8
2.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应所生成的气体在相同状况下体积相等时,反应中消耗的铝的物质的量之比是
( )
A.3∶1 B.2∶1
C.1∶1 D.1∶3
C
2
4
5
1
3
7
6
8
3.在实验室中,可用二氧化锰和浓盐酸反应制取Cl2,当有36.5 g HCl被氧化时,可生成Cl2( )
A.35.5 g B.36.5 g
C.71 g D.73 g
A
2
4
5
1
3
7
6
8
4.20 mL 0.05 mol·L-1某金属氯化物恰好与20 mL 0.1 mol·L-1 AgNO3溶液完全反应.则该氯化物的化学式为( )
A.RCl B.RCl2
C.RCl3 D.RCl4
B
2
4
5
1
3
7
6
8
5.32 g Cu与足量稀硝酸完全反应,产物有Cu(NO3)2、NO、H2O,则生成NO( )
A
2
4
5
1
3
7
6
8
A.+4 B.+3
C.+2 D.+1
A
2
4
5
1
3
7
6
8
7.为测定某铜器表面Cux(OH)yClz(Cu元素为+2价,x、y、z为正整数)的组成,现进行如下实验:取少量Cux(OH)yClz,将其完全溶解于稀硝酸中,将所得溶液分成两等份。向其中一份滴加足量AgNO3溶液,将所得沉淀过滤、洗涤、干燥,得到固体0.143 5 g;向另一份中加入0.100 0 mol·L-1 EDTA(已知Cu2+与EDTA反应的化学计量数比为1∶1),恰好完全反应时消耗EDTA 20 mL。则Cux(OH)yClz的化学式中y的值为( )
A.1 B.2
C.3 D.4
C
2
4
1
3
7
6
8
5
8.实验室测定水泥样品中钙含量的过程如下图所示:
45.0%
谢谢观看
Thank you for watching
