第4章 第3节 化学键(共31张ppt)
文档属性
| 名称 | 第4章 第3节 化学键(共31张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-16 19:52:23 | ||
图片预览











文档简介
(共31张PPT)
第四章
物质结构 元素周期律
第三节 化学键
内容索引
学习目标
活动方案
课堂反馈
1. 认识化学键的含义;知道离子键和共价键的形成。
2. 了解离子化合物、共价化合物的概念,并能判断常见的离子化合物和共价化合物。
3. 学会书写常见原子、离子、分子、离子化合物的电子式,能够用电子式表示常见的简单离子化合物、共价分子的形成过程。
4. 能从化学键变化的角度认识化学反应的实质。
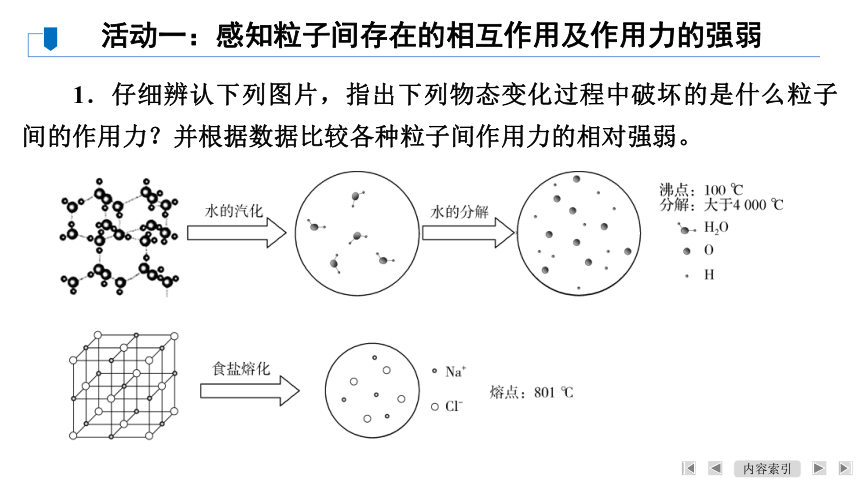
1.仔细辨认下列图片,指出下列物态变化过程中破坏的是什么粒子间的作用力?并根据数据比较各种粒子间作用力的相对强弱。
活动一:感知粒子间存在的相互作用及作用力的强弱
【答案】 水的汽化,破坏的是分子间的作用力;水的分解,破坏的是水分子中氢、氧原子间的作用力;食盐的熔化,破坏的是钠离子和氯离子间的作用力。水分子中氢、氧原子间的作用力>食盐中钠离子和氯离子间的作用力>水分子间的作用力。
2.化学键是原子或离子间存在的强烈的相互作用。你认为上述有关物质中,哪些粒子间可能存在化学键?并将这些化学键按下列标准进行分类。
化学键 离子键
(阴、阳离子间的强相互作用) 共价键
(原子间的强烈相互作用)
存在化学键的粒子
Na+、Cl-
H原子、O原子
1.利用导电性实验判断离子化合物和共价化合物。
离子化合物在熔融状态下可以导电,而共价化合物不导电。根据下列物质在熔融状态下的导电性,判断哪些是离子化合物?哪些是共价化合物?
活动二:探究离子化合物、共价化合物的判断方法
物质 NaOH H2O SiC MgO HCl
熔融状态下的导电性 导电 不导电 不导电 导电 不导电
化合物类型
【答案】 NaOH、MgO为离子化合物;H2O、SiC、HCl为共价化合物。
2.根据组成化合物的元素判断离子化合物和共价化合物。
根据上述判断出的离子化合物和共价化合物的元素组成,你认为什么元素能形成离子化合物?什么元素能形成共价化合物?
【答案】 活泼金属元素与活泼非金属元素可形成离子化合物;非金属元素与非金属元素可形成共价化合物。
3.AlCl3在熔融状态下不导电,是共价化合物,NH4Cl、(NH4)2SO4等铵盐是离子化合物。这两个案例对我们判断化合物的类型有什么启发?
【答案】 判断化合物的类型不能完全依据元素的种类,应结合化合物的性质来进行判断。
活动三:探究离子键、共价键的形成
2.原子都有形成稳定结构的趋势:氢原子最外层没有电子或具有2个电子时是稳定结构;多数原子最外层具有8个电子时是稳定结构。上述原子如何才能变成稳定结构?
【答案】 钠原子失去1个电子;镁原子失去两个电子;氮原子得到3个电子;氯原子得到1个电子;钙原子失去两个电子。
4.共价化合物中的原子间通过共用电子对形成稳定结构,请按照示例写出下列共价化合物的电子式。
【答案】
(2) 由同种原子形成的共价键,两个原子吸引电子的能力相同,共用电子对不发生偏向,成键原子不显电性,这样的共价键叫作非极性共价键,简称非极性键;不同原子形成的共价键,共用电子对会偏向吸引电子能力强的一方,成键原子显电性,这样的共价键叫作极性共价键,简称极性键。CH4、N2、H2O和NH3中分别含有什么类型的共价键?
【答案】 CH4中含有极性共价键;N2中含有非极性共价键;H2O中含有极性共价键;NH3中含有极性共价键。
5.分子具有一定的空间构型,请根据分子的结构模型判断分子的空间构型。
【答案】 (1)直线形 (2) V形 (3) 正四面体形
6.仿照下列示例,用电子式表示下列离子化合物、共价分子的形成过程。
示例:①
②
(1) MgO:_______________________________________;
(2) CCl4:______________________________。
阅读下列材料,回答问题:
除电子式外,还常用结构式表示共价分子。在结构式中,原子间用短线表示其中的共用电子对。如H—Cl(氯氢单键、极性共价键),H—O—H(氢氧单键、极性共价键),N≡N(氮氮三键、非极性共价键),O===C===O (碳氧双键、极性共价键)等。
活动四:从化学键变化的角度认识化学反应的实质
1. 说说单键、双键、三键的含义是什么?如何判断共价键是极性共价键还是非极性共价键?极性共价键具有极性的原因是什么?
【答案】 原子与原子之间以1个共用电子对形成的共价键是单键;原子与原子之间以2个共用电子对形成的共价键是双键;原子与原子之间以3个共用电子对形成的共价键是三键。
不同元素原子间形成的共价键是极性共价键;相同元素原子间形成的共价键是非极性共价键。
不同元素原子间形成共价键时,原子吸引电子的能力不同,共用电子对偏向吸引电子能力强的一方,使之显负电性,而吸引电子能力弱的一方显正电性。
2. 化学反应的实质是旧化学键的断裂与新化学键的形成。请你描述N2与H2发生化学反应生成NH3的过程中化学键的断裂与形成情况。
【答案】 N2中的N≡N共价键发生断裂生成N原子,H2中的H—H共价键发生断裂生成H原子,N、H原子结合形成新的N—H共价键。
2
4
5
1
3
7
9
6
8
1.下列性质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水 B.熔融状态能导电
C.水溶液能导电 D.有较高的熔点
B
2
4
5
1
3
7
9
6
8
2.下面是一些常见分子的模型。其中1个分子中只含有2对共用电子对的是( )
A.氮分子 B.氨分子 C.水分子 D.二氧化碳分子
C
2
4
5
1
3
7
9
6
8
3.下列叙述不正确的是( )
A.共价化合物可能含有离子键
B.CCl4和NH3都是只含有极性键的共价化合物
C.Na2O2是含有非极性键的离子化合物
D.CaO和NaCl晶体熔化时要破坏离子键
A
2
4
5
1
3
7
9
6
8
4.下列物质含有共价键的是( )
A.KCl B.MgO
C.H2O D.Na2O
C
2
4
5
1
3
7
9
6
8
5.下列既含有离子键,又含有共价键的化合物是( )
A.HCl B.NH4NO3
C.MgCl2 D.H2SO4
B
2
4
5
1
3
7
9
6
8
6.某元素原子最外层只有1个电子,它跟卤素原子相结合时,所形成的化学键( )
A.一定是共价键
B.一定是离子键
C.可能是共价键,也可能是离子键
D.以上说法均不正确
C
2
4
5
1
3
7
9
6
8
7.下列物质的电子式中,碳原子不满足8电子的是 ( )
A B C D
A
2
4
1
3
7
9
6
8
5
8.现有X、Y、Z、W四种元素,它们的原子序数分别为6、10、11、17,下列判断错误的是( )
A.X和W能形成共价化合物 B.Z和W能形成离子化合物
C.Y和Z不能形成化合物 D.Y分子中存在共价键
D
2
4
1
3
7
9
6
8
5
根据各图表示的结构特点,分别写出这些分子的化学式。
A__________、B__________、C__________、D__________。
NH3
HCN
CO2
BF3
谢谢观看
Thank you for watching
第四章
物质结构 元素周期律
第三节 化学键
内容索引
学习目标
活动方案
课堂反馈
1. 认识化学键的含义;知道离子键和共价键的形成。
2. 了解离子化合物、共价化合物的概念,并能判断常见的离子化合物和共价化合物。
3. 学会书写常见原子、离子、分子、离子化合物的电子式,能够用电子式表示常见的简单离子化合物、共价分子的形成过程。
4. 能从化学键变化的角度认识化学反应的实质。
1.仔细辨认下列图片,指出下列物态变化过程中破坏的是什么粒子间的作用力?并根据数据比较各种粒子间作用力的相对强弱。
活动一:感知粒子间存在的相互作用及作用力的强弱
【答案】 水的汽化,破坏的是分子间的作用力;水的分解,破坏的是水分子中氢、氧原子间的作用力;食盐的熔化,破坏的是钠离子和氯离子间的作用力。水分子中氢、氧原子间的作用力>食盐中钠离子和氯离子间的作用力>水分子间的作用力。
2.化学键是原子或离子间存在的强烈的相互作用。你认为上述有关物质中,哪些粒子间可能存在化学键?并将这些化学键按下列标准进行分类。
化学键 离子键
(阴、阳离子间的强相互作用) 共价键
(原子间的强烈相互作用)
存在化学键的粒子
Na+、Cl-
H原子、O原子
1.利用导电性实验判断离子化合物和共价化合物。
离子化合物在熔融状态下可以导电,而共价化合物不导电。根据下列物质在熔融状态下的导电性,判断哪些是离子化合物?哪些是共价化合物?
活动二:探究离子化合物、共价化合物的判断方法
物质 NaOH H2O SiC MgO HCl
熔融状态下的导电性 导电 不导电 不导电 导电 不导电
化合物类型
【答案】 NaOH、MgO为离子化合物;H2O、SiC、HCl为共价化合物。
2.根据组成化合物的元素判断离子化合物和共价化合物。
根据上述判断出的离子化合物和共价化合物的元素组成,你认为什么元素能形成离子化合物?什么元素能形成共价化合物?
【答案】 活泼金属元素与活泼非金属元素可形成离子化合物;非金属元素与非金属元素可形成共价化合物。
3.AlCl3在熔融状态下不导电,是共价化合物,NH4Cl、(NH4)2SO4等铵盐是离子化合物。这两个案例对我们判断化合物的类型有什么启发?
【答案】 判断化合物的类型不能完全依据元素的种类,应结合化合物的性质来进行判断。
活动三:探究离子键、共价键的形成
2.原子都有形成稳定结构的趋势:氢原子最外层没有电子或具有2个电子时是稳定结构;多数原子最外层具有8个电子时是稳定结构。上述原子如何才能变成稳定结构?
【答案】 钠原子失去1个电子;镁原子失去两个电子;氮原子得到3个电子;氯原子得到1个电子;钙原子失去两个电子。
4.共价化合物中的原子间通过共用电子对形成稳定结构,请按照示例写出下列共价化合物的电子式。
【答案】
(2) 由同种原子形成的共价键,两个原子吸引电子的能力相同,共用电子对不发生偏向,成键原子不显电性,这样的共价键叫作非极性共价键,简称非极性键;不同原子形成的共价键,共用电子对会偏向吸引电子能力强的一方,成键原子显电性,这样的共价键叫作极性共价键,简称极性键。CH4、N2、H2O和NH3中分别含有什么类型的共价键?
【答案】 CH4中含有极性共价键;N2中含有非极性共价键;H2O中含有极性共价键;NH3中含有极性共价键。
5.分子具有一定的空间构型,请根据分子的结构模型判断分子的空间构型。
【答案】 (1)直线形 (2) V形 (3) 正四面体形
6.仿照下列示例,用电子式表示下列离子化合物、共价分子的形成过程。
示例:①
②
(1) MgO:_______________________________________;
(2) CCl4:______________________________。
阅读下列材料,回答问题:
除电子式外,还常用结构式表示共价分子。在结构式中,原子间用短线表示其中的共用电子对。如H—Cl(氯氢单键、极性共价键),H—O—H(氢氧单键、极性共价键),N≡N(氮氮三键、非极性共价键),O===C===O (碳氧双键、极性共价键)等。
活动四:从化学键变化的角度认识化学反应的实质
1. 说说单键、双键、三键的含义是什么?如何判断共价键是极性共价键还是非极性共价键?极性共价键具有极性的原因是什么?
【答案】 原子与原子之间以1个共用电子对形成的共价键是单键;原子与原子之间以2个共用电子对形成的共价键是双键;原子与原子之间以3个共用电子对形成的共价键是三键。
不同元素原子间形成的共价键是极性共价键;相同元素原子间形成的共价键是非极性共价键。
不同元素原子间形成共价键时,原子吸引电子的能力不同,共用电子对偏向吸引电子能力强的一方,使之显负电性,而吸引电子能力弱的一方显正电性。
2. 化学反应的实质是旧化学键的断裂与新化学键的形成。请你描述N2与H2发生化学反应生成NH3的过程中化学键的断裂与形成情况。
【答案】 N2中的N≡N共价键发生断裂生成N原子,H2中的H—H共价键发生断裂生成H原子,N、H原子结合形成新的N—H共价键。
2
4
5
1
3
7
9
6
8
1.下列性质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水 B.熔融状态能导电
C.水溶液能导电 D.有较高的熔点
B
2
4
5
1
3
7
9
6
8
2.下面是一些常见分子的模型。其中1个分子中只含有2对共用电子对的是( )
A.氮分子 B.氨分子 C.水分子 D.二氧化碳分子
C
2
4
5
1
3
7
9
6
8
3.下列叙述不正确的是( )
A.共价化合物可能含有离子键
B.CCl4和NH3都是只含有极性键的共价化合物
C.Na2O2是含有非极性键的离子化合物
D.CaO和NaCl晶体熔化时要破坏离子键
A
2
4
5
1
3
7
9
6
8
4.下列物质含有共价键的是( )
A.KCl B.MgO
C.H2O D.Na2O
C
2
4
5
1
3
7
9
6
8
5.下列既含有离子键,又含有共价键的化合物是( )
A.HCl B.NH4NO3
C.MgCl2 D.H2SO4
B
2
4
5
1
3
7
9
6
8
6.某元素原子最外层只有1个电子,它跟卤素原子相结合时,所形成的化学键( )
A.一定是共价键
B.一定是离子键
C.可能是共价键,也可能是离子键
D.以上说法均不正确
C
2
4
5
1
3
7
9
6
8
7.下列物质的电子式中,碳原子不满足8电子的是 ( )
A B C D
A
2
4
1
3
7
9
6
8
5
8.现有X、Y、Z、W四种元素,它们的原子序数分别为6、10、11、17,下列判断错误的是( )
A.X和W能形成共价化合物 B.Z和W能形成离子化合物
C.Y和Z不能形成化合物 D.Y分子中存在共价键
D
2
4
1
3
7
9
6
8
5
根据各图表示的结构特点,分别写出这些分子的化学式。
A__________、B__________、C__________、D__________。
NH3
HCN
CO2
BF3
谢谢观看
Thank you for watching
