沪教版化学九年级上册 第三章物质构成的奥秘复习课件(共31张PPT)
文档属性
| 名称 | 沪教版化学九年级上册 第三章物质构成的奥秘复习课件(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-17 14:27:53 | ||
图片预览









文档简介
(共31张PPT)
第三章 物质构成的奥秘
复习课件
0
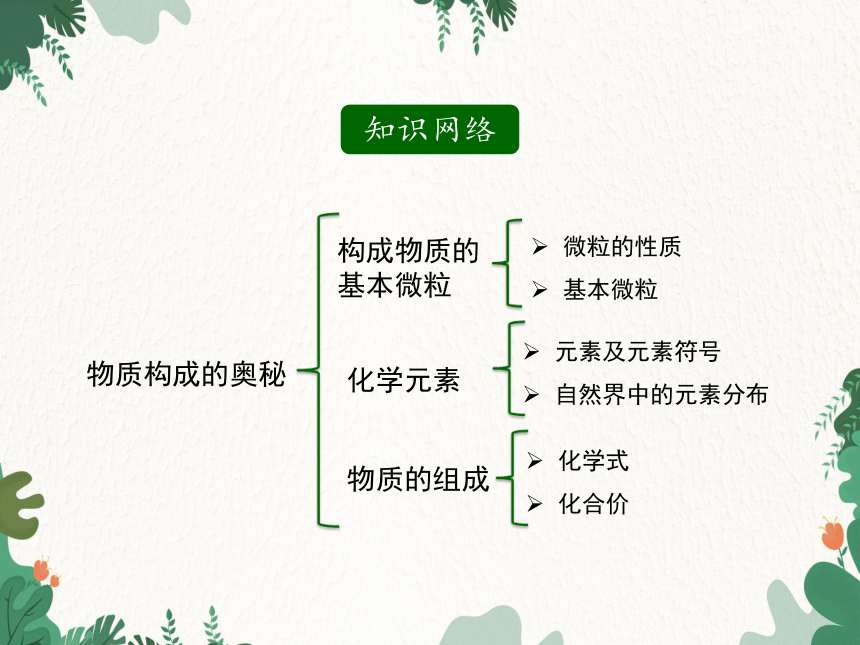
知识网络
物质构成的奥秘
构成物质的基本微粒
微粒的性质
基本微粒
元素及元素符号
自然界中的元素分布
化学元素
化学式
化合价
物质的组成
知识回顾
1.微粒的基本性质
(1)微粒的质量和体积都很_____;
(2)微粒总在不停地_______;
(3)微粒之间有_______;
(4)构成同种物质的微粒性质______。
知识点1 构成物质的基本微粒
小
相同
运动
间隔
2.研究表明,构成物质的基本微粒有______、_______和________。
(1)分子
①分子由______构成。
②构成同种物质的分子性质______,不同种物质的分子性质______。
③化学变化的微观解释:_________________________________。
分子
原子
离子
原子
相同
不同
分子分解为原子,原子又结合为新分子
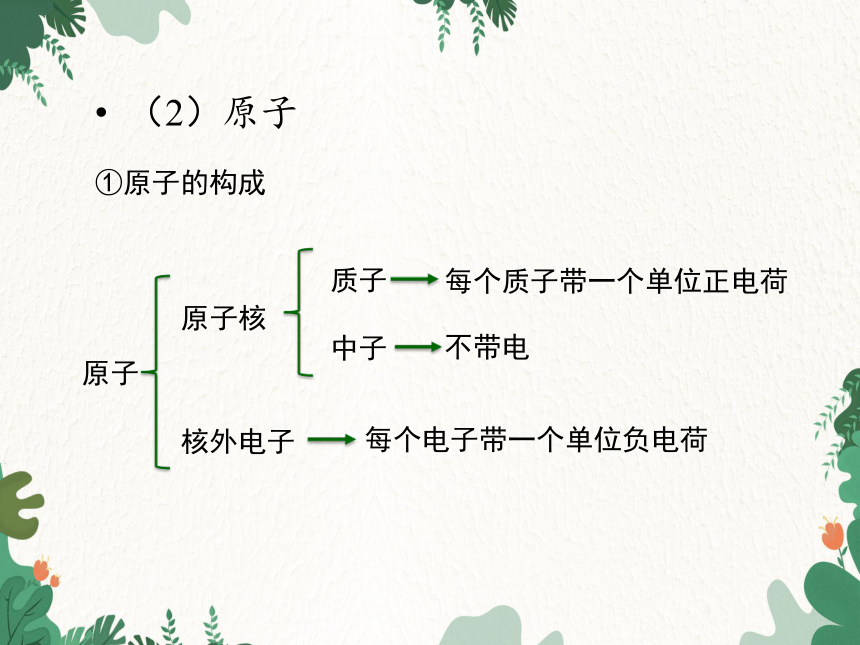
(2)原子
①原子的构成
原子
原子核
质子
中子
核外电子
每个质子带一个单位正电荷
不带电
每个电子带一个单位负电荷
构成原子的各粒子间的关系
①构成原子的粒子有三种:_________________。但并不是所有的原子都是由这三种粒子构成的,如氢原子中只有一个质子和一个电子,没有中子。
②原子核内质子所带电荷与核外电子的电荷数____,电性________,所以原子___________。
③原子核所带电荷数叫做核电荷数。
核电荷数=_________=______________
质子、中子、电子
相等
相反
不显电性
质子数
核外电子数
②相对原子质量
相对原子质量(Ar)=
原子的实际质量
碳12原子质量的1/12
③相对分子质量
分子的相对分子质量等于分子中所含原子的____________________。
相对原子质量之和
(3)离子
①形成:原子______________电子形成离子。
②离子的形成与_______________有密切联系。
③离子符号
在原子符号的________,用数字表示得失_____的数目,用“+”“-”表示______。
右上角
电子
电性
得到或失去
原子核外电子
知识点2 元素
1.元素的概念
元素是______(即核电荷数)相同的一类原子的总称。
质子数
2.元素的化学性质
(1)元素的化学性质与其原子的核外电子排布,特别是______________________有关。
(2)在化学变化时,_____的种类不变,_____也不变。
最外层电子的数目
元素
原子
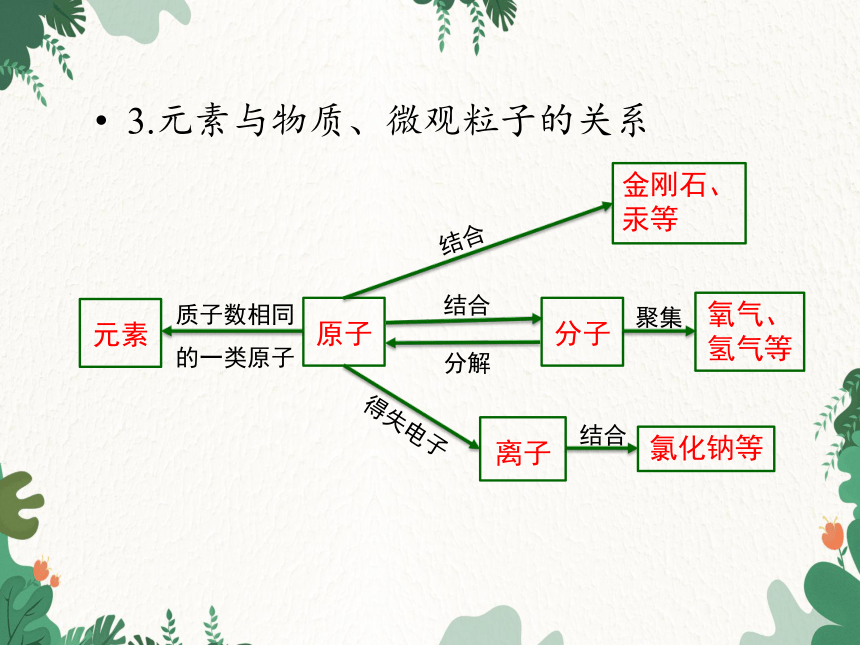
3.元素与物质、微观粒子的关系
原子
元素
质子数相同的一类原子
金刚石、汞等
分子
氧气、氢气等
离子
氯化钠等
结合
结合
分解
聚集
得失电子
结合
4.元素符号
(1)书写:“一大二小”。
(2)元素符号的意义
①表示一种______;
②表示这种元素的一个______;
③对于由单个原子构成的单质,还表示这种______。
如Fe。
元素
原子
物质
(1)单质
由_______元素组成的_________叫做单质。通常可以分为_______单质和_________单质。
(2)化合物
由_______元素组成的_________叫做化合物。如果化合物仅由两种元素组成且其中一种元素是氧元素,则此化合物称为_________。
5.纯净物分类
纯净物
同种
金属
非金属
不同种
纯净物
氧化物
(1)地壳中含量最多的元素是________,含量最多的金属元素是________。
(2)生物细胞中含量居前四位的元素是:
____(65%)、碳(18%)、氢(10%)、_____(3%)。
(3)空气中含量最多的元素是____________。
(4)宇宙中含量最多的元素是____________。
(5)海洋中含量最多的元素是____________。
氧元素
铝元素
氧
氮
氮元素
氢元素
7.自然界中的元素分布
氧元素
知识点3 物质的组成
1.化学式
(1)概念:用_____________和数字组合表示物质组成的式子。
(2)意义
化学式不仅能表示某种物质及其组成______,还能表示各元素的原子或离子之间的_____________。
元素符号
元素
数量关系
2.化学式的书写
(1)单质化学式的书写
①由原子直接构成的物质,用___________表示。
②双原子分子或多原子分子构成的单质,用______________________表示。
(2)化合物化学式的书写
化合物的化学式可以根据元素的_________书写。
元素符号
元素符号和原子个数
化合价
(1)概念
化学上用“__________”来体现不同元素的原子相互化合时具有确定的原子个数比的性质。
(2)化合价的表示方法
①元素的化合价标注在元素符号的_________;
②用“+”“-”号表示正负价,用数值表示价位,价位为1的数值__________。
3.化合价
化合价
正上方
不省略
(3)化合价的应用
根据:化合物中元素正负化合价的代数和为______。
①根据元素化合价书写化合物的化学式;
②求化合物中某元素的化合价;
③检验化学式的正误。
零
4.纯净物中元素之间的质量关系
1.计算物质组成元素的质量比
二氧化碳(CO2)中C、O元素的质量比为_____。
2.计算物质中某元素的质量分数
二氧化碳(CO2)中O元素的质量分数为_______。
3:8
72.7%
例题解析
命题角度:考查学生对微粒性质的认识。
例1下列操作或现象与分子的特性不对应的选项是( )
A.给篮球充气(分子间有间隔)
B.在花园中可闻到花的香味(分子是运动的)
C.加热氧化汞可得到金属汞和氧气(分子是可以再分的)
D.100mL酒精和100mL水混合在一起,体积小于200mL(分子是有质量的)
类型一 微粒的性质
D
【解析】A.给篮球充气是由于分子间有间隙,压强增大,分子间间隔变小,故A正确;
B.在花园中可闻到花的香味,原因是分子在不断运动,具有香味的分子运动到空气中,进入人们的鼻孔,故B正确;
C.加热氧化汞可得到金属汞和氧气,原因是氧化汞分子分裂成了汞原子和氧原子,然后氧原子重新组合形成氧分子,大量的氧分子聚集成氧气,大量的汞原子聚集成金属汞.故C正确;
D.100ml酒精和100ml水混合在一起,体积小于200ml,原因是分子间有间隔,与分子质量的大小无关.故D错误,符合题意。
故选:D。
【变式题】下列生活中常见现象用微观粒子解释不正确的是( )
现象 解释
A 温度计中的水银球受热体积膨胀 汞原子受热体积变大
B 25m3的石油气在加压情况下可装入容积为0.024m3的钢瓶中 气体分子间间隔大,易于压缩
C 一小匙蔗糖放入20mL水中很快就“消失” 分子在不断运动
D 晴天晾晒衣服比阴天更易干燥 温度升高,分子运动速率加快
A
【解析】A.水银是金属汞的俗称,是由原子直接构成的,温度计中的水银球受热体积膨胀是利用了汞原子的间隔,故选项错误;
B.分子间有间隔,气体受压后,分子间隔变小,气体体积减小。故25m3的石油气在加压情况下可装入容积为0.024m3的钢瓶中;故选项正确.
C.一小匙蔗糖放入20mL水中很快就“消失”,是由于分子是在不断运动的,蔗糖的分子运动到水分子中间去了,故选项正确。
D.晴天晾晒衣服比阴天更易干燥,是由于温度升高,分子运动速率加快,故选项正确。
故选:A。
命题角度:考查学生原子的掌握情况。
例2(1)化学变化中的最小粒子是______。
(2)某原子的结构示意图为右图,已知
该粒子在化学反应中易得到2个电子形成
稳定结构,X═_____,该原子得到两个电子后形成的离子符号是_______.若该原子质量为a千克,碳-12原子质量为b千克,该原子相对原子质量为_________。
类型二 原子
原子
16
S2-
12a/b
(3)下列四种微粒中,具有相似的化学性质的是___________。
D
【解析】(1)化学变化中的最小粒子是原子。
(2)该粒子在化学反应中易得到2个电子形成稳定结构,即得2个电子形成8电子稳定结构,则原子的最外层应有6个电子;核外电子总数=2+8+6=16,原子中质子数X等于核外电子数16;质子数为16的元素为S,该元素得到两个电子后形成的离子是带两个负电荷的硫离子,根据离子的表示方法可表示为:S2-;若该原子质量为a千克,碳-12原子质量为b千克,该原子相对原子质量为=12a/b。
(3)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,可得:
A.②的结构为原子,③的结构为离子,化学性质跟它的原子的最外层电子数目关系非常密切,故A错误;
B.①的结构为原子,③的结构为离子,化学性质跟它的原子的最外层电子数目关系非常密切,故B错误;
C.②、④都为原子结构,最外层电子数不相同,化学性质不同,故C错误;
D.①、④都为原子结构,最外层电子数相同,化学性质相似,故D正确。故选:D。
例3下列四个推断中,正确的是( )
A.氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物
B.一种元素与另一种元素的区别是它们的核电荷数不同
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.含有多种元素的物质一定是混合物
命题角度:考查学生对元素的掌握情况。
类型三 元素
B
【解析】A.氧化物必须由两种元素组成,一种是氧元素的化合物,故A错;
B.决定元素种类的是核内质子数或核电荷数,所以一种元素与另一种元素的区别是它们的核电荷数不同,故B正确;
C.只含有一种元素的物质不一定是单质,有可能是混合物,故C错;
D.含有多种元素的物质可能是混合物,也可能是纯净物,有多种元素组成的纯净物属于化合物,故D错。
故选B。
类型四 化学式与化合价
命题角度:考查学生对化学式与化合价的认识。
例4某物质的化学式为HnMO2n,其相对分子质量是A,则M的相对原子质量是____________,M的化合价是______,当M的化合价不变时,其氧化物化学式为_________,其氧化物的相对分子质量是_______。
A-33n
+3n
M2O3n
2A-18n
【解析】某物质的化学式为HnMO2n,其相对分子质量是A,设M的相对原子质量是x,则n+x+16×2n=A,x=A-33n。
氢元素显+1价,氧元素显-2价,
设M元素的化合价是X,根据在化合物中正负化合价代数和为零,可得:(+1)×n+X+(-2)×2n=0,则X=+3n价。
当M的化合价不变时,氧元素显-2价,其氧化物化学式为M2O3n。
其氧化物的相对分子质量是(A-33n)×2+16×3n=2A-18n。
谢 谢
第三章 物质构成的奥秘
复习课件
0
知识网络
物质构成的奥秘
构成物质的基本微粒
微粒的性质
基本微粒
元素及元素符号
自然界中的元素分布
化学元素
化学式
化合价
物质的组成
知识回顾
1.微粒的基本性质
(1)微粒的质量和体积都很_____;
(2)微粒总在不停地_______;
(3)微粒之间有_______;
(4)构成同种物质的微粒性质______。
知识点1 构成物质的基本微粒
小
相同
运动
间隔
2.研究表明,构成物质的基本微粒有______、_______和________。
(1)分子
①分子由______构成。
②构成同种物质的分子性质______,不同种物质的分子性质______。
③化学变化的微观解释:_________________________________。
分子
原子
离子
原子
相同
不同
分子分解为原子,原子又结合为新分子
(2)原子
①原子的构成
原子
原子核
质子
中子
核外电子
每个质子带一个单位正电荷
不带电
每个电子带一个单位负电荷
构成原子的各粒子间的关系
①构成原子的粒子有三种:_________________。但并不是所有的原子都是由这三种粒子构成的,如氢原子中只有一个质子和一个电子,没有中子。
②原子核内质子所带电荷与核外电子的电荷数____,电性________,所以原子___________。
③原子核所带电荷数叫做核电荷数。
核电荷数=_________=______________
质子、中子、电子
相等
相反
不显电性
质子数
核外电子数
②相对原子质量
相对原子质量(Ar)=
原子的实际质量
碳12原子质量的1/12
③相对分子质量
分子的相对分子质量等于分子中所含原子的____________________。
相对原子质量之和
(3)离子
①形成:原子______________电子形成离子。
②离子的形成与_______________有密切联系。
③离子符号
在原子符号的________,用数字表示得失_____的数目,用“+”“-”表示______。
右上角
电子
电性
得到或失去
原子核外电子
知识点2 元素
1.元素的概念
元素是______(即核电荷数)相同的一类原子的总称。
质子数
2.元素的化学性质
(1)元素的化学性质与其原子的核外电子排布,特别是______________________有关。
(2)在化学变化时,_____的种类不变,_____也不变。
最外层电子的数目
元素
原子
3.元素与物质、微观粒子的关系
原子
元素
质子数相同的一类原子
金刚石、汞等
分子
氧气、氢气等
离子
氯化钠等
结合
结合
分解
聚集
得失电子
结合
4.元素符号
(1)书写:“一大二小”。
(2)元素符号的意义
①表示一种______;
②表示这种元素的一个______;
③对于由单个原子构成的单质,还表示这种______。
如Fe。
元素
原子
物质
(1)单质
由_______元素组成的_________叫做单质。通常可以分为_______单质和_________单质。
(2)化合物
由_______元素组成的_________叫做化合物。如果化合物仅由两种元素组成且其中一种元素是氧元素,则此化合物称为_________。
5.纯净物分类
纯净物
同种
金属
非金属
不同种
纯净物
氧化物
(1)地壳中含量最多的元素是________,含量最多的金属元素是________。
(2)生物细胞中含量居前四位的元素是:
____(65%)、碳(18%)、氢(10%)、_____(3%)。
(3)空气中含量最多的元素是____________。
(4)宇宙中含量最多的元素是____________。
(5)海洋中含量最多的元素是____________。
氧元素
铝元素
氧
氮
氮元素
氢元素
7.自然界中的元素分布
氧元素
知识点3 物质的组成
1.化学式
(1)概念:用_____________和数字组合表示物质组成的式子。
(2)意义
化学式不仅能表示某种物质及其组成______,还能表示各元素的原子或离子之间的_____________。
元素符号
元素
数量关系
2.化学式的书写
(1)单质化学式的书写
①由原子直接构成的物质,用___________表示。
②双原子分子或多原子分子构成的单质,用______________________表示。
(2)化合物化学式的书写
化合物的化学式可以根据元素的_________书写。
元素符号
元素符号和原子个数
化合价
(1)概念
化学上用“__________”来体现不同元素的原子相互化合时具有确定的原子个数比的性质。
(2)化合价的表示方法
①元素的化合价标注在元素符号的_________;
②用“+”“-”号表示正负价,用数值表示价位,价位为1的数值__________。
3.化合价
化合价
正上方
不省略
(3)化合价的应用
根据:化合物中元素正负化合价的代数和为______。
①根据元素化合价书写化合物的化学式;
②求化合物中某元素的化合价;
③检验化学式的正误。
零
4.纯净物中元素之间的质量关系
1.计算物质组成元素的质量比
二氧化碳(CO2)中C、O元素的质量比为_____。
2.计算物质中某元素的质量分数
二氧化碳(CO2)中O元素的质量分数为_______。
3:8
72.7%
例题解析
命题角度:考查学生对微粒性质的认识。
例1下列操作或现象与分子的特性不对应的选项是( )
A.给篮球充气(分子间有间隔)
B.在花园中可闻到花的香味(分子是运动的)
C.加热氧化汞可得到金属汞和氧气(分子是可以再分的)
D.100mL酒精和100mL水混合在一起,体积小于200mL(分子是有质量的)
类型一 微粒的性质
D
【解析】A.给篮球充气是由于分子间有间隙,压强增大,分子间间隔变小,故A正确;
B.在花园中可闻到花的香味,原因是分子在不断运动,具有香味的分子运动到空气中,进入人们的鼻孔,故B正确;
C.加热氧化汞可得到金属汞和氧气,原因是氧化汞分子分裂成了汞原子和氧原子,然后氧原子重新组合形成氧分子,大量的氧分子聚集成氧气,大量的汞原子聚集成金属汞.故C正确;
D.100ml酒精和100ml水混合在一起,体积小于200ml,原因是分子间有间隔,与分子质量的大小无关.故D错误,符合题意。
故选:D。
【变式题】下列生活中常见现象用微观粒子解释不正确的是( )
现象 解释
A 温度计中的水银球受热体积膨胀 汞原子受热体积变大
B 25m3的石油气在加压情况下可装入容积为0.024m3的钢瓶中 气体分子间间隔大,易于压缩
C 一小匙蔗糖放入20mL水中很快就“消失” 分子在不断运动
D 晴天晾晒衣服比阴天更易干燥 温度升高,分子运动速率加快
A
【解析】A.水银是金属汞的俗称,是由原子直接构成的,温度计中的水银球受热体积膨胀是利用了汞原子的间隔,故选项错误;
B.分子间有间隔,气体受压后,分子间隔变小,气体体积减小。故25m3的石油气在加压情况下可装入容积为0.024m3的钢瓶中;故选项正确.
C.一小匙蔗糖放入20mL水中很快就“消失”,是由于分子是在不断运动的,蔗糖的分子运动到水分子中间去了,故选项正确。
D.晴天晾晒衣服比阴天更易干燥,是由于温度升高,分子运动速率加快,故选项正确。
故选:A。
命题角度:考查学生原子的掌握情况。
例2(1)化学变化中的最小粒子是______。
(2)某原子的结构示意图为右图,已知
该粒子在化学反应中易得到2个电子形成
稳定结构,X═_____,该原子得到两个电子后形成的离子符号是_______.若该原子质量为a千克,碳-12原子质量为b千克,该原子相对原子质量为_________。
类型二 原子
原子
16
S2-
12a/b
(3)下列四种微粒中,具有相似的化学性质的是___________。
D
【解析】(1)化学变化中的最小粒子是原子。
(2)该粒子在化学反应中易得到2个电子形成稳定结构,即得2个电子形成8电子稳定结构,则原子的最外层应有6个电子;核外电子总数=2+8+6=16,原子中质子数X等于核外电子数16;质子数为16的元素为S,该元素得到两个电子后形成的离子是带两个负电荷的硫离子,根据离子的表示方法可表示为:S2-;若该原子质量为a千克,碳-12原子质量为b千克,该原子相对原子质量为=12a/b。
(3)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,可得:
A.②的结构为原子,③的结构为离子,化学性质跟它的原子的最外层电子数目关系非常密切,故A错误;
B.①的结构为原子,③的结构为离子,化学性质跟它的原子的最外层电子数目关系非常密切,故B错误;
C.②、④都为原子结构,最外层电子数不相同,化学性质不同,故C错误;
D.①、④都为原子结构,最外层电子数相同,化学性质相似,故D正确。故选:D。
例3下列四个推断中,正确的是( )
A.氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物
B.一种元素与另一种元素的区别是它们的核电荷数不同
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.含有多种元素的物质一定是混合物
命题角度:考查学生对元素的掌握情况。
类型三 元素
B
【解析】A.氧化物必须由两种元素组成,一种是氧元素的化合物,故A错;
B.决定元素种类的是核内质子数或核电荷数,所以一种元素与另一种元素的区别是它们的核电荷数不同,故B正确;
C.只含有一种元素的物质不一定是单质,有可能是混合物,故C错;
D.含有多种元素的物质可能是混合物,也可能是纯净物,有多种元素组成的纯净物属于化合物,故D错。
故选B。
类型四 化学式与化合价
命题角度:考查学生对化学式与化合价的认识。
例4某物质的化学式为HnMO2n,其相对分子质量是A,则M的相对原子质量是____________,M的化合价是______,当M的化合价不变时,其氧化物化学式为_________,其氧化物的相对分子质量是_______。
A-33n
+3n
M2O3n
2A-18n
【解析】某物质的化学式为HnMO2n,其相对分子质量是A,设M的相对原子质量是x,则n+x+16×2n=A,x=A-33n。
氢元素显+1价,氧元素显-2价,
设M元素的化合价是X,根据在化合物中正负化合价代数和为零,可得:(+1)×n+X+(-2)×2n=0,则X=+3n价。
当M的化合价不变时,氧元素显-2价,其氧化物化学式为M2O3n。
其氧化物的相对分子质量是(A-33n)×2+16×3n=2A-18n。
谢 谢
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
