化学人教版2019选择性必修3 3.2.1 醇(共24张ppt)
文档属性
| 名称 | 化学人教版2019选择性必修3 3.2.1 醇(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 16:31:33 | ||
图片预览





文档简介
(共24张PPT)
第三章 烃的衍生物
第2节 醇和酚
第一课时 醇
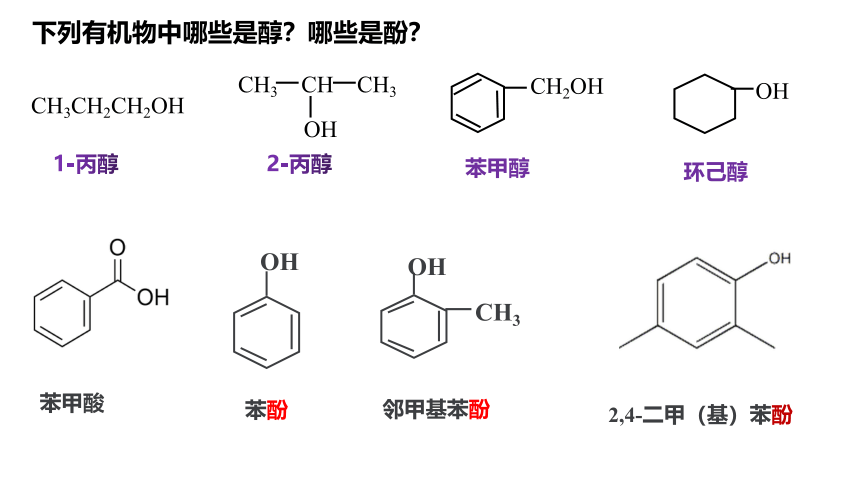
下列有机物中哪些是醇?哪些是酚?
2-丙醇
苯甲醇
CH3CH2CH2OH
CH3 CH CH3
CH2OH
OH
环己醇
OH
1-丙醇
OH
OH
CH3
2,4-二甲(基)苯酚
苯酚
邻甲基苯酚
苯甲酸
(1)定义:羟基与饱和碳原子相连的化合物称为醇。
(R1、R2、R3为H或烃基)
(2)官能团: .
(3)饱和一元醇通式: ,可简写为R—OH。
一、醇
CnH2n+1OH 或 CnH2n+2O (n≥1)
羟基(—OH)
注意:①羟基如果连在双键碳或三键碳上不稳定
②两个羟基不能连在同一个碳上。
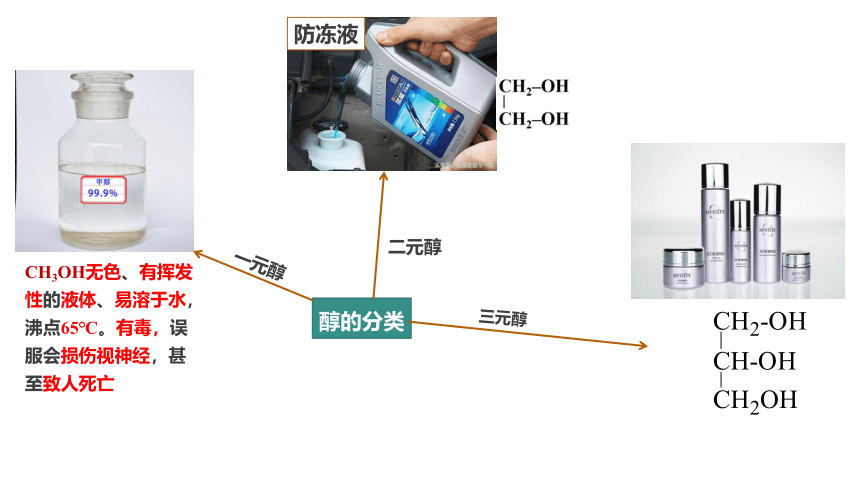
防冻液
醇的分类
CH3OH无色、有挥发性的液体、易溶于水,沸点65℃。有毒,误服会损伤视神经,甚至致人死亡
一元醇
二元醇
三元醇
2-甲基-1-丙醇
1,2,3-丙三醇(甘油)
醇的命名
(1)选主链:选择含官能团(—OH)的最长碳链为主链,称“某醇”或“某二醇”
(2)定编号:从靠官能团(—OH)的最近的一端开始编号。
(3)写名称:
2-甲基-2-丙醇
苯甲醇
2,3—二甲基—3—戊醇
2-甲基-1,3-丁二醇
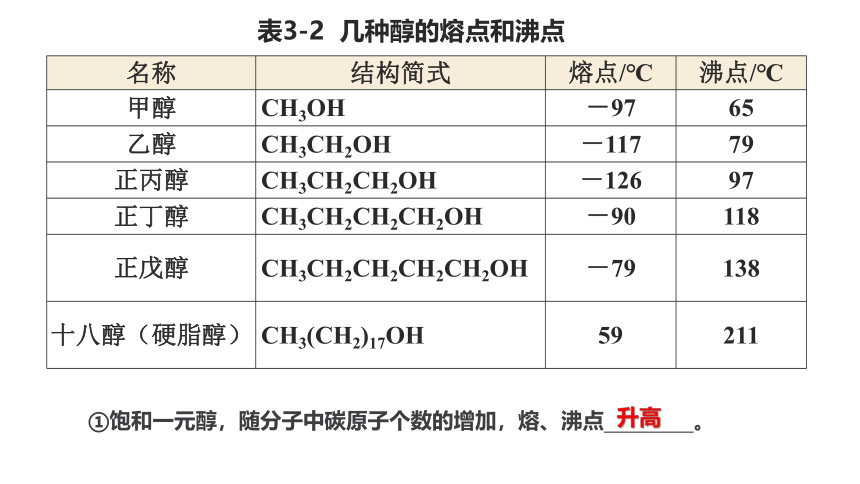
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
①饱和一元醇,随分子中碳原子个数的增加,熔、沸点 。
升高
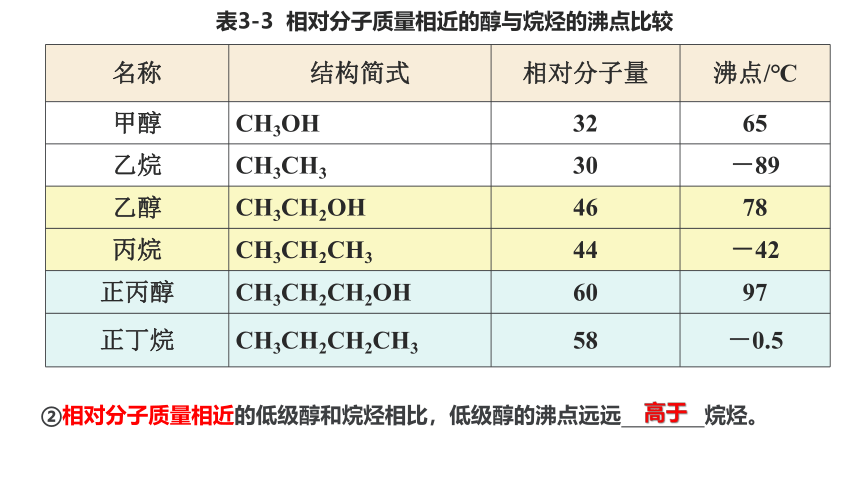
表3-3 相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
②相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远 烷烃。
高于
③相同碳原子数的饱和醇,羟基越多,沸点 ,在水中的溶解度也 。
CH3CH2OH
78℃
CH3CH2CH2OH
97℃
沸点:
197℃
290℃
越高
越大
甲醇 乙醇 正丙醇 正丁醇 正戊醇 正己醇
溶解度g/100 g水 互溶 互溶 互溶 7.7 2.6 0.59
④C1–C3的醇能与水互溶,随着烷基增大,醇的溶解度 。
减小
氢键
影响
沸点
溶解性
1、相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远高于烷烃。原因是什么?
2、甲醇、乙醇和丙醇均可以与水任意比例互溶的原因?
醇分子与水分子之间形成氢键。
思考交流
醇组成和结构
羟基:决定醇的化学性质
1、与钠的置换反应
CH3CH2OH + Na →
醇的化学性质
+ Na →
CH2OH
CH2OH
+ H2↑
CH2ONa
CH2ONa
+ Na →
CH2OH
CHOH
CH2OH
+ H2↑
CH2ONa
CHONa
CH2ONa
CH2OH
+ Na
CH2ONa
+ H2↑
2
2
2
2
2
2
6
3
→
CH3CH2ONa + H2↑
2
2
2
2mol—OH ~ 2mol Na ~ 1molH2
2、醇的取代反应
(1)酯化反应
练习: ①CH3CH2OH +
② CH3CH=CH-COOH +
同位素示踪法
CH3CH2OH + HBr
CH3CH2Br + H2O
2、醇的取代反应
(2)与氢卤酸(HX)反应
△
△
CH3CHCH3 + HCl
OH
—
Cl
—
CH3CHCH3 + H2O
可用于制备卤代烃
强碱水溶液,加热
—X被—OH取代
氢卤酸,加热
—OH被—X取代
卤代烷
醇
CH3CH2–OH+H–OCH2CH3 CH3CH2–O–CH2CH3+H2O
浓H2SO4
140℃
乙醚
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,有麻醉作用。
乙醚微溶于水,易溶于有机溶剂,本身是一种优良溶剂,能溶解多种有机物。
【醚类物质】
醚的结构可用R—O—R′来表示,R和R′都是烃基,可以相同,也可以不同。
官能团:醚键
饱和一元醚的通式:CnH2n+2O (n≥2)
2、醇的取代反应
(3)醇分子间脱水成醚
3、消去反应(分子内脱水成烯)
判断下列醇能否发生消去反应?若能,请写出反应方程式
① CH3OH
②
④
③
⑤
⑥
⑦
酸性KMnO4溶液
NaOH溶液
Br2的CCl4溶液
乙醇和浓H2SO4混合液
碎瓷片
温度计
【乙醇的消去反应实验过程】
①. 如图所示,在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL;
②. 放入几片碎瓷片
③. 加热混合液,使液体温度迅速升到170℃;
④. 将生成的气体先通入氢氧化钠溶液,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
问:
1、浓硫酸的作用是什么?
2、温度计水银球的位置?
3、为何使液体温度迅速升到170℃?
4、装置中的NaOH溶液的作用是什么?
酸性KMnO4溶液
NaOH溶液
Br2的CCl4溶液
乙醇和浓H2SO4混合液
碎瓷片
温度计
问:
1、浓硫酸的作用是什么?
催化剂和脱水剂
2、温度计水银球的位置?
水银球置于反应液中测反应物的温度。
3、为何使液体温度迅速升到170℃?
4、装置中的NaOH溶液的作用是什么?
4、氧化反应
CH3CH2OH+3O2 2CO2+3H2O
点燃
(1) 燃烧
(2) 催化氧化
2CH3CH2OH + O2
Cu或Ag
△
2CH3CHO + 2H2O
Cu
△
CH3OH
CH3CH2CH2OH
OH
CH3CH2CHCH3
CH3CHCH3
OH
CH3CHCH2OH
OH
CH3CH2CHO
HCHO
CH3CCH3
O
CH3CH2CCH3
O
CH3CCHO
O
1.
2.
4.
5.
3.
CH3CCH3
OH
CH3
7.
CH2OH
CH2OH
6.
CHO
CHO
不能被氧化
紫红色(MnO4—)退去(Mn2+)
CH3CH2OH CH3COOH
KMnO4(H+)溶液
K2Cr2O7溶液
橙色()变为绿色(Cr3+)
(3) 被强氧化剂氧化
乙醇的化学反应与断键位置
H—C—C—O—H
H H
H H
反应类型 反应物 反应条件 断键位置
置换反应 乙醇、活泼金属 — ①
取代反应 卤代 乙醇、浓HX △ ②
分子间脱水 乙醇 浓硫酸,140 ℃ ①②
酯化 乙醇、羧酸 浓硫酸,△ ①
消去反应 乙醇 浓硫酸,170 ℃ ②⑤
氧化反应 催化氧化 乙醇、O2 Cu或Ag,△ ①③
燃烧 乙醇、O2 点燃 全部
归纳小结
1、下列四种有机物的分子式均为C4H10O。
① ②CH3CH2CH2CH2OH
③ ④
(1)能被氧化成含相同碳原子数的醛的是 (填序号,下同)。
(2)能被氧化成酮的是 。
(3)写出①发生消去反应生成的有机物的结构简式:________________________
__________________________。
②③
①
CH3—CH==CHCH3、
CH3CH2CH==CH2
课堂检测
2、下列各物质中既能发生消去反应又能发生催化氧化反应,但催化氧化的产物不是醛的是 ( )
A. B.
C. D.
C
课堂检测
3、乙醇分子中不同的化学键,如图: 。
关于乙醇在各种反应中断裂键的说法不正确的是 ( )
A.乙醇和钠反应,键①断裂
B.在铜催化下和O2 反应,键①③断裂
C.乙醇制乙烯时,键②⑤断裂
D.与乙酸发生酯化反应时,键②断裂
D
课堂检测
第三章 烃的衍生物
第2节 醇和酚
第一课时 醇
下列有机物中哪些是醇?哪些是酚?
2-丙醇
苯甲醇
CH3CH2CH2OH
CH3 CH CH3
CH2OH
OH
环己醇
OH
1-丙醇
OH
OH
CH3
2,4-二甲(基)苯酚
苯酚
邻甲基苯酚
苯甲酸
(1)定义:羟基与饱和碳原子相连的化合物称为醇。
(R1、R2、R3为H或烃基)
(2)官能团: .
(3)饱和一元醇通式: ,可简写为R—OH。
一、醇
CnH2n+1OH 或 CnH2n+2O (n≥1)
羟基(—OH)
注意:①羟基如果连在双键碳或三键碳上不稳定
②两个羟基不能连在同一个碳上。
防冻液
醇的分类
CH3OH无色、有挥发性的液体、易溶于水,沸点65℃。有毒,误服会损伤视神经,甚至致人死亡
一元醇
二元醇
三元醇
2-甲基-1-丙醇
1,2,3-丙三醇(甘油)
醇的命名
(1)选主链:选择含官能团(—OH)的最长碳链为主链,称“某醇”或“某二醇”
(2)定编号:从靠官能团(—OH)的最近的一端开始编号。
(3)写名称:
2-甲基-2-丙醇
苯甲醇
2,3—二甲基—3—戊醇
2-甲基-1,3-丁二醇
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
①饱和一元醇,随分子中碳原子个数的增加,熔、沸点 。
升高
表3-3 相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
②相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远 烷烃。
高于
③相同碳原子数的饱和醇,羟基越多,沸点 ,在水中的溶解度也 。
CH3CH2OH
78℃
CH3CH2CH2OH
97℃
沸点:
197℃
290℃
越高
越大
甲醇 乙醇 正丙醇 正丁醇 正戊醇 正己醇
溶解度g/100 g水 互溶 互溶 互溶 7.7 2.6 0.59
④C1–C3的醇能与水互溶,随着烷基增大,醇的溶解度 。
减小
氢键
影响
沸点
溶解性
1、相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远高于烷烃。原因是什么?
2、甲醇、乙醇和丙醇均可以与水任意比例互溶的原因?
醇分子与水分子之间形成氢键。
思考交流
醇组成和结构
羟基:决定醇的化学性质
1、与钠的置换反应
CH3CH2OH + Na →
醇的化学性质
+ Na →
CH2OH
CH2OH
+ H2↑
CH2ONa
CH2ONa
+ Na →
CH2OH
CHOH
CH2OH
+ H2↑
CH2ONa
CHONa
CH2ONa
CH2OH
+ Na
CH2ONa
+ H2↑
2
2
2
2
2
2
6
3
→
CH3CH2ONa + H2↑
2
2
2
2mol—OH ~ 2mol Na ~ 1molH2
2、醇的取代反应
(1)酯化反应
练习: ①CH3CH2OH +
② CH3CH=CH-COOH +
同位素示踪法
CH3CH2OH + HBr
CH3CH2Br + H2O
2、醇的取代反应
(2)与氢卤酸(HX)反应
△
△
CH3CHCH3 + HCl
OH
—
Cl
—
CH3CHCH3 + H2O
可用于制备卤代烃
强碱水溶液,加热
—X被—OH取代
氢卤酸,加热
—OH被—X取代
卤代烷
醇
CH3CH2–OH+H–OCH2CH3 CH3CH2–O–CH2CH3+H2O
浓H2SO4
140℃
乙醚
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,有麻醉作用。
乙醚微溶于水,易溶于有机溶剂,本身是一种优良溶剂,能溶解多种有机物。
【醚类物质】
醚的结构可用R—O—R′来表示,R和R′都是烃基,可以相同,也可以不同。
官能团:醚键
饱和一元醚的通式:CnH2n+2O (n≥2)
2、醇的取代反应
(3)醇分子间脱水成醚
3、消去反应(分子内脱水成烯)
判断下列醇能否发生消去反应?若能,请写出反应方程式
① CH3OH
②
④
③
⑤
⑥
⑦
酸性KMnO4溶液
NaOH溶液
Br2的CCl4溶液
乙醇和浓H2SO4混合液
碎瓷片
温度计
【乙醇的消去反应实验过程】
①. 如图所示,在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL;
②. 放入几片碎瓷片
③. 加热混合液,使液体温度迅速升到170℃;
④. 将生成的气体先通入氢氧化钠溶液,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
问:
1、浓硫酸的作用是什么?
2、温度计水银球的位置?
3、为何使液体温度迅速升到170℃?
4、装置中的NaOH溶液的作用是什么?
酸性KMnO4溶液
NaOH溶液
Br2的CCl4溶液
乙醇和浓H2SO4混合液
碎瓷片
温度计
问:
1、浓硫酸的作用是什么?
催化剂和脱水剂
2、温度计水银球的位置?
水银球置于反应液中测反应物的温度。
3、为何使液体温度迅速升到170℃?
4、装置中的NaOH溶液的作用是什么?
4、氧化反应
CH3CH2OH+3O2 2CO2+3H2O
点燃
(1) 燃烧
(2) 催化氧化
2CH3CH2OH + O2
Cu或Ag
△
2CH3CHO + 2H2O
Cu
△
CH3OH
CH3CH2CH2OH
OH
CH3CH2CHCH3
CH3CHCH3
OH
CH3CHCH2OH
OH
CH3CH2CHO
HCHO
CH3CCH3
O
CH3CH2CCH3
O
CH3CCHO
O
1.
2.
4.
5.
3.
CH3CCH3
OH
CH3
7.
CH2OH
CH2OH
6.
CHO
CHO
不能被氧化
紫红色(MnO4—)退去(Mn2+)
CH3CH2OH CH3COOH
KMnO4(H+)溶液
K2Cr2O7溶液
橙色()变为绿色(Cr3+)
(3) 被强氧化剂氧化
乙醇的化学反应与断键位置
H—C—C—O—H
H H
H H
反应类型 反应物 反应条件 断键位置
置换反应 乙醇、活泼金属 — ①
取代反应 卤代 乙醇、浓HX △ ②
分子间脱水 乙醇 浓硫酸,140 ℃ ①②
酯化 乙醇、羧酸 浓硫酸,△ ①
消去反应 乙醇 浓硫酸,170 ℃ ②⑤
氧化反应 催化氧化 乙醇、O2 Cu或Ag,△ ①③
燃烧 乙醇、O2 点燃 全部
归纳小结
1、下列四种有机物的分子式均为C4H10O。
① ②CH3CH2CH2CH2OH
③ ④
(1)能被氧化成含相同碳原子数的醛的是 (填序号,下同)。
(2)能被氧化成酮的是 。
(3)写出①发生消去反应生成的有机物的结构简式:________________________
__________________________。
②③
①
CH3—CH==CHCH3、
CH3CH2CH==CH2
课堂检测
2、下列各物质中既能发生消去反应又能发生催化氧化反应,但催化氧化的产物不是醛的是 ( )
A. B.
C. D.
C
课堂检测
3、乙醇分子中不同的化学键,如图: 。
关于乙醇在各种反应中断裂键的说法不正确的是 ( )
A.乙醇和钠反应,键①断裂
B.在铜催化下和O2 反应,键①③断裂
C.乙醇制乙烯时,键②⑤断裂
D.与乙酸发生酯化反应时,键②断裂
D
课堂检测
