人教版九年级化学上册 第六单元 课题2 二氧化碳制取的研究 课件(共22张PPT)
文档属性
| 名称 | 人教版九年级化学上册 第六单元 课题2 二氧化碳制取的研究 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-18 16:44:51 | ||
图片预览





文档简介
(共22张PPT)
第六单元 碳和碳的氧化物
课题2 二氧化碳制取的研究
新课讲解
拓展延伸
随堂练习
课堂小结
新课导入
布置作业
1.了解实验室制取二氧化碳的反应原理。
2.探究实验室中制取二氧化碳的装置。
3.了解实验室中制取气体的一般思路和方法。
学习目标
重点
难点
新课讲解
拓展延伸
随堂练习
课堂小结
布置作业
新课导入
千锤万凿出深山,
烈火焚烧若等闲。
粉骨碎身浑不怕,
要留清白在人间。
《石灰吟·于谦》
CaCO3 CaO+CO2
高温
这也是二氧化碳的工业制法。
新课讲解
拓展延伸
随堂练习
课堂小结
布置作业
新课导入
二氧化碳是植物光合作用的主要原料,除此之外,二氧化碳还被广泛应用于工业、农业、生活中的很多方面。
用于灭火
做气体肥料
实验室如何制取二氧化碳气体呢?
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
思考讨论
联系所学知识和生活常识,列举你知道能生成二氧化碳的反应。
01
碳在氧气中燃烧生成二氧化碳
02
木炭还原氧化铜,生成铜和二氧化碳。
C+O2 CO2
点燃
C+2CuO 2Cu+CO2
高温
03
蜡烛燃烧会生成二氧化碳
蜡烛+氧气 二氧化碳+水
点燃
04
生物体的呼吸会产生二氧化碳
气体不纯
条件要求高
气体不纯
气体不纯
说一说这些反应是否适合实验室制取二氧化碳?为什么?
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
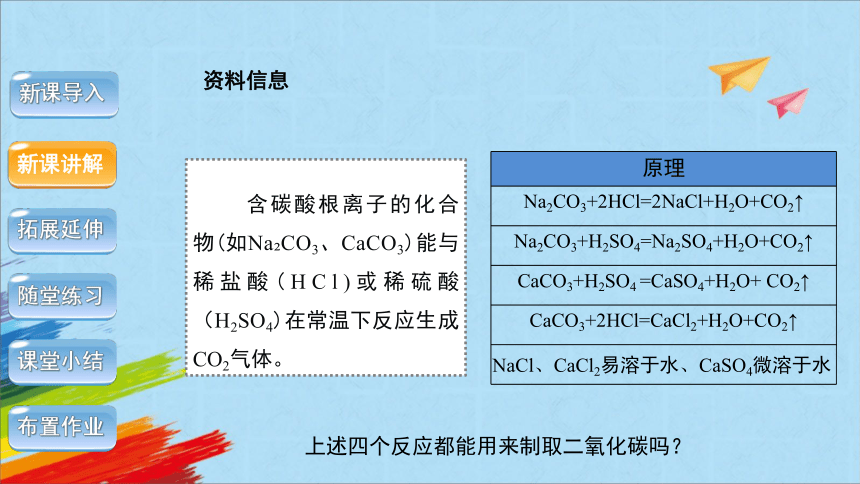
含碳酸根离子的化合物(如Na CO3、CaCO3)能与稀盐酸(HCl)或稀硫酸(H2SO4)在常温下反应生成CO2气体。
资料信息
NaCl、CaCl2易溶于水、CaSO4微溶于水
原理
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
CaCO3+H2SO4 =CaSO4+H2O+ CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
上述四个反应都能用来制取二氧化碳吗?
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
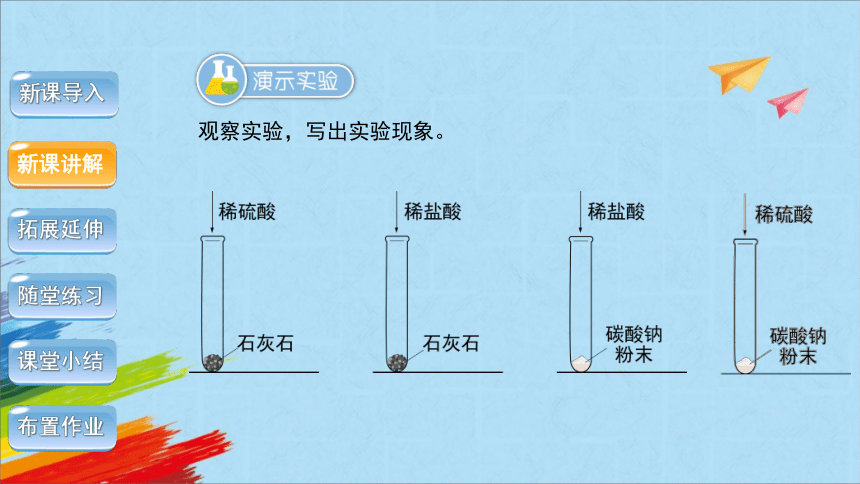
观察实验,写出实验现象。
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
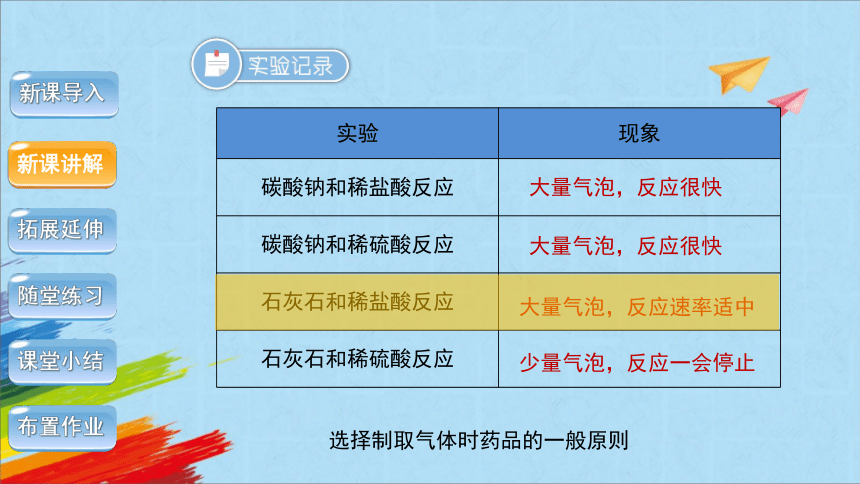
实验 现象
碳酸钠和稀盐酸反应
碳酸钠和稀硫酸反应
石灰石和稀盐酸反应
石灰石和稀硫酸反应
大量气泡,反应很快
大量气泡,反应很快
大量气泡,反应速率适中
少量气泡,反应一会停止
选择制取气体时药品的一般原则
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
选择制取气体时药品的一般原则:较易反应、反应速度适中、生成的气体纯净、易于收集、操作简便、原料廉价易得等。
药品:大理石(或石灰石)与稀盐酸
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
原理:
注意:不能用碳酸钙和稀硫酸反应制取二氧化碳,因为生成的硫酸钙微溶于水,覆盖在大理石(或石灰石)的表面,阻止反应继续进行。
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
思考讨论
1.发生装置的确定:以下实验装置,适合制取二氧化碳的有哪些?请说出原因。
根据O2的实验室制法,思考讨论以下问题:
A B C
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
2.收集装置的确定:以下实验装置,适合收集二氧化碳的有哪些?请说出原因(提示:CO2的密度大于空气的,且能溶于水)。
思考讨论
根据O2的实验室制法,思考讨论一下问题:
D E F
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
成果展示
发生装置选B或C,选择的理由是石灰石是块状固体,稀盐酸是液体,收集装置选择D,选择该装置的理由是二氧化碳的密度大于空气的密度,且能溶于水。
制取装置
收集装置
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
分组利用手中的仪器制取并收集二氧化碳气体。
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
操作步骤:
连接装置,并检查气密性。
加药品,先加石灰石,再加稀盐酸。
收集二氧化碳气体,并验满。
将燃着的木条放在集气瓶口,若木条熄灭证明CO2已收集满,否则,CO2未收集满。
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
注意事项 长颈漏斗应伸入液面以下;伸入集气瓶中的导气管口应位于集气瓶底部
检验方法 将制得的气体通入澄清石灰水,若石灰水变浑浊,则证明是CO2
放置方法 盖好玻璃片正放在桌面上
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
温
馨
提
示
1.实验中注意安全。
2.小组组员之间要合理分工。
3.注意节约药品,不要浪费。
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
气体制备的设计模式
1.发生装置的选择
主要从反应物的状态和反应的条件来选择
(1)凡是给固体加热,适用于制O2的装置,即试管横放,试管口略向下倾斜。
(2)凡是固体与液体反应制气体,且反应不需要加热,均可采用制取CO2装置,即试管直立。
2.收集装置的选择
(1)凡常温下不与空气中成分反应的气体,可根据密度与空气密度的相对大小采用向下或向上排空气法收集。
(2)凡是气体不易溶于水或难溶于水的,可采用排水法收集。
新课讲解
拓展延伸
课堂小结
新课导入
布置作业
随堂练习
1. 下列反应常用于实验室制取二氧化碳的是( )
A.高温煅烧石灰石
B.石灰石与稀硫酸反应
C.大理石与稀盐酸反应
D.木炭在氧气中燃烧
C
煅烧石灰石需要较高的温度,实验室难以达到;石灰石与稀硫酸反应生成微溶的硫酸钙,覆盖在石灰石表面,会阻止反应进一步进行,木炭燃烧产生的气体不易收集,且容易引入其他杂质。
新课讲解
拓展延伸
课堂小结
新课导入
布置作业
随堂练习
2实验室制取CO2有以下步骤,①连接好装置;②向试管中加入几小块石灰石;③向试管中加入适量稀盐酸;④检查装置气密性;⑤收集产生的气体;⑥用燃着的木条检验瓶中是否充满CO2,以上操作按由先至后的顺序排列,正确的是( )
A.①②③④⑤⑥ B.①④②③⑤⑥
C.①③②④⑤⑥ D.③①②④⑤⑥
B
解析
制取二氧化碳的操作步骤:连接仪器 检查装置气密性
加入固体药品 加入液体药品 用向上排空气法收集
用燃着的木条检验。
新课讲解
拓展延伸
随堂练习
新课导入
布置作业
课堂小结
制取装置的选择
药品的选择
收集装置的选择
二氧化碳制取的研究
布置作业
新课讲解
拓展延伸
随堂练习
课堂小结
新课导入
作业:
月 日
再见
第六单元 碳和碳的氧化物
课题2 二氧化碳制取的研究
新课讲解
拓展延伸
随堂练习
课堂小结
新课导入
布置作业
1.了解实验室制取二氧化碳的反应原理。
2.探究实验室中制取二氧化碳的装置。
3.了解实验室中制取气体的一般思路和方法。
学习目标
重点
难点
新课讲解
拓展延伸
随堂练习
课堂小结
布置作业
新课导入
千锤万凿出深山,
烈火焚烧若等闲。
粉骨碎身浑不怕,
要留清白在人间。
《石灰吟·于谦》
CaCO3 CaO+CO2
高温
这也是二氧化碳的工业制法。
新课讲解
拓展延伸
随堂练习
课堂小结
布置作业
新课导入
二氧化碳是植物光合作用的主要原料,除此之外,二氧化碳还被广泛应用于工业、农业、生活中的很多方面。
用于灭火
做气体肥料
实验室如何制取二氧化碳气体呢?
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
思考讨论
联系所学知识和生活常识,列举你知道能生成二氧化碳的反应。
01
碳在氧气中燃烧生成二氧化碳
02
木炭还原氧化铜,生成铜和二氧化碳。
C+O2 CO2
点燃
C+2CuO 2Cu+CO2
高温
03
蜡烛燃烧会生成二氧化碳
蜡烛+氧气 二氧化碳+水
点燃
04
生物体的呼吸会产生二氧化碳
气体不纯
条件要求高
气体不纯
气体不纯
说一说这些反应是否适合实验室制取二氧化碳?为什么?
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
含碳酸根离子的化合物(如Na CO3、CaCO3)能与稀盐酸(HCl)或稀硫酸(H2SO4)在常温下反应生成CO2气体。
资料信息
NaCl、CaCl2易溶于水、CaSO4微溶于水
原理
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
CaCO3+H2SO4 =CaSO4+H2O+ CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
上述四个反应都能用来制取二氧化碳吗?
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
观察实验,写出实验现象。
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
实验 现象
碳酸钠和稀盐酸反应
碳酸钠和稀硫酸反应
石灰石和稀盐酸反应
石灰石和稀硫酸反应
大量气泡,反应很快
大量气泡,反应很快
大量气泡,反应速率适中
少量气泡,反应一会停止
选择制取气体时药品的一般原则
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
选择制取气体时药品的一般原则:较易反应、反应速度适中、生成的气体纯净、易于收集、操作简便、原料廉价易得等。
药品:大理石(或石灰石)与稀盐酸
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
原理:
注意:不能用碳酸钙和稀硫酸反应制取二氧化碳,因为生成的硫酸钙微溶于水,覆盖在大理石(或石灰石)的表面,阻止反应继续进行。
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
思考讨论
1.发生装置的确定:以下实验装置,适合制取二氧化碳的有哪些?请说出原因。
根据O2的实验室制法,思考讨论以下问题:
A B C
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
2.收集装置的确定:以下实验装置,适合收集二氧化碳的有哪些?请说出原因(提示:CO2的密度大于空气的,且能溶于水)。
思考讨论
根据O2的实验室制法,思考讨论一下问题:
D E F
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
成果展示
发生装置选B或C,选择的理由是石灰石是块状固体,稀盐酸是液体,收集装置选择D,选择该装置的理由是二氧化碳的密度大于空气的密度,且能溶于水。
制取装置
收集装置
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
分组利用手中的仪器制取并收集二氧化碳气体。
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
操作步骤:
连接装置,并检查气密性。
加药品,先加石灰石,再加稀盐酸。
收集二氧化碳气体,并验满。
将燃着的木条放在集气瓶口,若木条熄灭证明CO2已收集满,否则,CO2未收集满。
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
注意事项 长颈漏斗应伸入液面以下;伸入集气瓶中的导气管口应位于集气瓶底部
检验方法 将制得的气体通入澄清石灰水,若石灰水变浑浊,则证明是CO2
放置方法 盖好玻璃片正放在桌面上
新课导入
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
温
馨
提
示
1.实验中注意安全。
2.小组组员之间要合理分工。
3.注意节约药品,不要浪费。
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
气体制备的设计模式
1.发生装置的选择
主要从反应物的状态和反应的条件来选择
(1)凡是给固体加热,适用于制O2的装置,即试管横放,试管口略向下倾斜。
(2)凡是固体与液体反应制气体,且反应不需要加热,均可采用制取CO2装置,即试管直立。
2.收集装置的选择
(1)凡常温下不与空气中成分反应的气体,可根据密度与空气密度的相对大小采用向下或向上排空气法收集。
(2)凡是气体不易溶于水或难溶于水的,可采用排水法收集。
新课讲解
拓展延伸
课堂小结
新课导入
布置作业
随堂练习
1. 下列反应常用于实验室制取二氧化碳的是( )
A.高温煅烧石灰石
B.石灰石与稀硫酸反应
C.大理石与稀盐酸反应
D.木炭在氧气中燃烧
C
煅烧石灰石需要较高的温度,实验室难以达到;石灰石与稀硫酸反应生成微溶的硫酸钙,覆盖在石灰石表面,会阻止反应进一步进行,木炭燃烧产生的气体不易收集,且容易引入其他杂质。
新课讲解
拓展延伸
课堂小结
新课导入
布置作业
随堂练习
2实验室制取CO2有以下步骤,①连接好装置;②向试管中加入几小块石灰石;③向试管中加入适量稀盐酸;④检查装置气密性;⑤收集产生的气体;⑥用燃着的木条检验瓶中是否充满CO2,以上操作按由先至后的顺序排列,正确的是( )
A.①②③④⑤⑥ B.①④②③⑤⑥
C.①③②④⑤⑥ D.③①②④⑤⑥
B
解析
制取二氧化碳的操作步骤:连接仪器 检查装置气密性
加入固体药品 加入液体药品 用向上排空气法收集
用燃着的木条检验。
新课讲解
拓展延伸
随堂练习
新课导入
布置作业
课堂小结
制取装置的选择
药品的选择
收集装置的选择
二氧化碳制取的研究
布置作业
新课讲解
拓展延伸
随堂练习
课堂小结
新课导入
作业:
月 日
再见
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
