安徽省黄山市田家炳实验中学2013-2014学年高二上学期期中考试化学试题(无答案)
文档属性
| 名称 | 安徽省黄山市田家炳实验中学2013-2014学年高二上学期期中考试化学试题(无答案) |  | |
| 格式 | zip | ||
| 文件大小 | 136.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-11-12 17:04:50 | ||
图片预览


文档简介
田家炳实验中学2013-2014学年高二上学期期中考试化学试题
第Ⅰ卷 选择题(共14题,42分)
每题3分,共42分。每题只有一个正确的选项,请正确选项的序号填在答题卷上。
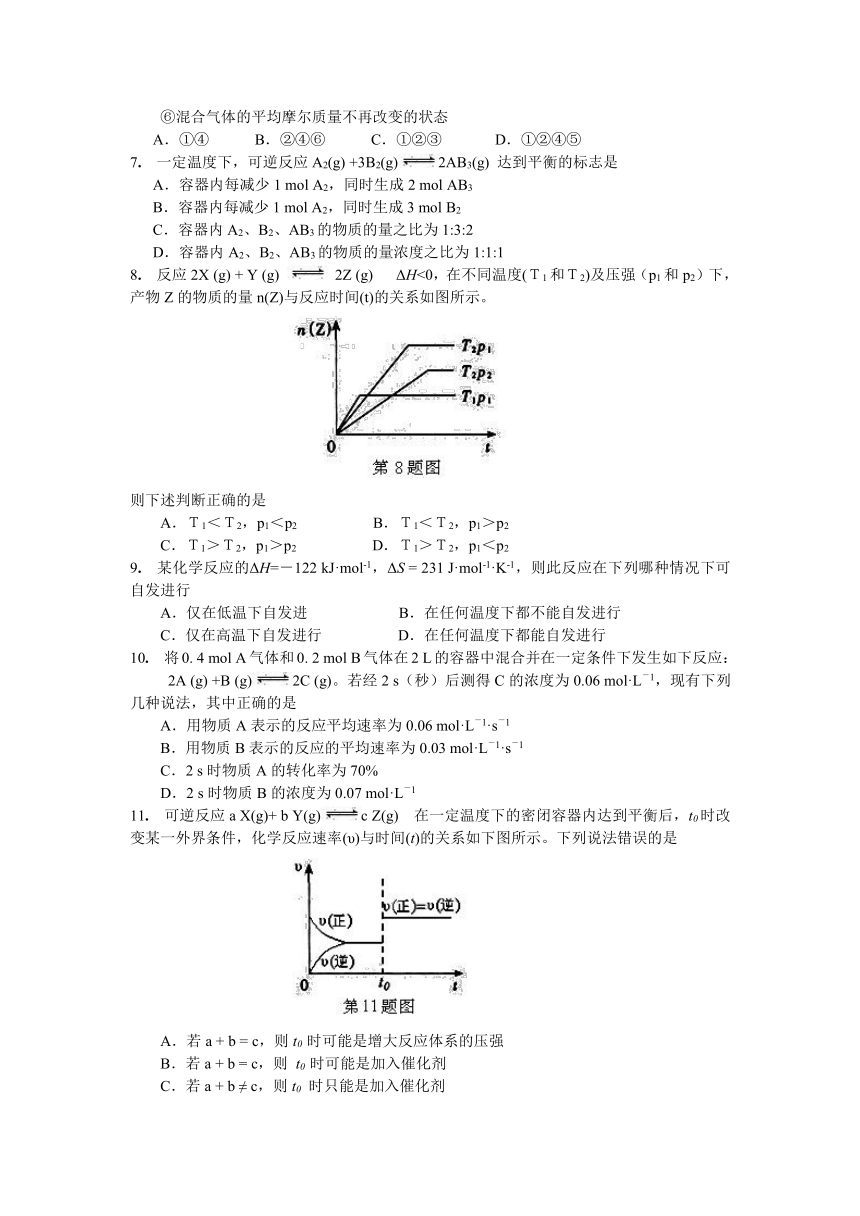
1. 大气污染问题已成影响环境的重要因素,有人想利用反应:
2CO(g)+SO2(g) 2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1
来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2. 以下是反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率,反应速率最大的是
A.υ(A) = 0.15 mol?L-1?s-1 B.υ(B) = 0.60 mol?L-1?s-1
C.υ(C) = 0.40 mol?L-1?s-1 D.υ(D) = 0.45mol?L-1?s-1
3. 下列说法中正确的是
A.任何化学反应都伴随着能量的变化
B.1 mol H2SO4和1 mol Ba(OH)2完全反应所放出的热量称为中和热
C.在101 kPa时,1 mol碳燃烧放出的热量就是碳的燃烧热
D.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据
4. 关于右图,下列说法不正确的是
A.△E1是该反应的活化能
B.△E2是该反应的反应热
C.该反应的热化学方程式为:
H2(g) + Cl2(g) =2 HCl(g) ΔH=-183kJ ? mol-1
D.该反应是一个放热反应
5. 下列叙述正确的是
A.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热
B.同温同压下,4Al(s)+3O2(g)===2Al2O3(s) 在常温和点燃条件下的ΔH不同
C.稀溶液中:H+(aq)+OH—(aq) ===H2O(l) ΔH=-57. 3kJ ? mol-1 ,则
将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57. 3kJ
D.由C (s,石墨)=== C (s,金刚石) ΔH= +1.90 kJ ? mol-1 可知,金刚石比石墨稳定
6. 可逆反应:2NO2 (g)2NO (g) + O2 (g) 在体积不变的容器中反应,下列说法中表示该反应一定达到平衡状态的有
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
A.①④ B.②④⑥ C.①②③ D.①②④⑤
7. 一定温度下,可逆反应A2(g) +3B2(g)2AB3(g) 达到平衡的标志是
A.容器内每减少1 mol A2,同时生成2 mol AB3
B.容器内每减少1 mol A2,同时生成3 mol B2
C.容器内A2、B2、AB3的物质的量之比为1:3:2
D.容器内A2、B2、AB3的物质的量浓度之比为1:1:1
8. 反应2X (g) + Y (g) 2Z (g) ΔH<0,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图所示。
则下述判断正确的是
A.T1<T2,p1<p2 B.T1<T2,p1>p2
C.T1>T2,p1>p2 D.T1>T2,p1<p2
9. 某化学反应的ΔH=-122 kJ·mol-1,ΔS = 231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.仅在低温下自发进 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.在任何温度下都能自发进行
10. 将0. 4 mol A气体和0. 2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:
2A (g) +B (g)2C (g)。若经2 s(秒)后测得C的浓度为0.06 mol·L-1,现有下列几种说法,其中正确的是
A.用物质A表示的反应平均速率为0.06 mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.03 mol·L-1·s-1
C.2?s时物质A的转化率为70%
D.2?s时物质B的浓度为0.07 mol·L-1
11. 可逆反应a X(g)+ b Y(g)c Z(g) 在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(υ)与时间(t)的关系如下图所示。下列说法错误的是
A.若a + b = c,则t0 时可能是增大反应体系的压强
B.若a + b = c,则 t0 时可能是加入催化剂
C.若a + b ≠ c,则t0 时只能是加入催化剂
D.若a + b ≠ c,则t0 时只能是增大反应体系的压强
12. 某可逆反应L(g) + G(g)3R(g) ΔH>0,右图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可能是表示
A.平衡混合气中R的质量分数
B.平衡混合气中G的质量分数
C. 达到平衡时L的转化率
D.达到平衡时以υ(R)表示的速率
13. 在密闭容器中有如下反应:a X(g) + b Y(g)n W(g) ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,得到如下曲线图:
其中,w(W)表示W在反应混合物中的体积分数,t表示反应时间。下列分析错误的是
A.图Ⅰ可能是不同压强对反应的影响,且p1 < p2,a +b < n
B.图Ⅱ可能是不同压强对反应的影响,且p1 > p2,a +b = n
C.图Ⅱ可能是在同温同压下不同催化剂对反应的影响,且1催化剂效果好
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH < 0
第Ⅱ卷 非选择题(共5题,58分)
15. (10分)已知:2SO2(g)+ O2 (g)2SO3 (g) ΔH=-196.6 kJ ? mol-1
2NO(g)+ O2 (g)2NO2 (g) ΔH=-113.0 kJ ? mol-1 在一定温度下,将NO2与SO2以体积比1∶2置于恒容密闭容器中发生反应:
NO2(g)+ SO2 (g)SO3 (g) +NO(g) 。请回答下列问题: ⑴ 反应的ΔH= kJ ? mol-1
⑵下列能说明反应达到平衡状态的是______。 a. 体系压强保持不变 b. 混合气体颜色保持不变 c. SO3与NO的体积比保持不变 d. 每消耗1mol SO3的同时生成1mol NO2 ⑶ 测得平衡时NO2与SO2体积比为1∶6,则该温度下的平衡常数K= (可用分数表示)。
16. (14分)A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同,B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C、A2C2两种常见的液态化合物。
请回答下列问题:
⑴ C位于周期表第 周期,第 族。写出A2C2的电子式 。
⑵ B、D、E三种元素的原子半径由大到小的顺序为 (填元素符号)。
⑶ C、D、E三种原子对应的离子半径由大到小的顺序是 (填离子符号)
⑷ 可逆反应:2EC2(g) + C2(g)2EC3(g) ΔH < 0
在A、B两个容器中进行。已知A容器中有一个可移动的活塞,B 容器可保持恒容(如右图所示)。若在 A 、B 中分别充入l mol C2 和2 mol EC2,使V (A ) = V ( B ),在相同温度下反应。
① 则平衡时 EC2 的转化率:α(A α(B)(填“>”、“<”或“=”)。
② 达到平衡后,在A、B中分别加入0. 1mol He,则
A中平衡 移动 (填“向正反应”、“向逆反应”或“不发生”)
B中平衡 移动 (填“向正反应”、“向逆反应”或“不发生”)
17. (10分) 已知: CO (g) + H2O (g) CO2 (g) + H2 (g)
434℃的平衡常数K1=9,800℃的平衡常数K2=1。
将1.0 mol CO与3.6 mol H2O充入100L恒容密闭容器中,在一定条件下发生反应。
⑴ 根据已知条件,推知正反应为_____________(填“放热反应”、“吸热反应”或“不能确定”)。
⑵ 434℃,反应进行到20 min时测得c(H2O)=0. 024 mol?L-1, 则前20min该反应的平均反应速率是 。
⑶ 求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程)。
18.(10分) 某同学进行了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
实验 序号
反应温度 (℃)
参加反应的物质
Na2S2O3
H2SO4
H2O
V/mL
c/mol·L-1
V/mL
c/mol·L-1
V/mL
A
20
10
0.1
10
0.1
0
B
20
5
0.1
10
0.1
5
C
20
10
0.1
5
0.1
V1
D
40
5
0.1
10
0.1
5
Na2S2O3 + H2SO4 == Na2SO4 + SO2↑+ S↓
⑴ 表中V1 = 。实验中还要测量记录的是 。
⑵ 在上述实验中反应速率最快的可能是 (填实验序号)
在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。
⑶ 能说明温度对该反应速率影响的组合是 ;(填实验序号) ⑷ A和B、A和C的组合所探究的问题是 。
19. (14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。
已知:2SO2(g)+ O2(g)2SO3(g) ΔH=-196. 6 kJ ? mol-1
⑴ 写出能表示硫的燃烧热的热化学方程式:
⑵ ΔH2=
⑶ 恒容条件下,下列措施中能使Ⅲ中n(SO3)/ n(SO2 )增大的有 。
a.升高温度; b.充入He气;
c.再充入1mol SO2 (g)和1molO 2 (g); d.使用催化剂
⑷ 某SO2 (g) 和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率(υ)与时间(t)的关系如图2所示。
若不改变SO2 (g)和O2(g)的量,则图中引起平衡移动的条件可能是:t2 ;t4 ;
e. 升高温度 f. 增大压强
g. 使用催化剂 h. 再加入少量O2
图中表示平衡混合物中SO3的含量最高的一段时间是 。
i. t1~t2 j. t3~t4 k. t5~t6 l. t6~t7
黄山市田家炳实验中学2013~2014学年度第一学期期中考试
化 学 答 题 卡
请将选择题答案填入下表:
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
得分
答案
15.(10分)
⑴
⑵
⑶
16.(14分)
⑴
⑵
⑶
⑷ ① ②
17.(10分)
⑴ ⑵
⑶
18.(10分)
⑴ ⑵
⑶ ⑷
19.(14分)
⑴
⑵ ⑶
⑷
、
第Ⅰ卷 选择题(共14题,42分)
每题3分,共42分。每题只有一个正确的选项,请正确选项的序号填在答题卷上。
1. 大气污染问题已成影响环境的重要因素,有人想利用反应:
2CO(g)+SO2(g) 2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1
来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2. 以下是反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率,反应速率最大的是
A.υ(A) = 0.15 mol?L-1?s-1 B.υ(B) = 0.60 mol?L-1?s-1
C.υ(C) = 0.40 mol?L-1?s-1 D.υ(D) = 0.45mol?L-1?s-1
3. 下列说法中正确的是
A.任何化学反应都伴随着能量的变化
B.1 mol H2SO4和1 mol Ba(OH)2完全反应所放出的热量称为中和热
C.在101 kPa时,1 mol碳燃烧放出的热量就是碳的燃烧热
D.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据
4. 关于右图,下列说法不正确的是
A.△E1是该反应的活化能
B.△E2是该反应的反应热
C.该反应的热化学方程式为:
H2(g) + Cl2(g) =2 HCl(g) ΔH=-183kJ ? mol-1
D.该反应是一个放热反应
5. 下列叙述正确的是
A.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热
B.同温同压下,4Al(s)+3O2(g)===2Al2O3(s) 在常温和点燃条件下的ΔH不同
C.稀溶液中:H+(aq)+OH—(aq) ===H2O(l) ΔH=-57. 3kJ ? mol-1 ,则
将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57. 3kJ
D.由C (s,石墨)=== C (s,金刚石) ΔH= +1.90 kJ ? mol-1 可知,金刚石比石墨稳定
6. 可逆反应:2NO2 (g)2NO (g) + O2 (g) 在体积不变的容器中反应,下列说法中表示该反应一定达到平衡状态的有
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
A.①④ B.②④⑥ C.①②③ D.①②④⑤
7. 一定温度下,可逆反应A2(g) +3B2(g)2AB3(g) 达到平衡的标志是
A.容器内每减少1 mol A2,同时生成2 mol AB3
B.容器内每减少1 mol A2,同时生成3 mol B2
C.容器内A2、B2、AB3的物质的量之比为1:3:2
D.容器内A2、B2、AB3的物质的量浓度之比为1:1:1
8. 反应2X (g) + Y (g) 2Z (g) ΔH<0,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图所示。
则下述判断正确的是
A.T1<T2,p1<p2 B.T1<T2,p1>p2
C.T1>T2,p1>p2 D.T1>T2,p1<p2
9. 某化学反应的ΔH=-122 kJ·mol-1,ΔS = 231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.仅在低温下自发进 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.在任何温度下都能自发进行
10. 将0. 4 mol A气体和0. 2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:
2A (g) +B (g)2C (g)。若经2 s(秒)后测得C的浓度为0.06 mol·L-1,现有下列几种说法,其中正确的是
A.用物质A表示的反应平均速率为0.06 mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.03 mol·L-1·s-1
C.2?s时物质A的转化率为70%
D.2?s时物质B的浓度为0.07 mol·L-1
11. 可逆反应a X(g)+ b Y(g)c Z(g) 在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(υ)与时间(t)的关系如下图所示。下列说法错误的是
A.若a + b = c,则t0 时可能是增大反应体系的压强
B.若a + b = c,则 t0 时可能是加入催化剂
C.若a + b ≠ c,则t0 时只能是加入催化剂
D.若a + b ≠ c,则t0 时只能是增大反应体系的压强
12. 某可逆反应L(g) + G(g)3R(g) ΔH>0,右图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可能是表示
A.平衡混合气中R的质量分数
B.平衡混合气中G的质量分数
C. 达到平衡时L的转化率
D.达到平衡时以υ(R)表示的速率
13. 在密闭容器中有如下反应:a X(g) + b Y(g)n W(g) ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,得到如下曲线图:
其中,w(W)表示W在反应混合物中的体积分数,t表示反应时间。下列分析错误的是
A.图Ⅰ可能是不同压强对反应的影响,且p1 < p2,a +b < n
B.图Ⅱ可能是不同压强对反应的影响,且p1 > p2,a +b = n
C.图Ⅱ可能是在同温同压下不同催化剂对反应的影响,且1催化剂效果好
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH < 0
第Ⅱ卷 非选择题(共5题,58分)
15. (10分)已知:2SO2(g)+ O2 (g)2SO3 (g) ΔH=-196.6 kJ ? mol-1
2NO(g)+ O2 (g)2NO2 (g) ΔH=-113.0 kJ ? mol-1 在一定温度下,将NO2与SO2以体积比1∶2置于恒容密闭容器中发生反应:
NO2(g)+ SO2 (g)SO3 (g) +NO(g) 。请回答下列问题: ⑴ 反应的ΔH= kJ ? mol-1
⑵下列能说明反应达到平衡状态的是______。 a. 体系压强保持不变 b. 混合气体颜色保持不变 c. SO3与NO的体积比保持不变 d. 每消耗1mol SO3的同时生成1mol NO2 ⑶ 测得平衡时NO2与SO2体积比为1∶6,则该温度下的平衡常数K= (可用分数表示)。
16. (14分)A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同,B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C、A2C2两种常见的液态化合物。
请回答下列问题:
⑴ C位于周期表第 周期,第 族。写出A2C2的电子式 。
⑵ B、D、E三种元素的原子半径由大到小的顺序为 (填元素符号)。
⑶ C、D、E三种原子对应的离子半径由大到小的顺序是 (填离子符号)
⑷ 可逆反应:2EC2(g) + C2(g)2EC3(g) ΔH < 0
在A、B两个容器中进行。已知A容器中有一个可移动的活塞,B 容器可保持恒容(如右图所示)。若在 A 、B 中分别充入l mol C2 和2 mol EC2,使V (A ) = V ( B ),在相同温度下反应。
① 则平衡时 EC2 的转化率:α(A α(B)(填“>”、“<”或“=”)。
② 达到平衡后,在A、B中分别加入0. 1mol He,则
A中平衡 移动 (填“向正反应”、“向逆反应”或“不发生”)
B中平衡 移动 (填“向正反应”、“向逆反应”或“不发生”)
17. (10分) 已知: CO (g) + H2O (g) CO2 (g) + H2 (g)
434℃的平衡常数K1=9,800℃的平衡常数K2=1。
将1.0 mol CO与3.6 mol H2O充入100L恒容密闭容器中,在一定条件下发生反应。
⑴ 根据已知条件,推知正反应为_____________(填“放热反应”、“吸热反应”或“不能确定”)。
⑵ 434℃,反应进行到20 min时测得c(H2O)=0. 024 mol?L-1, 则前20min该反应的平均反应速率是 。
⑶ 求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程)。
18.(10分) 某同学进行了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
实验 序号
反应温度 (℃)
参加反应的物质
Na2S2O3
H2SO4
H2O
V/mL
c/mol·L-1
V/mL
c/mol·L-1
V/mL
A
20
10
0.1
10
0.1
0
B
20
5
0.1
10
0.1
5
C
20
10
0.1
5
0.1
V1
D
40
5
0.1
10
0.1
5
Na2S2O3 + H2SO4 == Na2SO4 + SO2↑+ S↓
⑴ 表中V1 = 。实验中还要测量记录的是 。
⑵ 在上述实验中反应速率最快的可能是 (填实验序号)
在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。
⑶ 能说明温度对该反应速率影响的组合是 ;(填实验序号) ⑷ A和B、A和C的组合所探究的问题是 。
19. (14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。
已知:2SO2(g)+ O2(g)2SO3(g) ΔH=-196. 6 kJ ? mol-1
⑴ 写出能表示硫的燃烧热的热化学方程式:
⑵ ΔH2=
⑶ 恒容条件下,下列措施中能使Ⅲ中n(SO3)/ n(SO2 )增大的有 。
a.升高温度; b.充入He气;
c.再充入1mol SO2 (g)和1molO 2 (g); d.使用催化剂
⑷ 某SO2 (g) 和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率(υ)与时间(t)的关系如图2所示。
若不改变SO2 (g)和O2(g)的量,则图中引起平衡移动的条件可能是:t2 ;t4 ;
e. 升高温度 f. 增大压强
g. 使用催化剂 h. 再加入少量O2
图中表示平衡混合物中SO3的含量最高的一段时间是 。
i. t1~t2 j. t3~t4 k. t5~t6 l. t6~t7
黄山市田家炳实验中学2013~2014学年度第一学期期中考试
化 学 答 题 卡
请将选择题答案填入下表:
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
得分
答案
15.(10分)
⑴
⑵
⑶
16.(14分)
⑴
⑵
⑶
⑷ ① ②
17.(10分)
⑴ ⑵
⑶
18.(10分)
⑴ ⑵
⑶ ⑷
19.(14分)
⑴
⑵ ⑶
⑷
、
同课章节目录
