(2018-2022)五年高考化学真题分类汇编 专题08 水溶液中的离子平衡(学生版+解析版)
文档属性
| 名称 | (2018-2022)五年高考化学真题分类汇编 专题08 水溶液中的离子平衡(学生版+解析版) |

|
|
| 格式 | |||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-19 00:00:00 | ||
图片预览

文档简介
专题08水溶液中的离子平衡
【2022年】
1.(2022海南卷)NaC1O溶液具有添白能力,已知25℃时,K.(HCIO)=4.0×108。下列关于NaCIO溶液
说法正确的是
A.0.01mol/L溶液中,c(C1O)<0.01molL
B.长期露置在空气中,释放C2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO,+C1O+H,O=HSO,+HC1O
D.25℃,pH=7.0的NaCIO和HCIO的混合溶液中,c(HCIO)>c(C1O)=c(Na)】
2.(2022浙江卷)25℃时,苯酚(CH,OH的K,=1.0×10-0,下列说法正确的是
A.相同温度下,等pH的C,H,ONa和CH,COONa溶液中,c(CH,O)>c(CH,COO)
B.将浓度均为0.10mol·L的C。H,ONa和NaOH溶液加热,两种溶液的pH均变大
C.25℃时,C,H,OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(CH,O)=c(CH,OH)
D.25℃时,0.10mol.L的C6H,OH溶液中加少量C6H,ONa固体,水的电离程度变小
3.(2022浙江卷)25℃时,向20mL浓度均为0.1mol·L的盐酸和醋酸的混合溶液中逐滴加入0.1mol·L的
NaOH溶液(酷酸的K,=l.8×I05;用0.1mol.L的NaOH溶液滴定20mL等浓度的盐酸,滴定终点的pH突跃
范围4.3~9.7)。下列说法不正确的是
A.恰好中和时,溶液呈碱性
B.滴加NaOH溶液至pH=4.3的过程中,发生反应的离子方程式为:H+OH=H,O
C.滴定过程中,c(CI)=cCH,COO)+c(CH,COOH)
D.pH=7 c(Na*)>c(CI )>c(CH,COO )>c(CH,COOH)
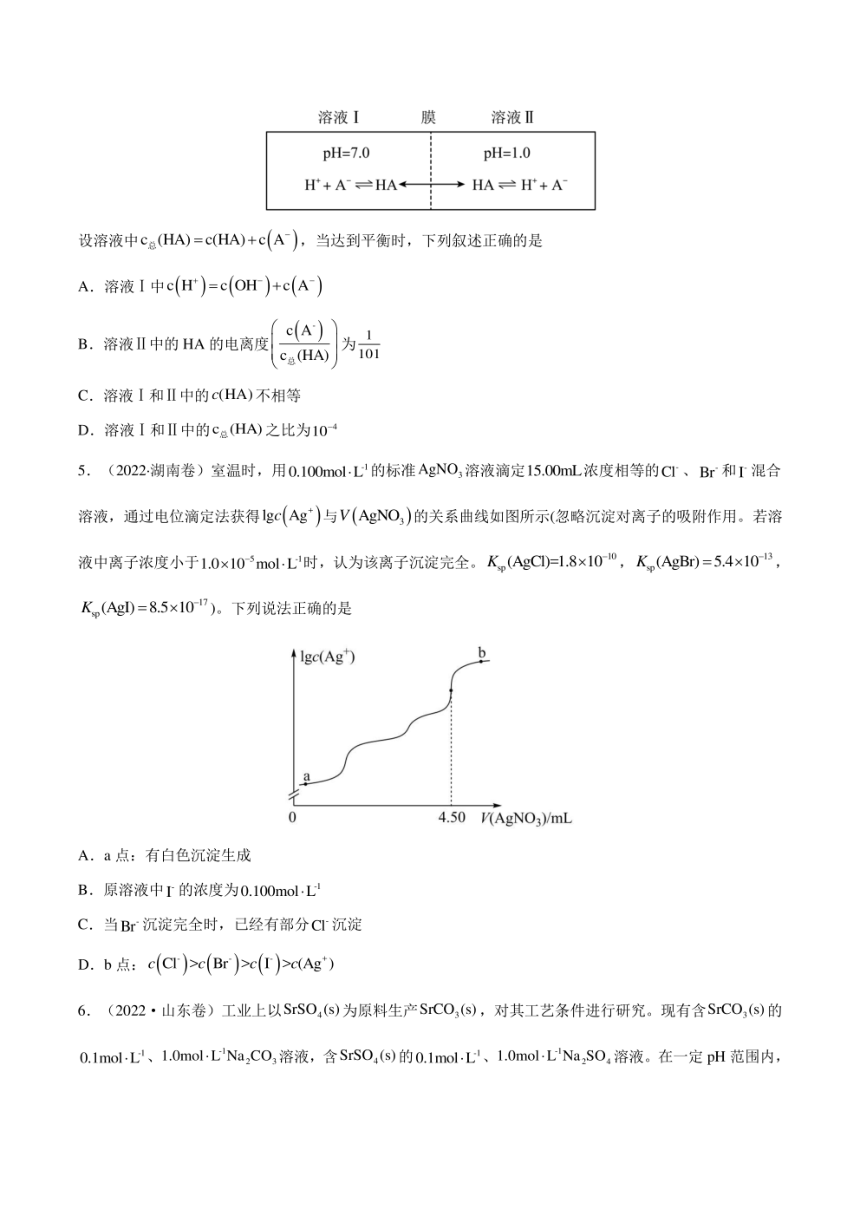
4.(2022全国乙卷)常温下,一元酸HA的K.(HA)=1.0×103。在某体系中,H与A离子不能穿过隔膜,
未电离的HA可自由穿过该膜(如图所示)。
溶液I
膜
溶液Ⅱ
pH=7.0
pH=1.0
H+A=HA←→HA=H+A
设溶液中c(HA)=c(HA)+c(A),当达到平衡时,下列叙述正确的是
A.溶液I中c(H)=c(OH)+c(A)
c(A)
B.溶液Ⅱ中的HA的电离度
1
C(HA)
为
01
C.溶液I和I中的c(HA)不相等
D.溶液I和IⅡ中的caHA)之比为10
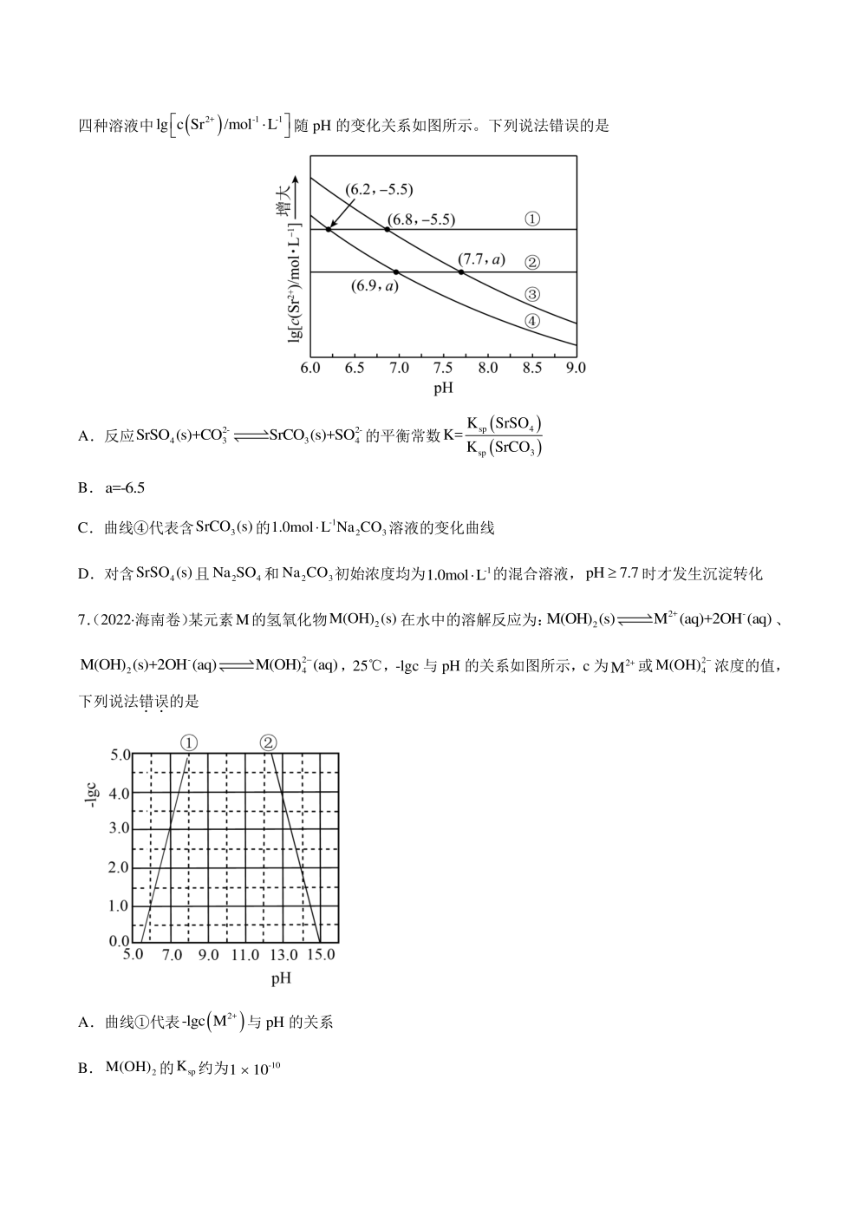
5.(2022湖南卷)室温时,用0.100mol-L的标准AgNO3溶液滴定15.00mL浓度相等的CI、Br和T混合
溶液,通过电位滴定法获得gCAg)与V(AgNO,)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶
液中离子浓度小于1.0×105molL时,认为该离子沉淀完全。Kn(AgC)=l.8×100,Kn(AgBr)=5.4×10B,
K,(Ag=8.5×10”)。下列说法正确的是
↑lgc(Ag)
a
0
4.50 V(AgNO3)/mL
A.a点:有白色沉淀生成
B.原溶液中I的浓度为0.100mol.L
C.当Br沉淀完全时,已经有部分Cr沉淀
D.b点:c(CI)>c(Br)>c(T)>c(ag)
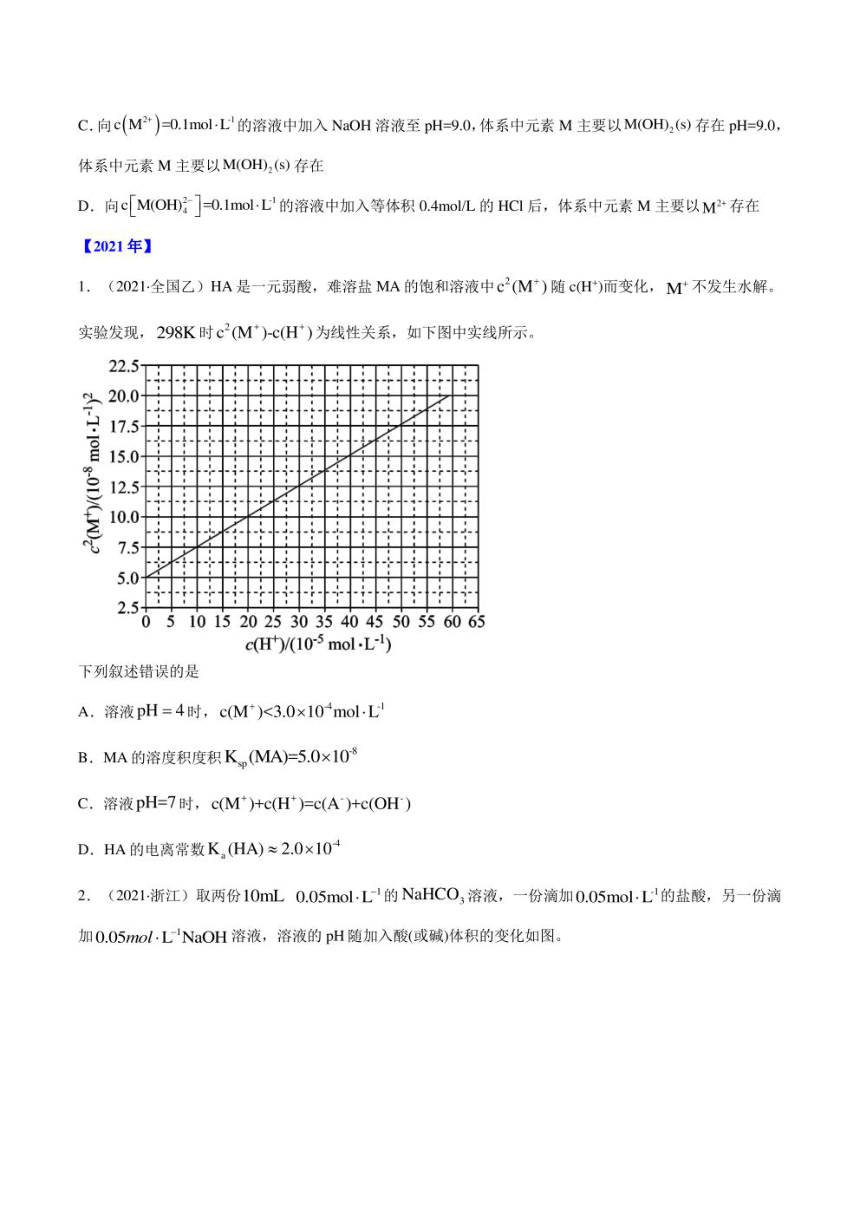
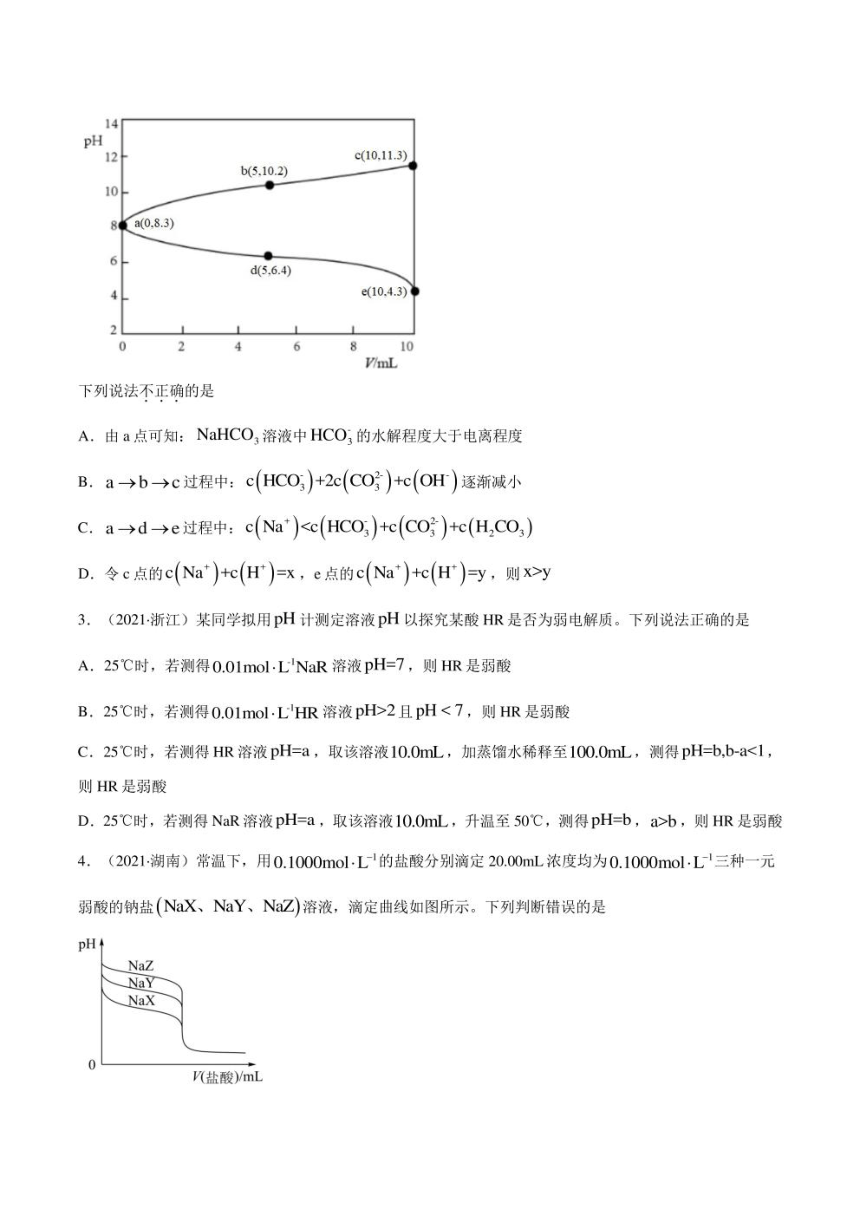
6.(2022·山东卷)工业上以SSO,(s)为原料生产SCO,(S),对其工艺条件进行研究。现有含SCO,(s)的
0.1molL、1.0 mol.L'Na,CO3溶液,含SrSO,(s)的0.1molL、1.0mol-L Na SO4溶液。在一定pH范围内,
【2022年】
1.(2022海南卷)NaC1O溶液具有添白能力,已知25℃时,K.(HCIO)=4.0×108。下列关于NaCIO溶液
说法正确的是
A.0.01mol/L溶液中,c(C1O)<0.01molL
B.长期露置在空气中,释放C2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO,+C1O+H,O=HSO,+HC1O
D.25℃,pH=7.0的NaCIO和HCIO的混合溶液中,c(HCIO)>c(C1O)=c(Na)】
2.(2022浙江卷)25℃时,苯酚(CH,OH的K,=1.0×10-0,下列说法正确的是
A.相同温度下,等pH的C,H,ONa和CH,COONa溶液中,c(CH,O)>c(CH,COO)
B.将浓度均为0.10mol·L的C。H,ONa和NaOH溶液加热,两种溶液的pH均变大
C.25℃时,C,H,OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(CH,O)=c(CH,OH)
D.25℃时,0.10mol.L的C6H,OH溶液中加少量C6H,ONa固体,水的电离程度变小
3.(2022浙江卷)25℃时,向20mL浓度均为0.1mol·L的盐酸和醋酸的混合溶液中逐滴加入0.1mol·L的
NaOH溶液(酷酸的K,=l.8×I05;用0.1mol.L的NaOH溶液滴定20mL等浓度的盐酸,滴定终点的pH突跃
范围4.3~9.7)。下列说法不正确的是
A.恰好中和时,溶液呈碱性
B.滴加NaOH溶液至pH=4.3的过程中,发生反应的离子方程式为:H+OH=H,O
C.滴定过程中,c(CI)=cCH,COO)+c(CH,COOH)
D.pH=7 c(Na*)>c(CI )>c(CH,COO )>c(CH,COOH)
4.(2022全国乙卷)常温下,一元酸HA的K.(HA)=1.0×103。在某体系中,H与A离子不能穿过隔膜,
未电离的HA可自由穿过该膜(如图所示)。
溶液I
膜
溶液Ⅱ
pH=7.0
pH=1.0
H+A=HA←→HA=H+A
设溶液中c(HA)=c(HA)+c(A),当达到平衡时,下列叙述正确的是
A.溶液I中c(H)=c(OH)+c(A)
c(A)
B.溶液Ⅱ中的HA的电离度
1
C(HA)
为
01
C.溶液I和I中的c(HA)不相等
D.溶液I和IⅡ中的caHA)之比为10
5.(2022湖南卷)室温时,用0.100mol-L的标准AgNO3溶液滴定15.00mL浓度相等的CI、Br和T混合
溶液,通过电位滴定法获得gCAg)与V(AgNO,)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶
液中离子浓度小于1.0×105molL时,认为该离子沉淀完全。Kn(AgC)=l.8×100,Kn(AgBr)=5.4×10B,
K,(Ag=8.5×10”)。下列说法正确的是
↑lgc(Ag)
a
0
4.50 V(AgNO3)/mL
A.a点:有白色沉淀生成
B.原溶液中I的浓度为0.100mol.L
C.当Br沉淀完全时,已经有部分Cr沉淀
D.b点:c(CI)>c(Br)>c(T)>c(ag)
6.(2022·山东卷)工业上以SSO,(s)为原料生产SCO,(S),对其工艺条件进行研究。现有含SCO,(s)的
0.1molL、1.0 mol.L'Na,CO3溶液,含SrSO,(s)的0.1molL、1.0mol-L Na SO4溶液。在一定pH范围内,
同课章节目录
