化学人教版(2019)必修第一册4.2.3 周期表应用(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2.3 周期表应用(共25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-20 15:48:43 | ||
图片预览






文档简介
(共25张PPT)
第二节 元素周期律
(第3课时 元素周期表和周期律的应用)
元素在周期表中的位置,由元素原子的结构决定,而元素原子的结构又决定了元素的性质,即元素的性质是元素在元素周期表中的位置的外在反映。那么研究元素周期表和元素周期律有何意义呢?
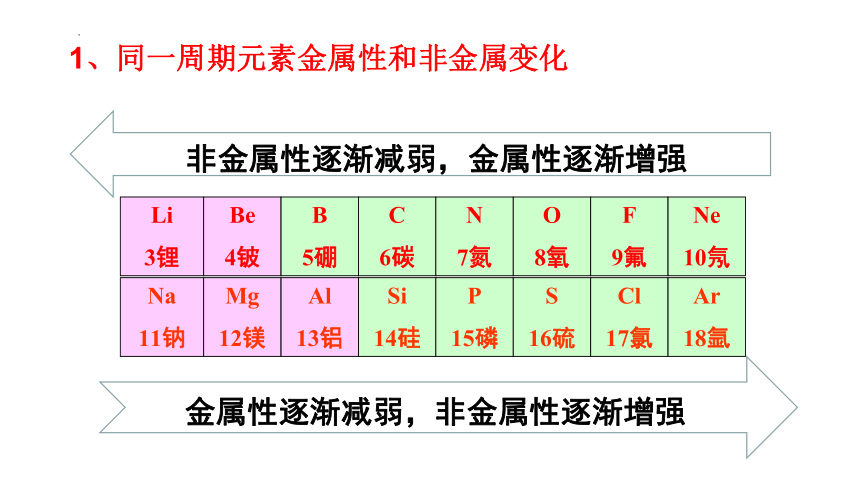
1、同一周期元素金属性和非金属变化
Li
3锂
Be
4铍
B
5硼
C
6碳
N
7氮
O
8氧
F
9氟
Ne
10氖
Na
11钠
Mg
12镁
Al
13铝
Si
14硅
P
15磷
S
16硫
Cl
17氯
Ar
18氩
非金属性逐渐减弱,金属性逐渐增强
金属性逐渐减弱,非金属性逐渐增强
,
思考:
试用结构观点解释为什么有这样的变化规律
同一周期元素,电子层数相同。从左向右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强。
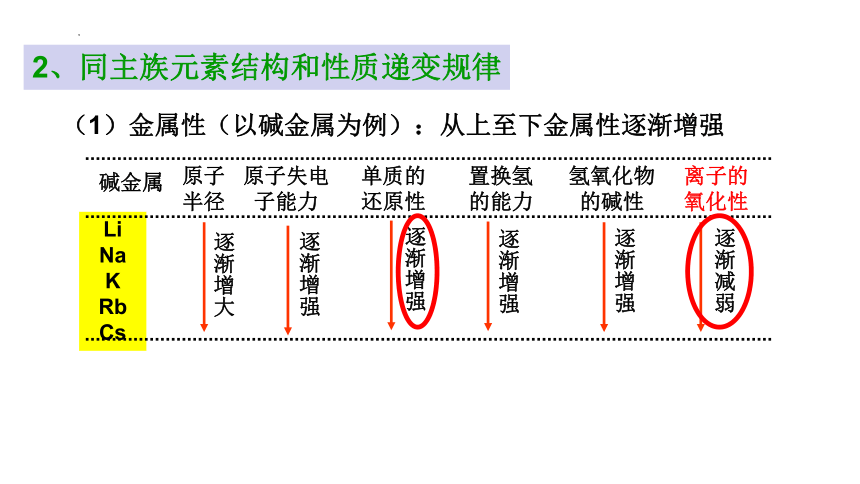
2、同主族元素结构和性质递变规律
(1)金属性(以碱金属为例):从上至下金属性逐渐增强
逐渐增大
逐渐增强
逐渐增强
逐渐增强
逐渐增强
Li
Na
K
Rb
Cs
碱金属
原子
半径
原子失电
子能力
单质的
还原性
置换氢
的能力
氢氧化物
的碱性
离子的
氧化性
逐渐减弱
(2)非金属性(以卤素为例):从上至下非金属性逐渐减弱
逐渐增大
逐渐减弱
逐渐减弱
逐渐减弱
逐渐减弱
卤素
原子
半径
原子得电
子能力
单质的
氧化性
结合氢
的能力
最高价氧化物对
应水化物的酸性
F
Cl
Br
I
离子的
还原性
逐渐增强
HX
酸性
逐渐增强
2、同主族元素结构和性质递变规律
思考:
试用结构观点解释为什么有这样的变化规律
同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。
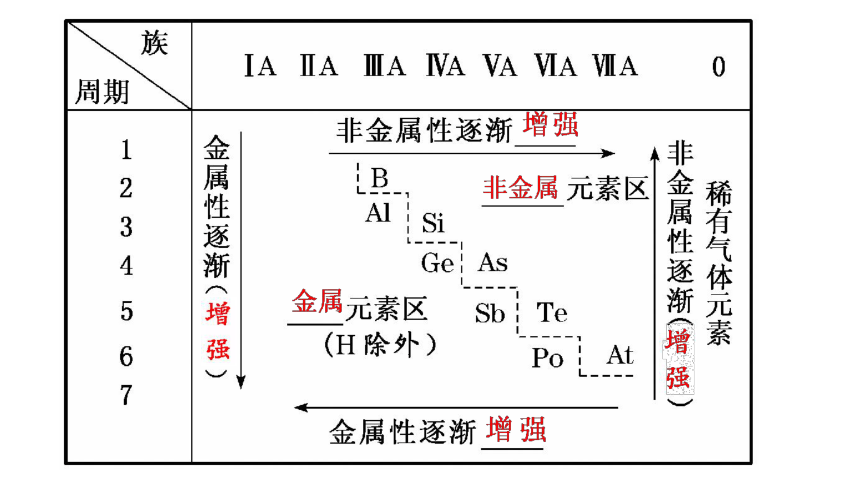
H
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
Fr
思考:
什么元素的金属性最强?什么元素的非金属性最强?它们分别位于元素周期表中的什么位置?
3、元素在周期表中的位置、原子结构与性质的关系
⑴原子结构 元素的化学性质
决定
11
12
13
14
15
16
17
18
钠
镁
铝
硅
磷
硫
氯
氩
原子序数
元素 名称
元素 符号
电子排布
化合价
Na
Mg
Al
Si
P
S
Cl
Ar
2, 8, 1
2, 8, 2
2, 8, 3
2, 8, 4
2, 8,5
2, 8, 6
2, 8, 7
2, 8, 8
第三周期
+ 1
+ 2
+ 3
+ 4
- 4
+ 5
- 3
- 2
- 1
0
+6
+7
4、元素化合价与其在元素周期表中的位置的关系
主族元素的最高正化合价与最外层电子数有何关系?
最高正价=最外层电子数
最低负化合价数 =
—(8 – 最外层电子数)
(1)主族元素最高正化合价=_________=_____________。
主族序数
最外层电子数
最外层电子数
8电子
8
最高正价+|最低负价|= 8
(除O、F无正价)
(3) 金属元素的无负化合价
(2)非金属元素的化合价
①最高正价等于原子所能失去或偏移的_____________。
②最低负价等于使其达到______稳定结构所需要得到的电子数。
③最高正价与最低负价绝对值之和等于__。
4、元素化合价与元素在周期表中位置的关系
(5)位置 原子结构和元素性质
体现
或推测
【练习1】已知铍(Be)的原子序数为4。
下列相关叙述中,正确的是 ( )
A.铍的原子半径大于硼的原子半径
B.氯化铍分子的化学式为BeCl2
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气
Mg + 2H2O Mg(OH)2 + H2↑
Be位于周期表的第二周期第ⅡA族,所以在化合物中呈现+2价,其原子半径应该大于B,氢氧化铍的碱性应该比氢氧化钙的弱,单质与水的反应应该比Mg与水的反应困难
AC
元素周期律 (回顾、总结)
周期表中位置 同周期(左→右) 同主族(上→下)
原子结构 核电荷数
电子层数
最外层电子数
原子半径
依次增加
依次增加
依次增加
增大
相同
相同
逐渐减小
逐渐增大
周期表中位置 同周期(左→右) 同主族(上→下)
性质 主要化合价
元素的金属性和非金属性
最高价氧化物对应水化物的酸、碱性
非金属气态氢化物的稳定性
原子得失电子能力
最高正价由+1→7
(O、F除外)
最低负化合价=
-(8-主族序数)
相同,
最高正化合价=主族序数(O、F除外)
金属性减弱
非金属性增强
金属性增强
非金属性减弱
最高价氧化物对应水化物的碱(酸)碱性减弱(酸性增强)
最高价氧化物对应水化物的碱(酸)碱性增强(酸性减弱)
增强
减弱
原子得电子能力增强,
失电子能力减弱
原子得电子能力减弱,
失电子能力增强
【练习2】五种短周期元素的原子半径、最高正化合价及负化合价见下表
B
下列叙述正确的是( )
A.L的金属性比M的金属性弱
B.Q、T两元素间可形成两性化合物
C.T的单质是黄绿色气体
D.L、R两元素的简单离子的核外电子数可能相等
元素代号 L M Q R T
原子半径/nm 0.160 0.089 0.143 0.102 0.074
化合价 +2 +2 +3 +6,-2 -2
根据元素化合价可以直接得到R为S,T为O;再根据原子半径和化合价得到L、M、Q分别为Mg、Be、Al
Al2O3
同一主族元素
最外层电子数相同
从上往下
电子层数增多
原子半径逐渐增大
失电子能力逐渐增强
得电子能力逐渐减弱
金属性逐渐增强
非金属性逐渐减弱
思维建模
元素名称 硒 元素符号 Se
原子序数 34 金属还是 非金属?
原子结构示意图
最高正价 最低负价
常见中间价 气态氢化物化学式
最高价氧化物 最高价氧化物对应水化物
与硫酸比较酸性 与硫化氢比较稳定性
根据元素周期表和元素周期律,互相交流讨论,填写下表:
非金属
+6
-2
+4
H2Se
SeO3
H2SeO4
弱
弱
位置、结构、性质之间的相互推断
【练习3】
6、元素周期表和元素周期律的应用
(1)根据同周期、同主族元素性质的递变规律判断元素性质的_____(或_____)。
(2)应用于元素“位置—结构—性质”的相互推断。
(3)预测新元素
为新元素的发现及预测它们的_______________提供线索。
(4)寻找新物质
强弱
大小
原子结构和性质
1、预测新元素
2、寻找半导体
3、寻找催化剂
4、寻找农药
⑴ 学习和研究化学的规律和工具
⑵ 研究发现新物质
⑶ 论证了量变引起质变的规律性
7、元素周期表及元素周期律的三大意义
预言新元素,
研究新农药,
寻找新的半导体材料,
寻找催化剂,
寻找耐高温耐腐蚀材料,
寻找新的矿物质。
1、根据元素周期表回答下列问题:
(1)金属性最强的元素是___,非金属性最强的元素是_____;
(2)第3周期中,原子半径最小的元素(稀有气体元素除外)是______,非金属性最强的元素是______;
(3)铷、氯、锗三种元素中,适合作半导体材料的是_____
Cs
F
Cl
Cl
锗
2、已知原子序数依次增大的X、Y、Z、W、T五种元素位于同一周期,正确的是 ( )
A.若W的最高价氧化物对应的水化物是强酸,则T一定是活泼非金属
B.若X的最高价氧化物对应的水化物是强碱,则Z一定是活泼金属
C.若Z是非金属元素,则W一定也是非金属元素
D.若Y是金属元素,则Z一定也是金属元素
C
【随堂检测】
3、同一周期的X、Y、Z三元素,已知最高价氧化物对应水化物的化学式是:H3XO4、H2YO4、HZO4,则: (1)X、Y、Z的非金属性强弱顺序为 。
(2)气态氢化物的化学式分别为 ,
它们稳定性强弱为______________________。
(3)最高价氧化物对应水化物的酸性强弱为__________________。
Z>Y>X
XH3<H2Y<HZ
H3XO4<H2YO4<HZO4
XH3、H2Y、HZ
4、X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z
B. 对应气态氢化物的稳定性:X>Z
C. 离子半径:X2->Y+>Z-
D. 原子序数:X>Y>Z
D
5、在第三周期元素中,除稀有气体元素外:(1)原子半径最小的元素是________(填元素符号)。(2)金属性最强的元素是________(填元素符号)。(3)最高价氧化物对应水化物酸性最强的是__________(用化学式回答,下同)。(4)最不稳定的气态氢化物是__________。(5)最高价氧化物对应水化物碱性最强的是__________。
(1)Cl (2)Na (3)HClO4 (4)SiH4 (5)NaOH
第二节 元素周期律
(第3课时 元素周期表和周期律的应用)
元素在周期表中的位置,由元素原子的结构决定,而元素原子的结构又决定了元素的性质,即元素的性质是元素在元素周期表中的位置的外在反映。那么研究元素周期表和元素周期律有何意义呢?
1、同一周期元素金属性和非金属变化
Li
3锂
Be
4铍
B
5硼
C
6碳
N
7氮
O
8氧
F
9氟
Ne
10氖
Na
11钠
Mg
12镁
Al
13铝
Si
14硅
P
15磷
S
16硫
Cl
17氯
Ar
18氩
非金属性逐渐减弱,金属性逐渐增强
金属性逐渐减弱,非金属性逐渐增强
,
思考:
试用结构观点解释为什么有这样的变化规律
同一周期元素,电子层数相同。从左向右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强。
2、同主族元素结构和性质递变规律
(1)金属性(以碱金属为例):从上至下金属性逐渐增强
逐渐增大
逐渐增强
逐渐增强
逐渐增强
逐渐增强
Li
Na
K
Rb
Cs
碱金属
原子
半径
原子失电
子能力
单质的
还原性
置换氢
的能力
氢氧化物
的碱性
离子的
氧化性
逐渐减弱
(2)非金属性(以卤素为例):从上至下非金属性逐渐减弱
逐渐增大
逐渐减弱
逐渐减弱
逐渐减弱
逐渐减弱
卤素
原子
半径
原子得电
子能力
单质的
氧化性
结合氢
的能力
最高价氧化物对
应水化物的酸性
F
Cl
Br
I
离子的
还原性
逐渐增强
HX
酸性
逐渐增强
2、同主族元素结构和性质递变规律
思考:
试用结构观点解释为什么有这样的变化规律
同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。
H
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
Fr
思考:
什么元素的金属性最强?什么元素的非金属性最强?它们分别位于元素周期表中的什么位置?
3、元素在周期表中的位置、原子结构与性质的关系
⑴原子结构 元素的化学性质
决定
11
12
13
14
15
16
17
18
钠
镁
铝
硅
磷
硫
氯
氩
原子序数
元素 名称
元素 符号
电子排布
化合价
Na
Mg
Al
Si
P
S
Cl
Ar
2, 8, 1
2, 8, 2
2, 8, 3
2, 8, 4
2, 8,5
2, 8, 6
2, 8, 7
2, 8, 8
第三周期
+ 1
+ 2
+ 3
+ 4
- 4
+ 5
- 3
- 2
- 1
0
+6
+7
4、元素化合价与其在元素周期表中的位置的关系
主族元素的最高正化合价与最外层电子数有何关系?
最高正价=最外层电子数
最低负化合价数 =
—(8 – 最外层电子数)
(1)主族元素最高正化合价=_________=_____________。
主族序数
最外层电子数
最外层电子数
8电子
8
最高正价+|最低负价|= 8
(除O、F无正价)
(3) 金属元素的无负化合价
(2)非金属元素的化合价
①最高正价等于原子所能失去或偏移的_____________。
②最低负价等于使其达到______稳定结构所需要得到的电子数。
③最高正价与最低负价绝对值之和等于__。
4、元素化合价与元素在周期表中位置的关系
(5)位置 原子结构和元素性质
体现
或推测
【练习1】已知铍(Be)的原子序数为4。
下列相关叙述中,正确的是 ( )
A.铍的原子半径大于硼的原子半径
B.氯化铍分子的化学式为BeCl2
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气
Mg + 2H2O Mg(OH)2 + H2↑
Be位于周期表的第二周期第ⅡA族,所以在化合物中呈现+2价,其原子半径应该大于B,氢氧化铍的碱性应该比氢氧化钙的弱,单质与水的反应应该比Mg与水的反应困难
AC
元素周期律 (回顾、总结)
周期表中位置 同周期(左→右) 同主族(上→下)
原子结构 核电荷数
电子层数
最外层电子数
原子半径
依次增加
依次增加
依次增加
增大
相同
相同
逐渐减小
逐渐增大
周期表中位置 同周期(左→右) 同主族(上→下)
性质 主要化合价
元素的金属性和非金属性
最高价氧化物对应水化物的酸、碱性
非金属气态氢化物的稳定性
原子得失电子能力
最高正价由+1→7
(O、F除外)
最低负化合价=
-(8-主族序数)
相同,
最高正化合价=主族序数(O、F除外)
金属性减弱
非金属性增强
金属性增强
非金属性减弱
最高价氧化物对应水化物的碱(酸)碱性减弱(酸性增强)
最高价氧化物对应水化物的碱(酸)碱性增强(酸性减弱)
增强
减弱
原子得电子能力增强,
失电子能力减弱
原子得电子能力减弱,
失电子能力增强
【练习2】五种短周期元素的原子半径、最高正化合价及负化合价见下表
B
下列叙述正确的是( )
A.L的金属性比M的金属性弱
B.Q、T两元素间可形成两性化合物
C.T的单质是黄绿色气体
D.L、R两元素的简单离子的核外电子数可能相等
元素代号 L M Q R T
原子半径/nm 0.160 0.089 0.143 0.102 0.074
化合价 +2 +2 +3 +6,-2 -2
根据元素化合价可以直接得到R为S,T为O;再根据原子半径和化合价得到L、M、Q分别为Mg、Be、Al
Al2O3
同一主族元素
最外层电子数相同
从上往下
电子层数增多
原子半径逐渐增大
失电子能力逐渐增强
得电子能力逐渐减弱
金属性逐渐增强
非金属性逐渐减弱
思维建模
元素名称 硒 元素符号 Se
原子序数 34 金属还是 非金属?
原子结构示意图
最高正价 最低负价
常见中间价 气态氢化物化学式
最高价氧化物 最高价氧化物对应水化物
与硫酸比较酸性 与硫化氢比较稳定性
根据元素周期表和元素周期律,互相交流讨论,填写下表:
非金属
+6
-2
+4
H2Se
SeO3
H2SeO4
弱
弱
位置、结构、性质之间的相互推断
【练习3】
6、元素周期表和元素周期律的应用
(1)根据同周期、同主族元素性质的递变规律判断元素性质的_____(或_____)。
(2)应用于元素“位置—结构—性质”的相互推断。
(3)预测新元素
为新元素的发现及预测它们的_______________提供线索。
(4)寻找新物质
强弱
大小
原子结构和性质
1、预测新元素
2、寻找半导体
3、寻找催化剂
4、寻找农药
⑴ 学习和研究化学的规律和工具
⑵ 研究发现新物质
⑶ 论证了量变引起质变的规律性
7、元素周期表及元素周期律的三大意义
预言新元素,
研究新农药,
寻找新的半导体材料,
寻找催化剂,
寻找耐高温耐腐蚀材料,
寻找新的矿物质。
1、根据元素周期表回答下列问题:
(1)金属性最强的元素是___,非金属性最强的元素是_____;
(2)第3周期中,原子半径最小的元素(稀有气体元素除外)是______,非金属性最强的元素是______;
(3)铷、氯、锗三种元素中,适合作半导体材料的是_____
Cs
F
Cl
Cl
锗
2、已知原子序数依次增大的X、Y、Z、W、T五种元素位于同一周期,正确的是 ( )
A.若W的最高价氧化物对应的水化物是强酸,则T一定是活泼非金属
B.若X的最高价氧化物对应的水化物是强碱,则Z一定是活泼金属
C.若Z是非金属元素,则W一定也是非金属元素
D.若Y是金属元素,则Z一定也是金属元素
C
【随堂检测】
3、同一周期的X、Y、Z三元素,已知最高价氧化物对应水化物的化学式是:H3XO4、H2YO4、HZO4,则: (1)X、Y、Z的非金属性强弱顺序为 。
(2)气态氢化物的化学式分别为 ,
它们稳定性强弱为______________________。
(3)最高价氧化物对应水化物的酸性强弱为__________________。
Z>Y>X
XH3<H2Y<HZ
H3XO4<H2YO4<HZO4
XH3、H2Y、HZ
4、X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z
B. 对应气态氢化物的稳定性:X>Z
C. 离子半径:X2->Y+>Z-
D. 原子序数:X>Y>Z
D
5、在第三周期元素中,除稀有气体元素外:(1)原子半径最小的元素是________(填元素符号)。(2)金属性最强的元素是________(填元素符号)。(3)最高价氧化物对应水化物酸性最强的是__________(用化学式回答,下同)。(4)最不稳定的气态氢化物是__________。(5)最高价氧化物对应水化物碱性最强的是__________。
(1)Cl (2)Na (3)HClO4 (4)SiH4 (5)NaOH
