【高效备课】人教版(2019)化学必修一 同步课件 4.3.1离子键(课件25页)
文档属性
| 名称 | 【高效备课】人教版(2019)化学必修一 同步课件 4.3.1离子键(课件25页) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-07 10:32:34 | ||
图片预览





文档简介
(共25张PPT)
4.3.1离子键
人教版(2019)高一上
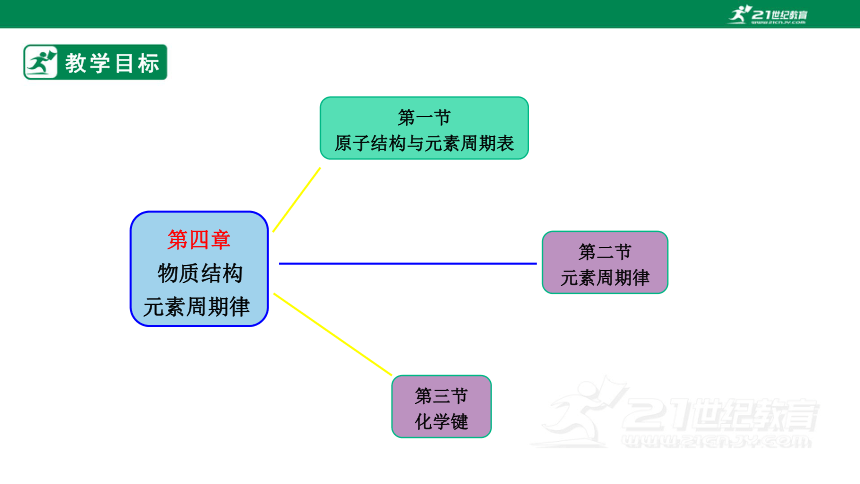
教学目标
第四章
物质结构
元素周期律
第一节
原子结构与元素周期表
第三节
化学键
第二节
元素周期律
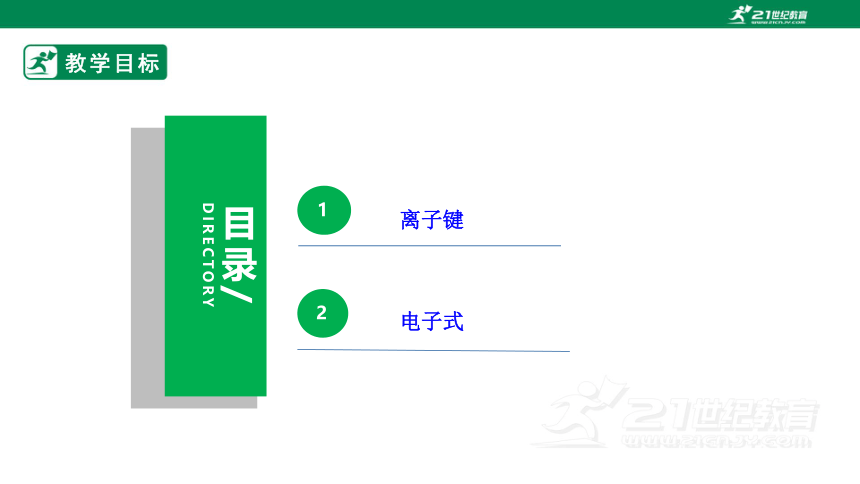
教学目标
目录/
DIRECTORY
1
2
离子键
电子式
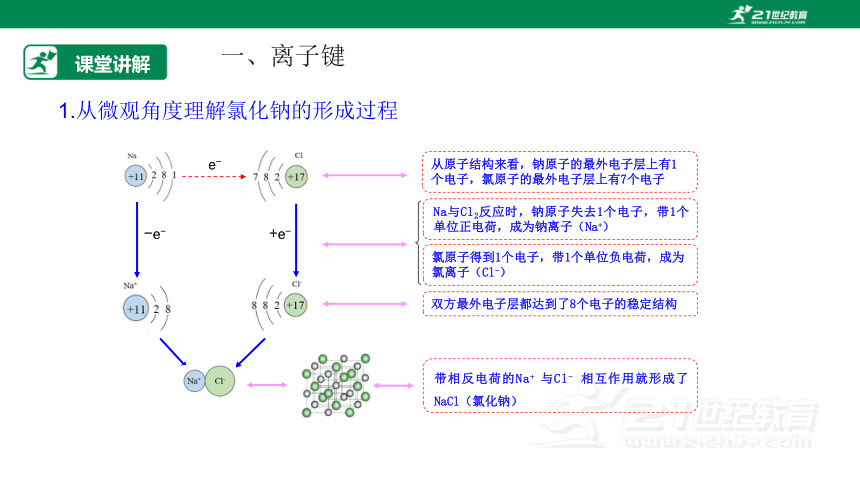
课堂讲解
一、离子键
1.从微观角度理解氯化钠的形成过程
-e-
+e-
e-
从原子结构来看,钠原子的最外电子层上有1个电子,氯原子的最外电子层上有7个电子
Na与Cl2反应时,钠原子失去1个电子,带1个单位正电荷,成为钠离子(Na+)
氯原子得到1个电子,带1个单位负电荷,成为氯离子(Cl-)
双方最外电子层都达到了8个电子的稳定结构
带相反电荷的Na+ 与Cl- 相互作用就形成了NaCl(氯化钠)
2.离子键和离子化合物
课堂讲解
(1)定义:_________之间的相互作用
(2)成键微粒:_____________________和________
(3)成键实质:_________,包括静电引力和静电斥力
(4)成键元素:一般是___________和___________
(注:铵盐中也含离子键)
阴阳离子
金属阳离子或铵根离子
阴离子
静电作用
活泼金属
活泼非金属
3.离子化合物
课堂讲解
(1)定义:由_________构成的化合物
(2)常见类型:_______________________________
(3)关系:离子化合物______含有离子键,含离子键的化合物______是离子化合物
离子键
强碱、大多数盐、活泼金属氧化物等
一定
一定
【例1】下列叙述正确的是
A.带相反电荷离子之间的相互吸引称为离子键
B.金属与非金属化合时,一定形成离子键
C.含离子键的化合物一定是离子化合物
D.非金属元素原子间不可能形成离子键
课堂练习
C
【例2】下列各对原子序数的原子能以离子键结合成化合物的是
A.1和17 B.6和8 C.13和17 D.11和17
D
课堂练习
【例3】下列物质中,含离子键的是
A.N2 B.CO2 C.NaCl D.HCl
C
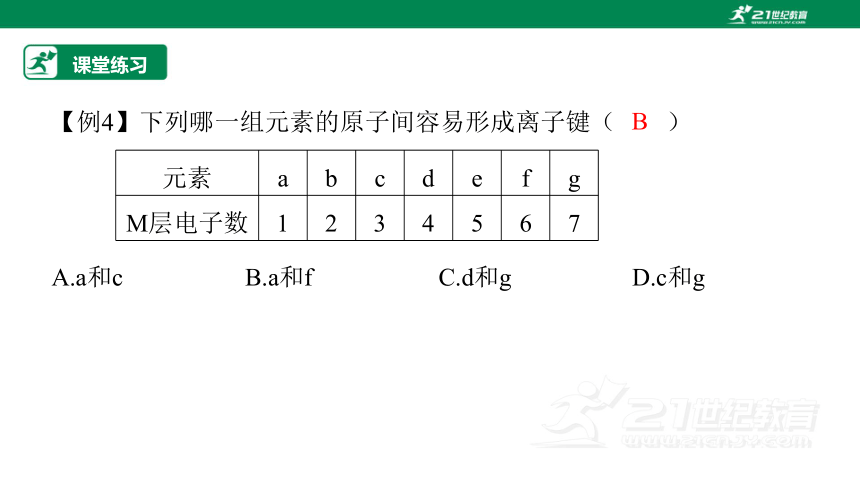
【例4】下列哪一组元素的原子间容易形成离子键( )
A.a和c B.a和f C.d和g D.c和g
课堂练习
B
元素 a b c d e f g
M层电子数 1 2 3 4 5 6 7
课堂练习
【例5】下列关于离子键的说法中,正确的是
A.阴、阳离子间的相互吸引即离子键
B.非金属元素所组成的化合物中不可能有离子键
C.ⅠA族元素与VIA族元素之间形成的化合物一定含离子键
D.某化合物在熔融状态下能导电,该化合物一定含离子键
D
二、电子式
1.电子式的定义
课堂讲解
在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子叫做电子式
2. 电子式的书写
课堂讲解
(1)原子的电子式(以第三周期元素为例)
Na原子: Mg原子: Al原子:
Si原子: P原子: S原子:
Cl原子: Ar原子:
·Mg·
·Na
(2)简单阳离子的电子式
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,如:Na+、Li+、Mg2+、Al3+等
(3)简单阴离子的电子式
画出最外层电子数,用“[ ]”括起来,并在右上角标出“n-”以表示其所带的电荷。如:
氯离子 硫离子
课堂讲解
(4)离子化合物的电子式
将阴离子和阳离子的电子式组合起来,注意相同离子不合并,分列在另一离子的周围。如:
氧化镁: 硫化钾 :
课堂讲解
3.用电子式表示下列物质的形成过程
课堂讲解
左边写原子的电子式,右边写离子化合物的电子式,中间用“→”连接,如:
(1)NaCl:
(2)MgBr2:
课堂练习
【例6】
D
【例7】
课堂练习
B
【例8】
课堂练习
B
【例9】下列化学用语中正确的是( )
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
B
课堂练习
【例10】用电子式表示下列化合物的形成过程:
NaF:
CaCl2:
Na2S:
MgO:
K2O:
课堂练习
课堂练习
【例11】设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y元素原子核内质子数少 9个;
③Y和Z两种元素可以形成四核42个电子的-1价阴离子。
据此,请填空:
(1)写出X、Y、Z三种元素的名称:X____,Y_____,Z_____。
(2)X、Y两种元素最高价氧化物对应水化物反应的离子方程式为____________________。
(3)用电子式表示X、Z形成化合物的过程:____________________。
钾
氯
氧
H++OH-=H2O
课堂练习
【例12】CaH2属于离子化合物,是一种生氢剂,其与水反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,回答下列问题。
(1)上述方程式中除CaH2外,属于离子化合物的还有:_______。
(2)CaH2中阴、阳离子个数比为_____,写出CaH2的电子式_______________。
(3)用双线桥标出上述化学方程式中电子转移的方向和数目:__________________________,氧化剂为______,还原剂为______。
Ca(OH)2
H2O
CaH2
2∶1
课堂小结
https://www.21cnjy.com/help/help_extract.php
4.3.1离子键
人教版(2019)高一上
教学目标
第四章
物质结构
元素周期律
第一节
原子结构与元素周期表
第三节
化学键
第二节
元素周期律
教学目标
目录/
DIRECTORY
1
2
离子键
电子式
课堂讲解
一、离子键
1.从微观角度理解氯化钠的形成过程
-e-
+e-
e-
从原子结构来看,钠原子的最外电子层上有1个电子,氯原子的最外电子层上有7个电子
Na与Cl2反应时,钠原子失去1个电子,带1个单位正电荷,成为钠离子(Na+)
氯原子得到1个电子,带1个单位负电荷,成为氯离子(Cl-)
双方最外电子层都达到了8个电子的稳定结构
带相反电荷的Na+ 与Cl- 相互作用就形成了NaCl(氯化钠)
2.离子键和离子化合物
课堂讲解
(1)定义:_________之间的相互作用
(2)成键微粒:_____________________和________
(3)成键实质:_________,包括静电引力和静电斥力
(4)成键元素:一般是___________和___________
(注:铵盐中也含离子键)
阴阳离子
金属阳离子或铵根离子
阴离子
静电作用
活泼金属
活泼非金属
3.离子化合物
课堂讲解
(1)定义:由_________构成的化合物
(2)常见类型:_______________________________
(3)关系:离子化合物______含有离子键,含离子键的化合物______是离子化合物
离子键
强碱、大多数盐、活泼金属氧化物等
一定
一定
【例1】下列叙述正确的是
A.带相反电荷离子之间的相互吸引称为离子键
B.金属与非金属化合时,一定形成离子键
C.含离子键的化合物一定是离子化合物
D.非金属元素原子间不可能形成离子键
课堂练习
C
【例2】下列各对原子序数的原子能以离子键结合成化合物的是
A.1和17 B.6和8 C.13和17 D.11和17
D
课堂练习
【例3】下列物质中,含离子键的是
A.N2 B.CO2 C.NaCl D.HCl
C
【例4】下列哪一组元素的原子间容易形成离子键( )
A.a和c B.a和f C.d和g D.c和g
课堂练习
B
元素 a b c d e f g
M层电子数 1 2 3 4 5 6 7
课堂练习
【例5】下列关于离子键的说法中,正确的是
A.阴、阳离子间的相互吸引即离子键
B.非金属元素所组成的化合物中不可能有离子键
C.ⅠA族元素与VIA族元素之间形成的化合物一定含离子键
D.某化合物在熔融状态下能导电,该化合物一定含离子键
D
二、电子式
1.电子式的定义
课堂讲解
在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子叫做电子式
2. 电子式的书写
课堂讲解
(1)原子的电子式(以第三周期元素为例)
Na原子: Mg原子: Al原子:
Si原子: P原子: S原子:
Cl原子: Ar原子:
·Mg·
·Na
(2)简单阳离子的电子式
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,如:Na+、Li+、Mg2+、Al3+等
(3)简单阴离子的电子式
画出最外层电子数,用“[ ]”括起来,并在右上角标出“n-”以表示其所带的电荷。如:
氯离子 硫离子
课堂讲解
(4)离子化合物的电子式
将阴离子和阳离子的电子式组合起来,注意相同离子不合并,分列在另一离子的周围。如:
氧化镁: 硫化钾 :
课堂讲解
3.用电子式表示下列物质的形成过程
课堂讲解
左边写原子的电子式,右边写离子化合物的电子式,中间用“→”连接,如:
(1)NaCl:
(2)MgBr2:
课堂练习
【例6】
D
【例7】
课堂练习
B
【例8】
课堂练习
B
【例9】下列化学用语中正确的是( )
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
B
课堂练习
【例10】用电子式表示下列化合物的形成过程:
NaF:
CaCl2:
Na2S:
MgO:
K2O:
课堂练习
课堂练习
【例11】设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y元素原子核内质子数少 9个;
③Y和Z两种元素可以形成四核42个电子的-1价阴离子。
据此,请填空:
(1)写出X、Y、Z三种元素的名称:X____,Y_____,Z_____。
(2)X、Y两种元素最高价氧化物对应水化物反应的离子方程式为____________________。
(3)用电子式表示X、Z形成化合物的过程:____________________。
钾
氯
氧
H++OH-=H2O
课堂练习
【例12】CaH2属于离子化合物,是一种生氢剂,其与水反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,回答下列问题。
(1)上述方程式中除CaH2外,属于离子化合物的还有:_______。
(2)CaH2中阴、阳离子个数比为_____,写出CaH2的电子式_______________。
(3)用双线桥标出上述化学方程式中电子转移的方向和数目:__________________________,氧化剂为______,还原剂为______。
Ca(OH)2
H2O
CaH2
2∶1
课堂小结
https://www.21cnjy.com/help/help_extract.php
