【高效备课】人教版(2019)化学必修一 同步课件 4.2.2元素周期表和元素周期律的应用(课件30页)
文档属性
| 名称 | 【高效备课】人教版(2019)化学必修一 同步课件 4.2.2元素周期表和元素周期律的应用(课件30页) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-07 10:32:34 | ||
图片预览








文档简介
(共30张PPT)
4.2.2元素周期表和元素周期律的应用
人教版(2019)高一上
教学目标
第四章
物质结构
元素周期律
第一节
原子结构与元素周期表
第三节
化学键
第二节
元素周期律
教学目标
目录/
DIRECTORY
1
2
元素在周期表中的分布及性质规律
元素周期表和周期律的应用
课堂讲解
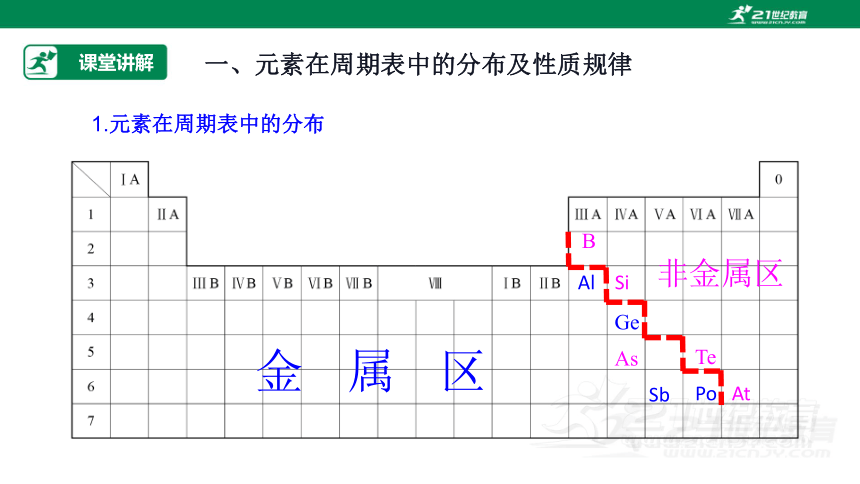
一、元素在周期表中的分布及性质规律
B
Al Si
Ge As
Sb
Te
Po At
金 属 区
非金属区
1.元素在周期表中的分布
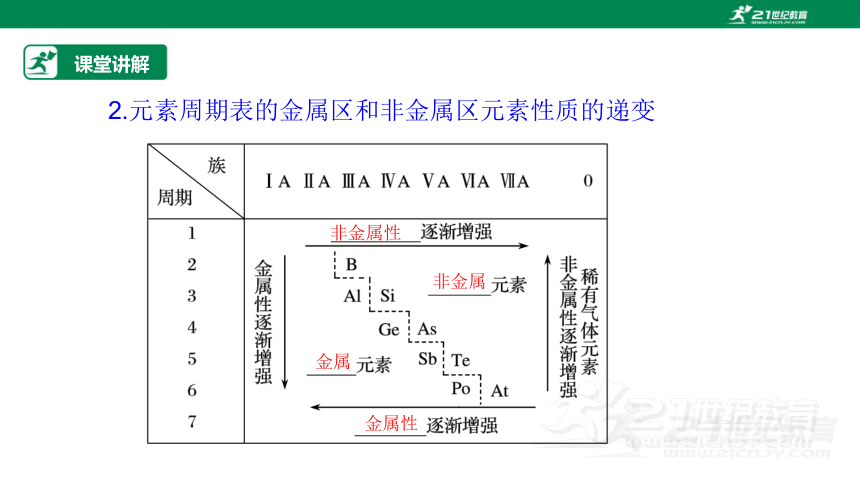
2.元素周期表的金属区和非金属区元素性质的递变
课堂讲解
金属
金属性
非金属性
非金属
(1)金属性强的在周期表的____方,最强的是____(放射性元素除外),非金属性强的在周期表的_____方(稀有气体除外),最强的是___
课堂讲解
左下
Cs
右上
F
金属性
非金属性
金属性
非金属性
(2)分界线附近的元素,既能表现出一定的________,又能表现出一定的_________,故元素的_______和_________之间没有严格的界线
(1)元素周期表是元素周期律的具体表现形式,反映了元素之间的内在联系
(2)元素周期表中元素的金属性和非金属性变化的规律。
同周期元素由左向右金属性_____,非金属性_____;同主族元素由上向下金属性_____,非金属性_____
课堂讲解
3. 元素周期表与元素周期律的关系
减弱
增强
增强
减弱
4.元素化合价与元素在周期表中位置的关系
课堂讲解
(1)同主族元素的最高正价和最低负价相同(O、F除外)
(2)主族元素最高正化合价=_________=_____________
(3)非金属元素的最高正价和最低负价的绝对值之和等于____(H最低价为-1,O、F除外)
主族序数
最外层电子数
8
【例1】中国化学会遴选了118名青年化学家作为“元素代言人”,组成“中国青年化学家元素周期表”。第37号元素铷(Rb)由清华大学张如范代言。下列说法正确的是
A.铷位于周期表的第四周期第IA族 B.氢氧化铷属于弱碱
C.与钠的单质相比,铷的单质熔点更低 D.硝酸铷属于共价化合物
课堂练习
C
【例2】
B
课堂练习
【例3】已知X元素原子的电子层数为n,最外层电子数为2n+1,Y元素原子的最外层电子数是次外层电子数的3倍,则X、Y元素分别可能为
A.N和C B.N和O C.Cl和S D.C和Cl
B
已知某主族元素R的原子核外有4个电子层,最外层有3个电子,下列有关说法错误的是
A.该元素在周期表中位于第四周期第IIIA族
B.该元素是非金属元素
C.该元素的单质可能有两性
D.该元素的氧化物可表示为R2O3
【例4】应用元素周期律分析下列推断,其中正确的组合是
①第三周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
②砹(At)是第ⅦA族元素,其氢化物的稳定性弱于HCl
③第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
④铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
A.①②④ B.③④ C.①③④ D.①②
课堂练习
D
【例5】下列关于元素周期表和周期律的说法正确的是
A.现行元素周期表有七个周期,18个族
B.熔点:Li>K,沸点:I2>Br2
C.盐酸的酸性比氢硫酸酸性强,可推测非金属性:Cl>S
D.At与I属于同主族元素,可推测AgAt为难溶于水的白色固体
课堂练习
B
【例6】
课堂练习
D
【例7】
课堂练习
C
二、元素周期表和周期律的应用
1. 根据“位—构—性”预测元素、物质的性质
课堂讲解
(1)比较同主族元素的金属性、非金属性、最高价氧化物对应水化物的酸碱性、氢化物的稳定性等,如:
碱性:Sr(OH)2____Ca(OH)2; 气态氢化物稳定性:CH4____SiH4
>
>
位置
结构
性质
反映
决定
决定
反映
(2)比较同周期元素及其化合物的性质,如:
酸性:HClO4____H2SO4; 稳定性:HCl____H2S
>
>
课堂讲解
(3)比较不同周期、不同主族元素性质(找参照物),如:
碱性:Mg(OH)2____KOH
<
(4)推断一些未学过的元素的某些性质。如:
Be(OH)2的溶解性为_____溶于水
难
元素名称及符号 砹(At) 原子序数 85
是金属还是非金属 _______ 原子结构示意图
最高正价 ____ 最低负价 ____
中间价 _____________ 预测依据 _____________
______________
根据元素周期表和元素周期律,互相交流讨论,填写下表:
非金属
+7
-1
+1、+3、+5
氯元素有+1、
+3、+5的化合物
课堂讲解
最高价氧化物 最高价氧化物的水化物
酸性 HClO4___HBrO4___HAtO4
稳定性 HAt___HBr___HCl
还原性 At-___Br-___Cl-
At2O7
HAtO4
>
>
<
<
>
>
课堂讲解
2.指导新元素的发现及预测它们的原子结构和性质
课堂讲解
(1)在金属与非金属交界处寻找半导体材料,如:硅Si、锗Ge、镓Ga等
(2)在过渡元素中寻找优良催化剂和耐高温、耐腐蚀合金材料,如:Fe、Ni等
(3)在周期表右上方如:F、Cl、P、S等元素中寻找研制农药的材料
3.寻找有特殊用途的新物质
课堂练习
【例8】
A
【例9】
课堂练习
D
【例10】四种短周期元素在元素周期表中的位置如图所示,T是地壳中含量最高的金属元素。下列说法不正确的是( )
A.W的氢化物比R的氢化物稳定
B.T的最高价氧化物对应的水化物可能为强碱
C.Q的原子半径比T的小
D.W和Q的原子序数相差10
课堂练习
B
【例11】下列事实不能用元素周期律解释的是( )
A.酸性:H2SO3>H2CO3 B.还原性:S2->Cl-
C.气态氢化物的稳定性:NH3>CH4 D.Cl2从KI溶液中置换出I2
课堂练习
A
【例12】
课堂练习
B
【例13】
课堂练习
下图为元素周期表的一部分,8种元素的位置如图所示,试回答下列问题:
(1)元素⑧在周期表中的位置是____ ________,其最高价氧化物的水化物化学式为_______。
(2)元素③④⑤简单离子半径从小到大的顺序为______________________(用离子符号表示)。
(3)8种元素中,最高价氧化物对应水化物的碱性最强的是_______(填化学式,下同),最高价氧化物对应水化物的酸性最强的是_______,简单氢化物最稳定的是_______。
(4)元素①和④可以按原子个数比1:1形成一种离子化合物M,M的电子式子为_______。M是一种良好的储氢材料,遇水后放出氢气并生成一种碱。写出M与水反应的化学方程式:___ ______ _ _____ ______ _ __。若NA表示阿伏伽德罗常数,则该反应每生成标况下的氢气22.4L,转移电子数目为_____ 。
第四周期ⅣA族
KOH
HF
NA
【例14】门捷列夫在研究周期表时预言了包括“类铝”“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勤发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物对应的水化物为两性氢氧化物。试比较元素的非金属性Si__Ge(用“>”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置_____________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是___________。
>
第四周期ⅣA族
半导体材料
课堂练习
③硅和锗单质分别与H2反应时,反应较难进行的是______(填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因____________________________。
②为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液,____________和________________。
锗
稀硫酸(或盐酸)
原子最外层电子数都是3个
NaOH溶液
课堂练习
课堂小结
元素周期律
元素周期表
表现
形式
体现
应用
位
构
性
离子的性质
氢化物
得失电子
氧化物
化合价
含氧酸
氢氧化物
预测新元素
指导寻找有新用途的元素
https://www.21cnjy.com/help/help_extract.php
4.2.2元素周期表和元素周期律的应用
人教版(2019)高一上
教学目标
第四章
物质结构
元素周期律
第一节
原子结构与元素周期表
第三节
化学键
第二节
元素周期律
教学目标
目录/
DIRECTORY
1
2
元素在周期表中的分布及性质规律
元素周期表和周期律的应用
课堂讲解
一、元素在周期表中的分布及性质规律
B
Al Si
Ge As
Sb
Te
Po At
金 属 区
非金属区
1.元素在周期表中的分布
2.元素周期表的金属区和非金属区元素性质的递变
课堂讲解
金属
金属性
非金属性
非金属
(1)金属性强的在周期表的____方,最强的是____(放射性元素除外),非金属性强的在周期表的_____方(稀有气体除外),最强的是___
课堂讲解
左下
Cs
右上
F
金属性
非金属性
金属性
非金属性
(2)分界线附近的元素,既能表现出一定的________,又能表现出一定的_________,故元素的_______和_________之间没有严格的界线
(1)元素周期表是元素周期律的具体表现形式,反映了元素之间的内在联系
(2)元素周期表中元素的金属性和非金属性变化的规律。
同周期元素由左向右金属性_____,非金属性_____;同主族元素由上向下金属性_____,非金属性_____
课堂讲解
3. 元素周期表与元素周期律的关系
减弱
增强
增强
减弱
4.元素化合价与元素在周期表中位置的关系
课堂讲解
(1)同主族元素的最高正价和最低负价相同(O、F除外)
(2)主族元素最高正化合价=_________=_____________
(3)非金属元素的最高正价和最低负价的绝对值之和等于____(H最低价为-1,O、F除外)
主族序数
最外层电子数
8
【例1】中国化学会遴选了118名青年化学家作为“元素代言人”,组成“中国青年化学家元素周期表”。第37号元素铷(Rb)由清华大学张如范代言。下列说法正确的是
A.铷位于周期表的第四周期第IA族 B.氢氧化铷属于弱碱
C.与钠的单质相比,铷的单质熔点更低 D.硝酸铷属于共价化合物
课堂练习
C
【例2】
B
课堂练习
【例3】已知X元素原子的电子层数为n,最外层电子数为2n+1,Y元素原子的最外层电子数是次外层电子数的3倍,则X、Y元素分别可能为
A.N和C B.N和O C.Cl和S D.C和Cl
B
已知某主族元素R的原子核外有4个电子层,最外层有3个电子,下列有关说法错误的是
A.该元素在周期表中位于第四周期第IIIA族
B.该元素是非金属元素
C.该元素的单质可能有两性
D.该元素的氧化物可表示为R2O3
【例4】应用元素周期律分析下列推断,其中正确的组合是
①第三周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
②砹(At)是第ⅦA族元素,其氢化物的稳定性弱于HCl
③第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
④铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
A.①②④ B.③④ C.①③④ D.①②
课堂练习
D
【例5】下列关于元素周期表和周期律的说法正确的是
A.现行元素周期表有七个周期,18个族
B.熔点:Li>K,沸点:I2>Br2
C.盐酸的酸性比氢硫酸酸性强,可推测非金属性:Cl>S
D.At与I属于同主族元素,可推测AgAt为难溶于水的白色固体
课堂练习
B
【例6】
课堂练习
D
【例7】
课堂练习
C
二、元素周期表和周期律的应用
1. 根据“位—构—性”预测元素、物质的性质
课堂讲解
(1)比较同主族元素的金属性、非金属性、最高价氧化物对应水化物的酸碱性、氢化物的稳定性等,如:
碱性:Sr(OH)2____Ca(OH)2; 气态氢化物稳定性:CH4____SiH4
>
>
位置
结构
性质
反映
决定
决定
反映
(2)比较同周期元素及其化合物的性质,如:
酸性:HClO4____H2SO4; 稳定性:HCl____H2S
>
>
课堂讲解
(3)比较不同周期、不同主族元素性质(找参照物),如:
碱性:Mg(OH)2____KOH
<
(4)推断一些未学过的元素的某些性质。如:
Be(OH)2的溶解性为_____溶于水
难
元素名称及符号 砹(At) 原子序数 85
是金属还是非金属 _______ 原子结构示意图
最高正价 ____ 最低负价 ____
中间价 _____________ 预测依据 _____________
______________
根据元素周期表和元素周期律,互相交流讨论,填写下表:
非金属
+7
-1
+1、+3、+5
氯元素有+1、
+3、+5的化合物
课堂讲解
最高价氧化物 最高价氧化物的水化物
酸性 HClO4___HBrO4___HAtO4
稳定性 HAt___HBr___HCl
还原性 At-___Br-___Cl-
At2O7
HAtO4
>
>
<
<
>
>
课堂讲解
2.指导新元素的发现及预测它们的原子结构和性质
课堂讲解
(1)在金属与非金属交界处寻找半导体材料,如:硅Si、锗Ge、镓Ga等
(2)在过渡元素中寻找优良催化剂和耐高温、耐腐蚀合金材料,如:Fe、Ni等
(3)在周期表右上方如:F、Cl、P、S等元素中寻找研制农药的材料
3.寻找有特殊用途的新物质
课堂练习
【例8】
A
【例9】
课堂练习
D
【例10】四种短周期元素在元素周期表中的位置如图所示,T是地壳中含量最高的金属元素。下列说法不正确的是( )
A.W的氢化物比R的氢化物稳定
B.T的最高价氧化物对应的水化物可能为强碱
C.Q的原子半径比T的小
D.W和Q的原子序数相差10
课堂练习
B
【例11】下列事实不能用元素周期律解释的是( )
A.酸性:H2SO3>H2CO3 B.还原性:S2->Cl-
C.气态氢化物的稳定性:NH3>CH4 D.Cl2从KI溶液中置换出I2
课堂练习
A
【例12】
课堂练习
B
【例13】
课堂练习
下图为元素周期表的一部分,8种元素的位置如图所示,试回答下列问题:
(1)元素⑧在周期表中的位置是____ ________,其最高价氧化物的水化物化学式为_______。
(2)元素③④⑤简单离子半径从小到大的顺序为______________________(用离子符号表示)。
(3)8种元素中,最高价氧化物对应水化物的碱性最强的是_______(填化学式,下同),最高价氧化物对应水化物的酸性最强的是_______,简单氢化物最稳定的是_______。
(4)元素①和④可以按原子个数比1:1形成一种离子化合物M,M的电子式子为_______。M是一种良好的储氢材料,遇水后放出氢气并生成一种碱。写出M与水反应的化学方程式:___ ______ _ _____ ______ _ __。若NA表示阿伏伽德罗常数,则该反应每生成标况下的氢气22.4L,转移电子数目为_____ 。
第四周期ⅣA族
KOH
HF
NA
【例14】门捷列夫在研究周期表时预言了包括“类铝”“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勤发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物对应的水化物为两性氢氧化物。试比较元素的非金属性Si__Ge(用“>”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置_____________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是___________。
>
第四周期ⅣA族
半导体材料
课堂练习
③硅和锗单质分别与H2反应时,反应较难进行的是______(填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因____________________________。
②为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液,____________和________________。
锗
稀硫酸(或盐酸)
原子最外层电子数都是3个
NaOH溶液
课堂练习
课堂小结
元素周期律
元素周期表
表现
形式
体现
应用
位
构
性
离子的性质
氢化物
得失电子
氧化物
化合价
含氧酸
氢氧化物
预测新元素
指导寻找有新用途的元素
https://www.21cnjy.com/help/help_extract.php
