课题3 利用化学方程式的简单计算(课件15页)
文档属性
| 名称 | 课题3 利用化学方程式的简单计算(课件15页) |  | |
| 格式 | zip | ||
| 文件大小 | 49.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-21 16:08:47 | ||
图片预览






文档简介
(共15张PPT)
课题3 利用化学方程式的简单计算
第五单元
在化工生产中用一定量的原料最多可以生产多少产品?制备一定量的产品最少需要多少原料?如何有计划合理的利用资源?
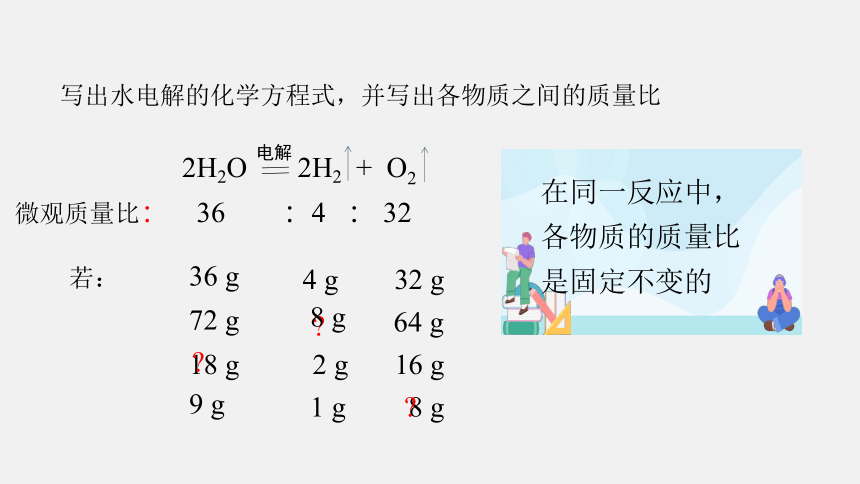
写出水电解的化学方程式,并写出各物质之间的质量比
2H2O 2H2 + O2
电解
微观质量比:
36 :4 : 32
若:
36 g
4 g
32 g
18 g
2 g
16 g
72 g
8 g
64 g
9 g
1 g
8 g
在同一反应中,各物质的质量比是固定不变的
例1:加热分解6.3g高锰酸钾,可以得到氧气的质量是多少?
【分析】一般解法如下:
设未知量
解:设可得氧气的质量为x。
写化学方程式
2KMnO4 ══ K2MnO4 + MnO2 + O2
△
标出有关物质的量
已知量
2×(39+55+4×16)
2×16
6.3g
x
列比例式
答
答:可以得到0.6g氧气。
(1)设:根据题意设未知量;
(2)写:正确书写化学方程式;
(3)标:标出有关物质的量;
(4)列:列出比例式,求解;
(5)答:简明地写出答案。
上标相对分子质量
下标已知质量和未知数
根据化学方程式进行计算的步骤
学即练
若以过氧化氢为原料制取氧气,过氧化氢的质量是68g,能制取需要多少氧气?
解:设需要氧气质量为x。
2H2O2 2 H2O + O2
MnO2
68
32
68g
Χ
68
32
=
68g
X
Χ=32g
答:可以得到32g氧气。
中国登山协会为纪念我国首次攀登珠穆拉玛峰成功50周年,再次组织登珠活动。假如每名运动员冲顶时消耗自带的液氧4.8Kg,
求:若这些用高锰酸钾为原料,需要多少千克高锰酸钾?
KMnO4 K2MnO4+MnO2+O2↑
158 32
答:高锰酸钾的质量是23.7Kg。
解:设需要高锰酸钾 x 。
x
158
=
x
32
4.8Kg
x
=
158×4.8kg
= 23.7 Kg
32
4.8kg
例2:工业上,煅烧石灰石可制得生石灰和二氧化碳。如果要制取5.6t氧化钙,需要碳酸钙的质量是多少?
答:需要碳酸钙的质量为10t。
解:设需要碳酸钙的质量为x。
CaCO3 ══ CaO + CO2
100 56
x 5.6t
高温
100 x
56 5.6t
=
x =
100 ×5.6t
56
=10t
通过电解水制得的氢气,若要制得0.4Kg氢气,理论上消耗水的质量是多少?
2H2O 2H2 ↑+ O2↑
36 4
答:消耗水的质量是为3.6Kg。
解:理论上消耗水的质量是x 。
x
36
=
x
4
通电
0.4kg
x
=
36×0.4Kg
= 3.6Kg
4
0.4Kg
实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。请回答:
(1)反应生成氧气的质量为 g;
(2)参加反应的过氧化氢的质量是多少?
1.6
物质总质量 /g
反应时间
0
68.4
70
2H2O2 2H2O + O2↑
68 32
答:参加反应的过氧化氢的质量为3.4g。
解:设参加反应的过氧化氢的质量为x 。
x
68
=
x
32
MnO2
1.6g
x
=
68×1.6g
= 3.4g
32
1.6g
练习.在实验室里加热30g氯酸钾KClO3和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g.请计算:
(1)则生成氧气的质量为______g。
(2)求原混合物中氯酸钾的质量。
9.6
MnO2
物质总质量 /g
反应时间
0
20.4
30
2KClO3 2KCl+3O2↑
245 96
答:混合物氯酸钾的质量是24.5g。
解:设原混合物中氯酸钾质量为x 。
x
245
=
x
96
9.6g
x
=
245×9.6g
= 24.5 Kg
96
9.6g
变式训练
某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定量的该样品与1g 的二氧化锰混合,其总共的质量为6g ,依次加热该样品的混合物t1、t2、t3、t4、时间后,分别冷却并称量剩余物的质量,记录的有关数据如下表所示
加热时间 t1 t2 t3 t4
剩余固体质量/g 4.24 4.16 4.08 4.08
1.完全反应后产生的氧气的质量是多少?
6-4.08=1.92(g)
2.样品中氯酸钾的纯度是多少?
2KClO3 2KCl+3O2↑
245 96
解:设原混合物中氯酸钾质量为x 。
x
245
=
x
96
1.92g
x
=
245×1.92g
=4.9 g
96
1.92g
MnO2
4.9
5
×100%
=98%
答:样品中氯酸钾的纯度是98%
Thank You For Watching
课题3 利用化学方程式的简单计算
第五单元
在化工生产中用一定量的原料最多可以生产多少产品?制备一定量的产品最少需要多少原料?如何有计划合理的利用资源?
写出水电解的化学方程式,并写出各物质之间的质量比
2H2O 2H2 + O2
电解
微观质量比:
36 :4 : 32
若:
36 g
4 g
32 g
18 g
2 g
16 g
72 g
8 g
64 g
9 g
1 g
8 g
在同一反应中,各物质的质量比是固定不变的
例1:加热分解6.3g高锰酸钾,可以得到氧气的质量是多少?
【分析】一般解法如下:
设未知量
解:设可得氧气的质量为x。
写化学方程式
2KMnO4 ══ K2MnO4 + MnO2 + O2
△
标出有关物质的量
已知量
2×(39+55+4×16)
2×16
6.3g
x
列比例式
答
答:可以得到0.6g氧气。
(1)设:根据题意设未知量;
(2)写:正确书写化学方程式;
(3)标:标出有关物质的量;
(4)列:列出比例式,求解;
(5)答:简明地写出答案。
上标相对分子质量
下标已知质量和未知数
根据化学方程式进行计算的步骤
学即练
若以过氧化氢为原料制取氧气,过氧化氢的质量是68g,能制取需要多少氧气?
解:设需要氧气质量为x。
2H2O2 2 H2O + O2
MnO2
68
32
68g
Χ
68
32
=
68g
X
Χ=32g
答:可以得到32g氧气。
中国登山协会为纪念我国首次攀登珠穆拉玛峰成功50周年,再次组织登珠活动。假如每名运动员冲顶时消耗自带的液氧4.8Kg,
求:若这些用高锰酸钾为原料,需要多少千克高锰酸钾?
KMnO4 K2MnO4+MnO2+O2↑
158 32
答:高锰酸钾的质量是23.7Kg。
解:设需要高锰酸钾 x 。
x
158
=
x
32
4.8Kg
x
=
158×4.8kg
= 23.7 Kg
32
4.8kg
例2:工业上,煅烧石灰石可制得生石灰和二氧化碳。如果要制取5.6t氧化钙,需要碳酸钙的质量是多少?
答:需要碳酸钙的质量为10t。
解:设需要碳酸钙的质量为x。
CaCO3 ══ CaO + CO2
100 56
x 5.6t
高温
100 x
56 5.6t
=
x =
100 ×5.6t
56
=10t
通过电解水制得的氢气,若要制得0.4Kg氢气,理论上消耗水的质量是多少?
2H2O 2H2 ↑+ O2↑
36 4
答:消耗水的质量是为3.6Kg。
解:理论上消耗水的质量是x 。
x
36
=
x
4
通电
0.4kg
x
=
36×0.4Kg
= 3.6Kg
4
0.4Kg
实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。请回答:
(1)反应生成氧气的质量为 g;
(2)参加反应的过氧化氢的质量是多少?
1.6
物质总质量 /g
反应时间
0
68.4
70
2H2O2 2H2O + O2↑
68 32
答:参加反应的过氧化氢的质量为3.4g。
解:设参加反应的过氧化氢的质量为x 。
x
68
=
x
32
MnO2
1.6g
x
=
68×1.6g
= 3.4g
32
1.6g
练习.在实验室里加热30g氯酸钾KClO3和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g.请计算:
(1)则生成氧气的质量为______g。
(2)求原混合物中氯酸钾的质量。
9.6
MnO2
物质总质量 /g
反应时间
0
20.4
30
2KClO3 2KCl+3O2↑
245 96
答:混合物氯酸钾的质量是24.5g。
解:设原混合物中氯酸钾质量为x 。
x
245
=
x
96
9.6g
x
=
245×9.6g
= 24.5 Kg
96
9.6g
变式训练
某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定量的该样品与1g 的二氧化锰混合,其总共的质量为6g ,依次加热该样品的混合物t1、t2、t3、t4、时间后,分别冷却并称量剩余物的质量,记录的有关数据如下表所示
加热时间 t1 t2 t3 t4
剩余固体质量/g 4.24 4.16 4.08 4.08
1.完全反应后产生的氧气的质量是多少?
6-4.08=1.92(g)
2.样品中氯酸钾的纯度是多少?
2KClO3 2KCl+3O2↑
245 96
解:设原混合物中氯酸钾质量为x 。
x
245
=
x
96
1.92g
x
=
245×1.92g
=4.9 g
96
1.92g
MnO2
4.9
5
×100%
=98%
答:样品中氯酸钾的纯度是98%
Thank You For Watching
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
