第5节物质的溶解(溶液的配制)
图片预览







文档简介
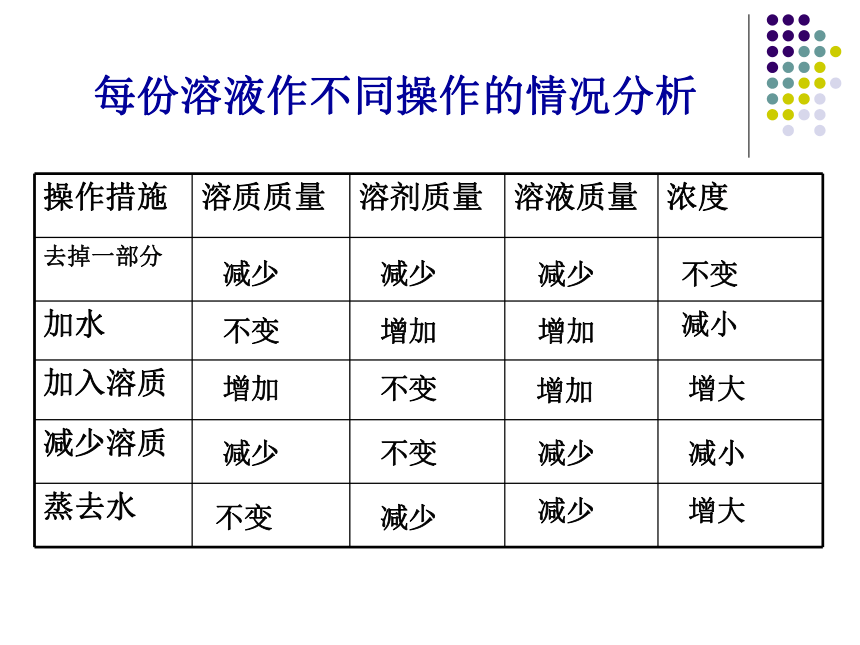
课件25张PPT。溶液的配制一、溶液的组成:溶液由 组成m液 =溶质和溶剂m质+m剂减少 减少减少不变不变 增加增加减小不变减少减少
增加不变增加
增大减少不变减少减小增大每份溶液作不同操作的情况分析二、溶质的质量分数(表示溶液浓度)通常用百分数表示C% =×100%溶质的质量分数=质液对10%的食盐溶液含义的解释错误的是:
A.100克水中溶解了10克食盐
B.100克食盐溶液中溶解有10克食盐
C.将10克食盐溶解于90克水中所得到的溶液
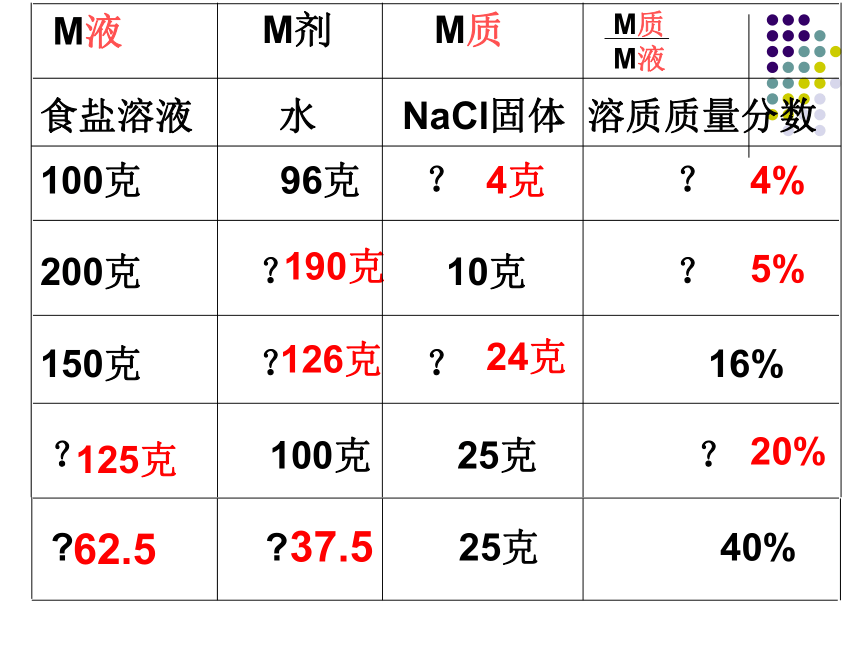
D.将食盐与水按1:10的质量比配成的溶液理解食盐溶液 水 NaCl固体 溶质质量分数100克 96克 ? ?
200克 ? 10克 ?
150克 ? ? 16%
? 100克 25克 ?
? ? 25克 40%4克4%190克5%24克126克125克20%M液M剂M质M质
M液
62.537.5练习1、蒸干25克氯化钠溶液得到
5克氯化钠,计算该溶液的溶
质质量分数。练习2、配制80克20%的硝酸钾溶液,
需硝酸钾和水各多少克?解: m(硝酸钾)=80×20%=16(克)
m(水)=80-16=64(克)
答:配制80克20%的硝酸钾溶液需硝酸钾16克
和水64克。判断下列说法是否正确,并加以改正。
⑴在100克水中溶解30克食盐,溶质质量分数是
30%
⑵从100克10%的食盐溶液里取出10克,其浓度
是10%
⑶将100克10%的食盐溶液和100克10%的食盐溶
液混合,混合溶液的浓度是20%
⑷ 20℃时,100克水中最多溶解36克食盐,它的
溶解度是36克/100克水,浓度是36%( × )( √ )( × )( × )
饱和溶液的C% =1、联系:三、溶解度(S)与C%的换算2、不同点:
一定温
度下常温或
某一定
温度下饱和不一定100克不一定S=m溶质
m溶剂×100克C%=m溶质
m溶液×100%克无练习
1、已知20℃时硝酸钾的溶解度为31.6克,计算
200克硝酸钾饱和溶液的溶质质量分数为多少?解:因溶液为饱和状态,所以
C% =
答:略。2、现有50 ℃时硼酸饱和溶液,浓度为9%,
求该温度时硼酸的溶解度。解:据题意:
S
100+S×100%=9%S=9.89克/100克水答:略.3、20℃时,食盐的溶解度为36克,将30克食盐放入80克水中,充分搅拌后,所得溶液的溶质质量分数为多少?所得溶液是否饱和?∴30克食盐未全部溶解,所得溶液饱和。小结:溶质的质量分数C% =×100%饱和溶液的C% =如何配制100克2%的NaCl溶液?思考(1)需NaCl固体_____克,水______毫升 (2) 配制溶液实验步骤步骤:计算 称量(量取) 溶解仪器:托盘天平、药匙、量筒、胶头滴管、
烧杯、玻璃棒298能否用5%的氯化钠溶液配制100克2%的氯化钠溶液?加水稀释用水稀释浓溶液:
浓溶液中溶质质量=稀释后溶液中溶质质量m浓溶液中溶质= m浓溶液 × C浓%m稀溶液中溶质= m稀溶液 × C浓%四、关于溶液稀释问题的计算m浓×C浓% = m稀×C稀%
m水=m稀- m浓配制100克2%的氯化钠溶液需要多少克5%的氯化钠溶液?加水多少克?解设:需5%的氯化钠溶液X克5%×X100×2%=X40克m水=100g – 40g = 60 克=四、关于溶液稀释问题的计算m浓×C浓% = m稀×C稀%
m水=m稀- m浓m液=ρ· V【例题 】配制20%的盐酸溶液100克,需要
(1) 市售 37% 的浓盐酸多少克?解:设需37%的浓盐酸x克
x· 37%=100×20% x=54.05(克)
浓盐酸的ρ =1.19g/mL (2)需要浓盐酸多少毫升?=45.42 mL(3)需要加水多少毫升?=100-54.05=45.95(克) m水= m稀- m浓练习1:工业上常用10%的稀硫酸去除铁器表面的
铁锈。为了配制50千克10%的稀硫酸。问:
(1)需要98%的浓硫酸多少千克?
(2)需要加水多少千克?解:设需浓硫酸 x 千克
根据 m浓×C浓% = m稀×C稀%
x ×98% = 50 ×10% x=5.1(千克)m水= m稀- m浓
m水=50 - 5.1=44.9(千克)
答:略。
练习2:要配制300毫升10%的硫酸溶液需90%的硫
酸溶液多少毫升?需加水多少毫升?解:查对照表可知,10%与90%的硫酸溶液的密度
分别为1.07克/厘米3和1.81克/厘米3 设需90%的硫酸x克
300×1.07 ×10%= x ×90%
x=35.67克
m水= m稀- m浓=300×1.07-35.67=285.3克
V水=285.3毫升 答:略
增加不变增加
增大减少不变减少减小增大每份溶液作不同操作的情况分析二、溶质的质量分数(表示溶液浓度)通常用百分数表示C% =×100%溶质的质量分数=质液对10%的食盐溶液含义的解释错误的是:
A.100克水中溶解了10克食盐
B.100克食盐溶液中溶解有10克食盐
C.将10克食盐溶解于90克水中所得到的溶液
D.将食盐与水按1:10的质量比配成的溶液理解食盐溶液 水 NaCl固体 溶质质量分数100克 96克 ? ?
200克 ? 10克 ?
150克 ? ? 16%
? 100克 25克 ?
? ? 25克 40%4克4%190克5%24克126克125克20%M液M剂M质M质
M液
62.537.5练习1、蒸干25克氯化钠溶液得到
5克氯化钠,计算该溶液的溶
质质量分数。练习2、配制80克20%的硝酸钾溶液,
需硝酸钾和水各多少克?解: m(硝酸钾)=80×20%=16(克)
m(水)=80-16=64(克)
答:配制80克20%的硝酸钾溶液需硝酸钾16克
和水64克。判断下列说法是否正确,并加以改正。
⑴在100克水中溶解30克食盐,溶质质量分数是
30%
⑵从100克10%的食盐溶液里取出10克,其浓度
是10%
⑶将100克10%的食盐溶液和100克10%的食盐溶
液混合,混合溶液的浓度是20%
⑷ 20℃时,100克水中最多溶解36克食盐,它的
溶解度是36克/100克水,浓度是36%( × )( √ )( × )( × )
饱和溶液的C% =1、联系:三、溶解度(S)与C%的换算2、不同点:
一定温
度下常温或
某一定
温度下饱和不一定100克不一定S=m溶质
m溶剂×100克C%=m溶质
m溶液×100%克无练习
1、已知20℃时硝酸钾的溶解度为31.6克,计算
200克硝酸钾饱和溶液的溶质质量分数为多少?解:因溶液为饱和状态,所以
C% =
答:略。2、现有50 ℃时硼酸饱和溶液,浓度为9%,
求该温度时硼酸的溶解度。解:据题意:
S
100+S×100%=9%S=9.89克/100克水答:略.3、20℃时,食盐的溶解度为36克,将30克食盐放入80克水中,充分搅拌后,所得溶液的溶质质量分数为多少?所得溶液是否饱和?∴30克食盐未全部溶解,所得溶液饱和。小结:溶质的质量分数C% =×100%饱和溶液的C% =如何配制100克2%的NaCl溶液?思考(1)需NaCl固体_____克,水______毫升 (2) 配制溶液实验步骤步骤:计算 称量(量取) 溶解仪器:托盘天平、药匙、量筒、胶头滴管、
烧杯、玻璃棒298能否用5%的氯化钠溶液配制100克2%的氯化钠溶液?加水稀释用水稀释浓溶液:
浓溶液中溶质质量=稀释后溶液中溶质质量m浓溶液中溶质= m浓溶液 × C浓%m稀溶液中溶质= m稀溶液 × C浓%四、关于溶液稀释问题的计算m浓×C浓% = m稀×C稀%
m水=m稀- m浓配制100克2%的氯化钠溶液需要多少克5%的氯化钠溶液?加水多少克?解设:需5%的氯化钠溶液X克5%×X100×2%=X40克m水=100g – 40g = 60 克=四、关于溶液稀释问题的计算m浓×C浓% = m稀×C稀%
m水=m稀- m浓m液=ρ· V【例题 】配制20%的盐酸溶液100克,需要
(1) 市售 37% 的浓盐酸多少克?解:设需37%的浓盐酸x克
x· 37%=100×20% x=54.05(克)
浓盐酸的ρ =1.19g/mL (2)需要浓盐酸多少毫升?=45.42 mL(3)需要加水多少毫升?=100-54.05=45.95(克) m水= m稀- m浓练习1:工业上常用10%的稀硫酸去除铁器表面的
铁锈。为了配制50千克10%的稀硫酸。问:
(1)需要98%的浓硫酸多少千克?
(2)需要加水多少千克?解:设需浓硫酸 x 千克
根据 m浓×C浓% = m稀×C稀%
x ×98% = 50 ×10% x=5.1(千克)m水= m稀- m浓
m水=50 - 5.1=44.9(千克)
答:略。
练习2:要配制300毫升10%的硫酸溶液需90%的硫
酸溶液多少毫升?需加水多少毫升?解:查对照表可知,10%与90%的硫酸溶液的密度
分别为1.07克/厘米3和1.81克/厘米3 设需90%的硫酸x克
300×1.07 ×10%= x ×90%
x=35.67克
m水= m稀- m浓=300×1.07-35.67=285.3克
V水=285.3毫升 答:略
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
