化学人教版(2019)必修第一册2.1.2 钠的几种化合物 课件(共20张PPT)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.2 钠的几种化合物 课件(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-20 21:34:05 | ||
图片预览




文档简介
(共20张PPT)
第2课时 钠的几种化合物
第二章 第一节 海水中的重要元素——钠和氯
思考与讨论
一、氧化钠和过氧化钠
1、回忆上节课的实验,描述氧化钠和过氧化钠的颜色、状态。
氧化钠—白色固体
过氧化钠—淡黄色固体
思考与讨论
一、氧化钠和过氧化钠
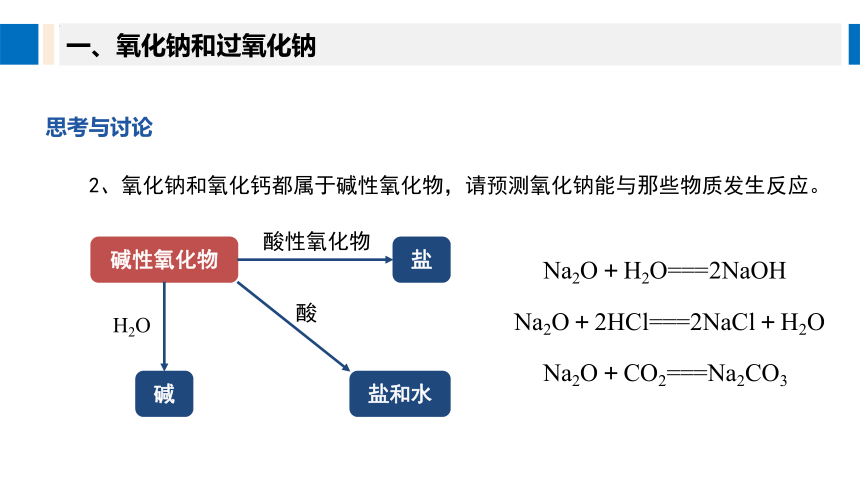
2、氧化钠和氧化钙都属于碱性氧化物,请预测氧化钠能与那些物质发生反应。
碱性氧化物
碱
盐
酸性氧化物
H2O
盐和水
酸
Na2O+H2O===2NaOH
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
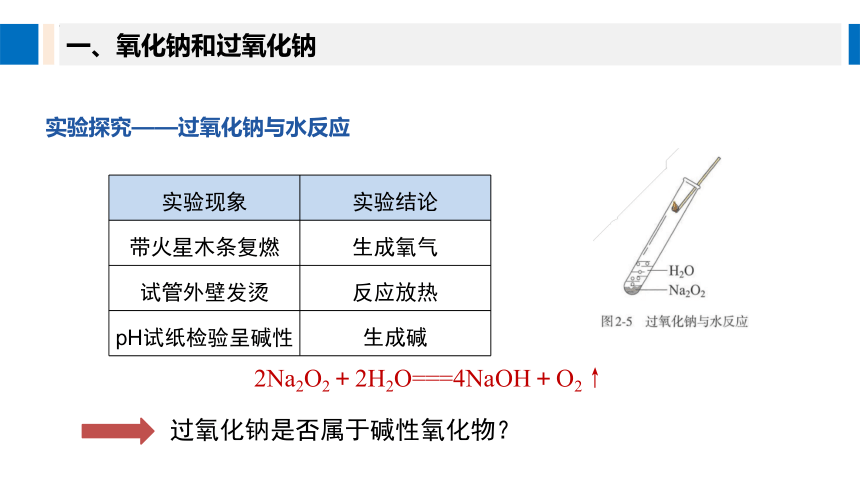
实验探究——过氧化钠与水反应
一、氧化钠和过氧化钠
实验现象 实验结论
带火星木条复燃 生成氧气
试管外壁发烫 反应放热
pH试纸检验呈碱性 生成碱
2Na2O2+2H2O===4NaOH+O2↑
过氧化钠是否属于碱性氧化物?
一、氧化钠和过氧化钠
氧化钠与含有CO2和水蒸气的空气接触时,既能产生O2,又能吸收空气中的CO2
2Na2O2+2CO2===2Na2CO3+O2
性质
用途
利用该技术将药板装备用于潜艇、宇宙飞船、呼吸面具等密闭环境中,供人们呼吸应急使用。
实验探究——过氧化钠与CO2反应
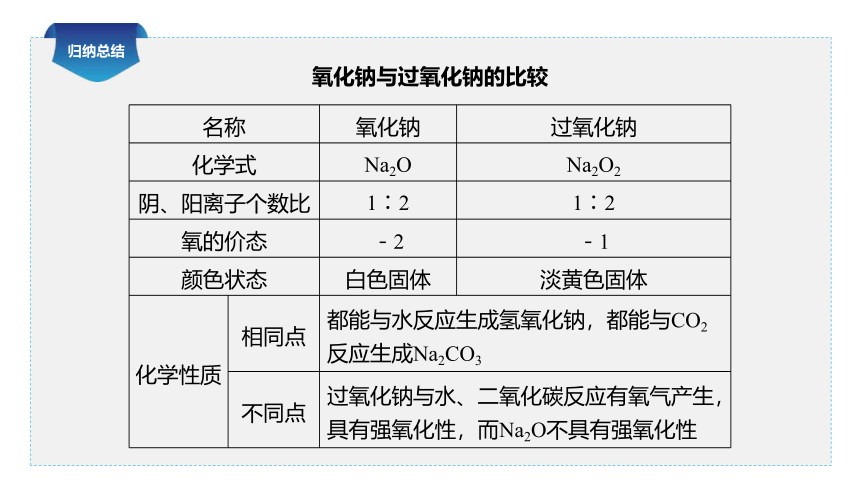
归纳总结
氧化钠与过氧化钠的比较
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
阴、阳离子个数比 1∶2 1∶2
氧的价态 -2 -1
颜色状态 白色固体 淡黄色固体
化学性质 相同点 都能与水反应生成氢氧化钠,都能与CO2反应生成Na2CO3
不同点 过氧化钠与水、二氧化碳反应有氧气产生,具有强氧化性,而Na2O不具有强氧化性
二、碳酸钠和碳酸氢钠
苏氏三兄弟
苏打(碳酸钠)
小苏打(碳酸氢钠)
大苏打(硫代硫酸钠)
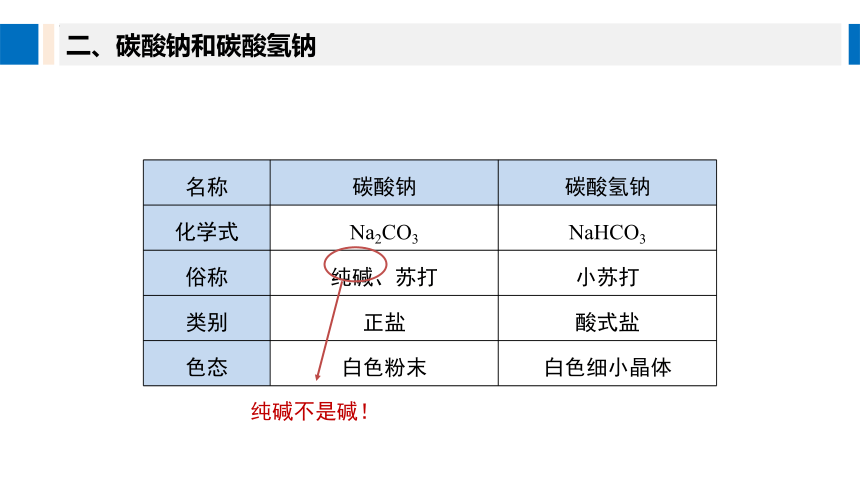
二、碳酸钠和碳酸氢钠
名称 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗称 纯碱、苏打 小苏打
类别 正盐 酸式盐
色态 白色粉末 白色细小晶体
纯碱不是碱!
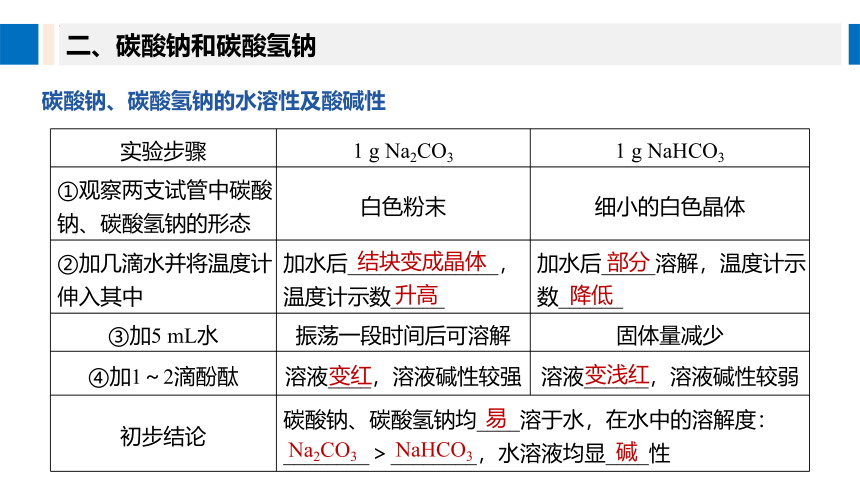
碳酸钠、碳酸氢钠的水溶性及酸碱性
二、碳酸钠和碳酸氢钠
实验步骤 1 g Na2CO3 1 g NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态 白色粉末 细小的白色晶体
②加几滴水并将温度计伸入其中 加水后______________,温度计示数_____ 加水后_____溶解,温度计示数______
③加5 mL水 振荡一段时间后可溶解 固体量减少
④加1~2滴酚酞 溶液____,溶液碱性较强 溶液______,溶液碱性较弱
初步结论 碳酸钠、碳酸氢钠均____溶于水,在水中的溶解度:________>________,水溶液均显____性
结块变成晶体
升高
部分
降低
变红
变浅红
易
Na2CO3
NaHCO3
碱
二、碳酸钠和碳酸氢钠
化学性质
1、与盐酸反应:
结论
两者均能与酸反应,碳酸氢钠与盐酸反应更剧烈,且碳酸氢钠与盐酸反应更剧烈
反应:
Na2CO3+2HCl === 2NaCl+H2O+ CO2↑
NaHCO3+HCl === NaCl+H2O+ CO2↑
Na2CO3+HCl === NaHCO3 +NaCl
NaHCO3+HCl === NaCl+H2O+ CO2↑
慢
快
二、碳酸钠和碳酸氢钠
化学性质
2、热稳定性比较:
试管口为什么要略向下倾斜?
二、碳酸钠和碳酸氢钠
Na2CO3 NaHCO3
现象 澄清石灰水不变浑浊 试管口处有水珠,澄清的石灰水变浑浊
反应方程式 / 2NaHCO3 === Na2CO3+H2O+ CO2↑
结论 受热不分解 受热易分解
比较 热稳定性:Na2CO3 > NaHCO3
化学性质
2、热稳定性比较:
二、碳酸钠和碳酸氢钠
化学性质
3、与盐反应:
分别取少量Na2CO3溶液和NaHCO3溶液于两支试管中,加入CaCl2溶液。
Na2CO3+ CaCl2 === 2NaCl+CaCO3↓
(白色沉淀)
NaHCO3+ CaCl2 不反应!!!
二、碳酸钠和碳酸氢钠
化学性质
3、与盐反应:
分别取少量Na2CO3溶液和NaHCO3溶液于两支试管中,加入Ca(OH)2溶液,会出现什么现象?
现象:都有白色沉淀生成
Na2CO3+ Ca(OH)2 === 2NaOH+CaCO3↓
(白色沉淀)
HCO3- + OH- ===CO32-+H2O
二、碳酸钠和碳酸氢钠
学以致用
如何鉴别Na2CO3和NaHCO3?
1、溶解: Na2CO3 比 NaHCO3 易溶于水,且溶解放热
2、(固体)加热: Na2CO3 稳定,NaHCO3受热易分解
3、加入稀HCl: Na2CO3 的反应速率比 NaHCO3 慢
4、先溶解后加入CaCl2 : Na2CO3 有白色沉淀, NaHCO3 没有白色沉淀
二、碳酸钠和碳酸氢钠
知识拓展——侯氏制碱法(联合制碱法)
吸氨
NaHCO3
沉淀
Na2CO3
碳酸化
过滤
煅烧
盐析
冷析
吸氨
精制饱和食盐水
NH3
NH3
母液Ⅱ
母液Ⅰ
NH4Cl
NaCl
CO2
澄清
降温
由合成氨工业提供
CO2
NH4+、Cl-、Na+、HCO3-
Na+、Cl-、(主要)
NH4+、HCO3-(少量)
二、碳酸钠和碳酸氢钠
知识拓展——侯氏制碱法(联合制碱法)
【问题】实际工业中为什么要先向饱和食盐水中通入氨气制得氨盐水,再通入CO2?
目标:获得更多的HCO3-
室温下: CO2的溶解度(1:1) NH3 的溶解度(1:700)
先通NH3: 吸收的CO2量多, HCO3-产量大。
只需持续通入(足量)即可,操作简便。
先通CO2: 需要控制NH3的吸收量(少量)。
吸收的NH3量少,HCO3-产量小。
二、碳酸钠和碳酸氢钠
知识拓展——侯氏制碱法(联合制碱法)
【原理】
依据离子反应发生的原理进行,离子反应会向着离子浓度减小的方向进行。要制纯碱,先制得溶解度较小的NaHCO3。再利用其不稳定性分解得到纯碱。
要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入CO2,在溶液中就有了大量得钠离子、铵根离子、氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用。
三、焰色试验
操作
盐酸
原火焰颜色相同
试样
火焰的颜色
盐酸
无色
总结归纳
第2课时 钠的几种化合物
第二章 第一节 海水中的重要元素——钠和氯
思考与讨论
一、氧化钠和过氧化钠
1、回忆上节课的实验,描述氧化钠和过氧化钠的颜色、状态。
氧化钠—白色固体
过氧化钠—淡黄色固体
思考与讨论
一、氧化钠和过氧化钠
2、氧化钠和氧化钙都属于碱性氧化物,请预测氧化钠能与那些物质发生反应。
碱性氧化物
碱
盐
酸性氧化物
H2O
盐和水
酸
Na2O+H2O===2NaOH
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
实验探究——过氧化钠与水反应
一、氧化钠和过氧化钠
实验现象 实验结论
带火星木条复燃 生成氧气
试管外壁发烫 反应放热
pH试纸检验呈碱性 生成碱
2Na2O2+2H2O===4NaOH+O2↑
过氧化钠是否属于碱性氧化物?
一、氧化钠和过氧化钠
氧化钠与含有CO2和水蒸气的空气接触时,既能产生O2,又能吸收空气中的CO2
2Na2O2+2CO2===2Na2CO3+O2
性质
用途
利用该技术将药板装备用于潜艇、宇宙飞船、呼吸面具等密闭环境中,供人们呼吸应急使用。
实验探究——过氧化钠与CO2反应
归纳总结
氧化钠与过氧化钠的比较
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
阴、阳离子个数比 1∶2 1∶2
氧的价态 -2 -1
颜色状态 白色固体 淡黄色固体
化学性质 相同点 都能与水反应生成氢氧化钠,都能与CO2反应生成Na2CO3
不同点 过氧化钠与水、二氧化碳反应有氧气产生,具有强氧化性,而Na2O不具有强氧化性
二、碳酸钠和碳酸氢钠
苏氏三兄弟
苏打(碳酸钠)
小苏打(碳酸氢钠)
大苏打(硫代硫酸钠)
二、碳酸钠和碳酸氢钠
名称 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗称 纯碱、苏打 小苏打
类别 正盐 酸式盐
色态 白色粉末 白色细小晶体
纯碱不是碱!
碳酸钠、碳酸氢钠的水溶性及酸碱性
二、碳酸钠和碳酸氢钠
实验步骤 1 g Na2CO3 1 g NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态 白色粉末 细小的白色晶体
②加几滴水并将温度计伸入其中 加水后______________,温度计示数_____ 加水后_____溶解,温度计示数______
③加5 mL水 振荡一段时间后可溶解 固体量减少
④加1~2滴酚酞 溶液____,溶液碱性较强 溶液______,溶液碱性较弱
初步结论 碳酸钠、碳酸氢钠均____溶于水,在水中的溶解度:________>________,水溶液均显____性
结块变成晶体
升高
部分
降低
变红
变浅红
易
Na2CO3
NaHCO3
碱
二、碳酸钠和碳酸氢钠
化学性质
1、与盐酸反应:
结论
两者均能与酸反应,碳酸氢钠与盐酸反应更剧烈,且碳酸氢钠与盐酸反应更剧烈
反应:
Na2CO3+2HCl === 2NaCl+H2O+ CO2↑
NaHCO3+HCl === NaCl+H2O+ CO2↑
Na2CO3+HCl === NaHCO3 +NaCl
NaHCO3+HCl === NaCl+H2O+ CO2↑
慢
快
二、碳酸钠和碳酸氢钠
化学性质
2、热稳定性比较:
试管口为什么要略向下倾斜?
二、碳酸钠和碳酸氢钠
Na2CO3 NaHCO3
现象 澄清石灰水不变浑浊 试管口处有水珠,澄清的石灰水变浑浊
反应方程式 / 2NaHCO3 === Na2CO3+H2O+ CO2↑
结论 受热不分解 受热易分解
比较 热稳定性:Na2CO3 > NaHCO3
化学性质
2、热稳定性比较:
二、碳酸钠和碳酸氢钠
化学性质
3、与盐反应:
分别取少量Na2CO3溶液和NaHCO3溶液于两支试管中,加入CaCl2溶液。
Na2CO3+ CaCl2 === 2NaCl+CaCO3↓
(白色沉淀)
NaHCO3+ CaCl2 不反应!!!
二、碳酸钠和碳酸氢钠
化学性质
3、与盐反应:
分别取少量Na2CO3溶液和NaHCO3溶液于两支试管中,加入Ca(OH)2溶液,会出现什么现象?
现象:都有白色沉淀生成
Na2CO3+ Ca(OH)2 === 2NaOH+CaCO3↓
(白色沉淀)
HCO3- + OH- ===CO32-+H2O
二、碳酸钠和碳酸氢钠
学以致用
如何鉴别Na2CO3和NaHCO3?
1、溶解: Na2CO3 比 NaHCO3 易溶于水,且溶解放热
2、(固体)加热: Na2CO3 稳定,NaHCO3受热易分解
3、加入稀HCl: Na2CO3 的反应速率比 NaHCO3 慢
4、先溶解后加入CaCl2 : Na2CO3 有白色沉淀, NaHCO3 没有白色沉淀
二、碳酸钠和碳酸氢钠
知识拓展——侯氏制碱法(联合制碱法)
吸氨
NaHCO3
沉淀
Na2CO3
碳酸化
过滤
煅烧
盐析
冷析
吸氨
精制饱和食盐水
NH3
NH3
母液Ⅱ
母液Ⅰ
NH4Cl
NaCl
CO2
澄清
降温
由合成氨工业提供
CO2
NH4+、Cl-、Na+、HCO3-
Na+、Cl-、(主要)
NH4+、HCO3-(少量)
二、碳酸钠和碳酸氢钠
知识拓展——侯氏制碱法(联合制碱法)
【问题】实际工业中为什么要先向饱和食盐水中通入氨气制得氨盐水,再通入CO2?
目标:获得更多的HCO3-
室温下: CO2的溶解度(1:1) NH3 的溶解度(1:700)
先通NH3: 吸收的CO2量多, HCO3-产量大。
只需持续通入(足量)即可,操作简便。
先通CO2: 需要控制NH3的吸收量(少量)。
吸收的NH3量少,HCO3-产量小。
二、碳酸钠和碳酸氢钠
知识拓展——侯氏制碱法(联合制碱法)
【原理】
依据离子反应发生的原理进行,离子反应会向着离子浓度减小的方向进行。要制纯碱,先制得溶解度较小的NaHCO3。再利用其不稳定性分解得到纯碱。
要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入CO2,在溶液中就有了大量得钠离子、铵根离子、氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用。
三、焰色试验
操作
盐酸
原火焰颜色相同
试样
火焰的颜色
盐酸
无色
总结归纳
