第5单元 化学方程式(复习课件33页)-2022-2023学年九年级化学上册精品课堂课件精讲及好题精练(人教版)
文档属性
| 名称 | 第5单元 化学方程式(复习课件33页)-2022-2023学年九年级化学上册精品课堂课件精讲及好题精练(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-21 00:00:00 | ||
图片预览










文档简介
(共33张PPT)
第5单元 化学方程式
( 复 习)
人教版 化学(初中)
1.认识质量守恒定律,并能应用质量守恒定律解释化学变化中发生的一些现象;
2.了解化学方程式的意义和书写原则,并能正确书写简单的化学反应方程式;
3.掌握简单化学方程式的配平方法;
4.掌握根据化学方程式进行计算的步骤和方法。
复习目标
复习重点
复习难点
质量守恒定律,正确书写化学方程式,根据化学方程式的计算。
化学方程式的配平
利用化学
方程式的
简单计算
单击添加文字
知识框架
质量守恒
定律
如何正确
书写化学方
程式
化学方程式
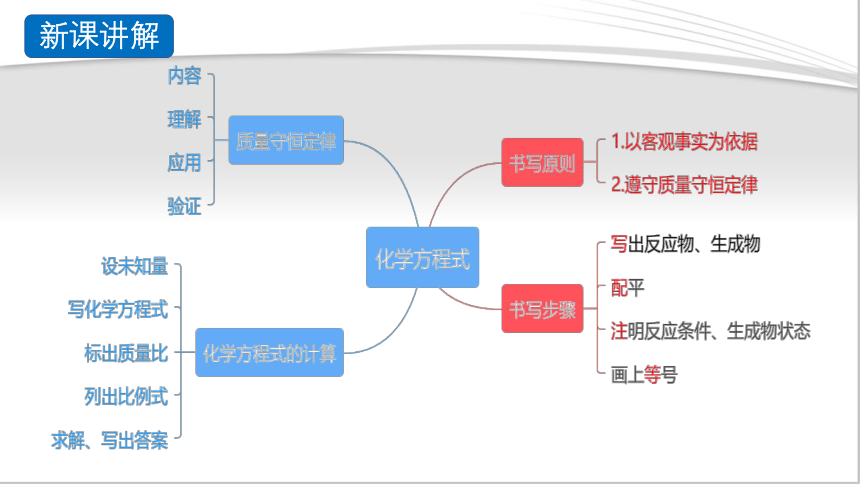
新课讲解
质量守恒定律
1.内容
的各物质的 ,等于反应后生成的各物质的 。
2.微观解释
化学反应的过程是 ,
的过程。在化学反应中,反应前后原子
的 没有改变, 没有增减, 也没有变化。
参加化学反应
质量总和
质量总和
参加反应的各物质(反应物)的原子重新组合
生成其他物质(生成物)
种类
数目
质量
新课讲解
【思考感悟】
有气体参加或生成的反应,在探究质量守恒定律时,应注意什么问题?
有气体参加或生成的反应在探究质量守恒定律时,需
在密闭容器中进行。
【温馨提示】
新课讲解
1.定义:用_______来表示 的式子。
2.意义
(1)质的方面:表示 、 和 。
宏观:反应物、生成物各物质的 ;
(2)量的方面 微观:反应物、生成物各物质的微粒 。
MnO2
====
化学式
化学反应
反应物
生成物
反应条件
质量比
个数比
新课讲解
化学方程式
如反应2H2O2 2H2O+O2↑表示的意义为:
①宏观。
a.质的方面:过氧化氢在 反应生成 和 。
b.量的方面:每_____质量的过氧化氢在催化剂作用下反应生成_____质量的水和_____质量的氧气。
②微观。
每 在催化剂作用下反应生成__________和_________。
3.书写原则
(1)要以 为基础。(2)要遵守 定律。
催化剂作用下
水
氧气
68份
36份
32份
2个过氧化氢分子
2个水分子
1个氧分子
客观事实
质量守恒
新课讲解
4.书写步骤
写
配
标
查
写出反应物、生成物的化学式
配平化学方程式
标明化学反应的条件,标出生成物的状态,把短线改为“=”
一查化学式是否正确,
二查是否配平,
三查生成物状态是否标注、标注是否恰当,
四查反应条件是否标明
新课讲解
5.利用化学方程式的简单计算
(1)计算依据:化学方程式中各物质间的质量关系。
新课讲解
(2)计算步骤:简记为:六步骤。即:
新课讲解
【思考感悟】
配平化学方程式时,为使左右两边同一元素的原子个数相等,能否改变化学式中元素符号右下角的数字?
新课讲解
【温馨提示】
不能。一种物质只有一种化学式,改变了化学式中元素符号
右下角数字就改变了物质结构,不符合客观事实,因此只能
在化学式前配上适当的化学计量数,使之平衡。
一、对质量守恒定律的解读
1.宏观、微观方面的理解
可总结为“五个不变”,“两个肯定变”,“两个可能变”。
五个不变 两个肯定变 两个可能变
宏观 (1)反应物、生成物的总质量 (2)元素的种类 (3)元素的质量不变 物质的种类 元素化合价
微观 (1)原子的种类 (2)原子的数目 (3)原子的质量 分子(构成物质的粒子)的种类 分子的数目
新课讲解
2.应用
(1)解释反应前后物质的质量变化及用质量差确定某一物质的质量。
(2)推断反应物或生成物的化学式。
(3)确定物质的组成元素。
(4)进行各物质量的计算。
新课讲解
(1)质量守恒定律只能解释化学变化不能解释物理变化。
(2)质量守恒是指物质的“质量”守恒,而非“体积”守恒、“分子个数”守恒。
(3)质量守恒是指参加化学反应的各物质的质量总和与生成的各物质的质量总和相等,不包括未反应的质量,也不包括杂质。
新课讲解
【特别提醒】
二、对化学反应类型的正确解读
反应 类型 反应特点 举例
化合 反应 A+B AB 即“多变一” ①2CO+O2 2CO2
②CO2+H2O==H2CO3
分解 反应 AB A+B 即“一变多” ①2H2O2 2H2O+O2↑
②CaCO3 CaO+CO2↑
点燃
====
MnO2
====
高温
====
新课讲解
反应 类型 反应特点 举例
置换 反应 A+BC AC+B 即“一换一” ①C+2CuO 2Cu+CO2↑
②Fe+CuSO4====FeSO4+Cu
复分解 反应 AB+CD AD+CB 即“二换二” ①NaOH+HCl==NaCl+H2O
②Na2CO3+2HCl==2NaCl+CO2↑+H2O
高温
====
新课讲解
质量守恒定律的应用
1、推断未知物的化学式
典例精讲
例1.【2022黑龙江齐齐哈尔中考】利用催化剂将工厂废气中的二氧化碳转化为燃料x,是实现“碳中和”的路径之一,该反应的化学方程式为 ,X的化学式为( )
A. C B. CH4
C. CH3OH D. CH2O
【答案】C
【解析】g根据质量守恒定律的围观本质,在化学反应 前后原子的种类和数量不变,反应前有1个碳原子、6个氢原子、2个氧原子,反应后有2个氢原子、1个氧原子,X必须提供1个碳原子、4个氢原子、1个氧原子,故选C。
新课讲解
例2.某化合物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该化合物的推断正确的是( )
A.一定含有碳、氢、硫元素
B.一定含有碳、氢、氧元素
C.只含有碳、氢元素
D.一定含有碳、氢、氧元素,可能含有硫元素
2、推断物质的组成元素
新课讲解
【答案】A
【详解】某化合物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,说明生成物中含有碳元素、硫元素、氢元素和氧元素,根据质量守恒定律,化学反应前后元素的种类不变,则说说明反应物中含有碳元素、硫元素、氢元素和氧元素,又因为该化合物是在空气中完全燃烧的,故生成物中的氧元素可能来自于氧气,因此可判断该化合物中一定含有碳元素、氢元素、硫元素,是否含有氧元素无法确定;故选A。
新课讲解
3、图表计算题
新课讲解
例3【2022湖南邵阳中考】把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是( )
A. x的值是25 B. 乙一定是催化剂
C. 甲和丁都是反应物 D. 反应中,甲与丙发生改变的质量比是14:33
【答案】A
【解析】A、x =7+10+28+37-14-10-33=25,故选项正确;
B、乙反应前后质量不变,可能为催化剂或没有参与反应,故选项错误;C、甲反应后质量增加,为生成物;丁质量减少,是反应物,故选项错误;D、反应中的甲、丙发生改变的质量比是:(14g-7g):(33g-28g)=7:5,故选项错误。故选A.。
新课讲解
新课讲解
4、微观模型图
例4【2022河北中考】2021年12月9日,中国空间站“天宫课堂”中航天员介绍,他们所需的部分水是由呼吸产生的二氧化碳通过化学反应生成的,实现了循环利用,如图是该反应的示意图。
下列说法正确的是( )
A. 乙和丁中氢元素的化合价相同
B. 参加反应的甲和乙分子个数比为1:3
C. 丁可电解生成供航天员呼吸的氧气
D. 参加反应的甲和生成的丙质量比为1:1
【答案】C
【解析】由微观反应示意图可知,该反应是由氢气和二氧化碳在一定条件下反应生成甲烷和水,化学方程式为
A、乙是氢气,其中氢元素的化合价为零,丁是甲烷,其中氢元素显+1价,故A错误; B、由化学方程式可知,参加反应的甲和乙分子个数比为1:4,故B错误; C、丁是水,水电解可生成供航天员呼吸的氧气,故C正确; D、由化学方程式可知,参加反应的甲和生成的丙质量比为44:16=11:4,故D错误。 故选:C。
新课讲解
新课讲解
5、化学方程式的考查
例5.【2022湖北黄石中考】下列化学方程式书写完全正确的是( )
新课讲解
例6(2021·四川达州市·中考真题)某补钙片的主要成分为CaCO3,每片钙片重0.5 g(假设钙片中其他成分不含钙元素,不溶于水且不与任何物质发生反应)。化学兴趣小组为测定钙片中钙元素的含量,进行了如图实验:
根据图示信息,完成下列各题:
(1)钙片中钙元素的质量分数为______。
(2)求恰好完全反应时所得溶液的溶质质量分数?(要求写出计算过程)
6、利用化学方程式的计算
新课讲解
例7.(2021·湖北宜昌市·中考真题)小华同学为测定某稀盐酸中溶
质的质量分数,在烧杯里放入一定质量的大理石,然后分次加入
该稀盐酸,充分反应后测得生成二氧化碳的质量如表所示(大理
石中的杂质与反应)。
(1)两次加稀盐酸后,生成二氧化碳的总质量是______g。
(2)该稀盐酸中溶质的质量分数。
新课讲解
加盐酸的次数 第一次 第二次
加盐酸的质量/g 25 25
生成二氧化碳的质量/g 2.2 1.1
新课讲解
例8.(2021·湖北荆州市·中考真题)工业制得的碳酸钾中常含有氯化钾。现取含氯化钾杂质的碳酸钾样品10g,其中氧元素的质量为2.4g,向该样品中加入一定量的稀盐酸,恰好完全反应时,得到47.8g溶液,请回答下列问题:
(1)写出上述反应过程中发生反应的化学方程式______。
(2)样品中氯化钾的质量为______g。
(3)求稀盐酸中溶质的质量分数(写出计算过程,计算结果保留一位小数)。
新课讲解
1.完成配套练习册单元检测题;
2.预习课题1 金刚石、石墨、C60
作业布置
第5单元 化学方程式
( 复 习)
人教版 化学(初中)
1.认识质量守恒定律,并能应用质量守恒定律解释化学变化中发生的一些现象;
2.了解化学方程式的意义和书写原则,并能正确书写简单的化学反应方程式;
3.掌握简单化学方程式的配平方法;
4.掌握根据化学方程式进行计算的步骤和方法。
复习目标
复习重点
复习难点
质量守恒定律,正确书写化学方程式,根据化学方程式的计算。
化学方程式的配平
利用化学
方程式的
简单计算
单击添加文字
知识框架
质量守恒
定律
如何正确
书写化学方
程式
化学方程式
新课讲解
质量守恒定律
1.内容
的各物质的 ,等于反应后生成的各物质的 。
2.微观解释
化学反应的过程是 ,
的过程。在化学反应中,反应前后原子
的 没有改变, 没有增减, 也没有变化。
参加化学反应
质量总和
质量总和
参加反应的各物质(反应物)的原子重新组合
生成其他物质(生成物)
种类
数目
质量
新课讲解
【思考感悟】
有气体参加或生成的反应,在探究质量守恒定律时,应注意什么问题?
有气体参加或生成的反应在探究质量守恒定律时,需
在密闭容器中进行。
【温馨提示】
新课讲解
1.定义:用_______来表示 的式子。
2.意义
(1)质的方面:表示 、 和 。
宏观:反应物、生成物各物质的 ;
(2)量的方面 微观:反应物、生成物各物质的微粒 。
MnO2
====
化学式
化学反应
反应物
生成物
反应条件
质量比
个数比
新课讲解
化学方程式
如反应2H2O2 2H2O+O2↑表示的意义为:
①宏观。
a.质的方面:过氧化氢在 反应生成 和 。
b.量的方面:每_____质量的过氧化氢在催化剂作用下反应生成_____质量的水和_____质量的氧气。
②微观。
每 在催化剂作用下反应生成__________和_________。
3.书写原则
(1)要以 为基础。(2)要遵守 定律。
催化剂作用下
水
氧气
68份
36份
32份
2个过氧化氢分子
2个水分子
1个氧分子
客观事实
质量守恒
新课讲解
4.书写步骤
写
配
标
查
写出反应物、生成物的化学式
配平化学方程式
标明化学反应的条件,标出生成物的状态,把短线改为“=”
一查化学式是否正确,
二查是否配平,
三查生成物状态是否标注、标注是否恰当,
四查反应条件是否标明
新课讲解
5.利用化学方程式的简单计算
(1)计算依据:化学方程式中各物质间的质量关系。
新课讲解
(2)计算步骤:简记为:六步骤。即:
新课讲解
【思考感悟】
配平化学方程式时,为使左右两边同一元素的原子个数相等,能否改变化学式中元素符号右下角的数字?
新课讲解
【温馨提示】
不能。一种物质只有一种化学式,改变了化学式中元素符号
右下角数字就改变了物质结构,不符合客观事实,因此只能
在化学式前配上适当的化学计量数,使之平衡。
一、对质量守恒定律的解读
1.宏观、微观方面的理解
可总结为“五个不变”,“两个肯定变”,“两个可能变”。
五个不变 两个肯定变 两个可能变
宏观 (1)反应物、生成物的总质量 (2)元素的种类 (3)元素的质量不变 物质的种类 元素化合价
微观 (1)原子的种类 (2)原子的数目 (3)原子的质量 分子(构成物质的粒子)的种类 分子的数目
新课讲解
2.应用
(1)解释反应前后物质的质量变化及用质量差确定某一物质的质量。
(2)推断反应物或生成物的化学式。
(3)确定物质的组成元素。
(4)进行各物质量的计算。
新课讲解
(1)质量守恒定律只能解释化学变化不能解释物理变化。
(2)质量守恒是指物质的“质量”守恒,而非“体积”守恒、“分子个数”守恒。
(3)质量守恒是指参加化学反应的各物质的质量总和与生成的各物质的质量总和相等,不包括未反应的质量,也不包括杂质。
新课讲解
【特别提醒】
二、对化学反应类型的正确解读
反应 类型 反应特点 举例
化合 反应 A+B AB 即“多变一” ①2CO+O2 2CO2
②CO2+H2O==H2CO3
分解 反应 AB A+B 即“一变多” ①2H2O2 2H2O+O2↑
②CaCO3 CaO+CO2↑
点燃
====
MnO2
====
高温
====
新课讲解
反应 类型 反应特点 举例
置换 反应 A+BC AC+B 即“一换一” ①C+2CuO 2Cu+CO2↑
②Fe+CuSO4====FeSO4+Cu
复分解 反应 AB+CD AD+CB 即“二换二” ①NaOH+HCl==NaCl+H2O
②Na2CO3+2HCl==2NaCl+CO2↑+H2O
高温
====
新课讲解
质量守恒定律的应用
1、推断未知物的化学式
典例精讲
例1.【2022黑龙江齐齐哈尔中考】利用催化剂将工厂废气中的二氧化碳转化为燃料x,是实现“碳中和”的路径之一,该反应的化学方程式为 ,X的化学式为( )
A. C B. CH4
C. CH3OH D. CH2O
【答案】C
【解析】g根据质量守恒定律的围观本质,在化学反应 前后原子的种类和数量不变,反应前有1个碳原子、6个氢原子、2个氧原子,反应后有2个氢原子、1个氧原子,X必须提供1个碳原子、4个氢原子、1个氧原子,故选C。
新课讲解
例2.某化合物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该化合物的推断正确的是( )
A.一定含有碳、氢、硫元素
B.一定含有碳、氢、氧元素
C.只含有碳、氢元素
D.一定含有碳、氢、氧元素,可能含有硫元素
2、推断物质的组成元素
新课讲解
【答案】A
【详解】某化合物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,说明生成物中含有碳元素、硫元素、氢元素和氧元素,根据质量守恒定律,化学反应前后元素的种类不变,则说说明反应物中含有碳元素、硫元素、氢元素和氧元素,又因为该化合物是在空气中完全燃烧的,故生成物中的氧元素可能来自于氧气,因此可判断该化合物中一定含有碳元素、氢元素、硫元素,是否含有氧元素无法确定;故选A。
新课讲解
3、图表计算题
新课讲解
例3【2022湖南邵阳中考】把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是( )
A. x的值是25 B. 乙一定是催化剂
C. 甲和丁都是反应物 D. 反应中,甲与丙发生改变的质量比是14:33
【答案】A
【解析】A、x =7+10+28+37-14-10-33=25,故选项正确;
B、乙反应前后质量不变,可能为催化剂或没有参与反应,故选项错误;C、甲反应后质量增加,为生成物;丁质量减少,是反应物,故选项错误;D、反应中的甲、丙发生改变的质量比是:(14g-7g):(33g-28g)=7:5,故选项错误。故选A.。
新课讲解
新课讲解
4、微观模型图
例4【2022河北中考】2021年12月9日,中国空间站“天宫课堂”中航天员介绍,他们所需的部分水是由呼吸产生的二氧化碳通过化学反应生成的,实现了循环利用,如图是该反应的示意图。
下列说法正确的是( )
A. 乙和丁中氢元素的化合价相同
B. 参加反应的甲和乙分子个数比为1:3
C. 丁可电解生成供航天员呼吸的氧气
D. 参加反应的甲和生成的丙质量比为1:1
【答案】C
【解析】由微观反应示意图可知,该反应是由氢气和二氧化碳在一定条件下反应生成甲烷和水,化学方程式为
A、乙是氢气,其中氢元素的化合价为零,丁是甲烷,其中氢元素显+1价,故A错误; B、由化学方程式可知,参加反应的甲和乙分子个数比为1:4,故B错误; C、丁是水,水电解可生成供航天员呼吸的氧气,故C正确; D、由化学方程式可知,参加反应的甲和生成的丙质量比为44:16=11:4,故D错误。 故选:C。
新课讲解
新课讲解
5、化学方程式的考查
例5.【2022湖北黄石中考】下列化学方程式书写完全正确的是( )
新课讲解
例6(2021·四川达州市·中考真题)某补钙片的主要成分为CaCO3,每片钙片重0.5 g(假设钙片中其他成分不含钙元素,不溶于水且不与任何物质发生反应)。化学兴趣小组为测定钙片中钙元素的含量,进行了如图实验:
根据图示信息,完成下列各题:
(1)钙片中钙元素的质量分数为______。
(2)求恰好完全反应时所得溶液的溶质质量分数?(要求写出计算过程)
6、利用化学方程式的计算
新课讲解
例7.(2021·湖北宜昌市·中考真题)小华同学为测定某稀盐酸中溶
质的质量分数,在烧杯里放入一定质量的大理石,然后分次加入
该稀盐酸,充分反应后测得生成二氧化碳的质量如表所示(大理
石中的杂质与反应)。
(1)两次加稀盐酸后,生成二氧化碳的总质量是______g。
(2)该稀盐酸中溶质的质量分数。
新课讲解
加盐酸的次数 第一次 第二次
加盐酸的质量/g 25 25
生成二氧化碳的质量/g 2.2 1.1
新课讲解
例8.(2021·湖北荆州市·中考真题)工业制得的碳酸钾中常含有氯化钾。现取含氯化钾杂质的碳酸钾样品10g,其中氧元素的质量为2.4g,向该样品中加入一定量的稀盐酸,恰好完全反应时,得到47.8g溶液,请回答下列问题:
(1)写出上述反应过程中发生反应的化学方程式______。
(2)样品中氯化钾的质量为______g。
(3)求稀盐酸中溶质的质量分数(写出计算过程,计算结果保留一位小数)。
新课讲解
1.完成配套练习册单元检测题;
2.预习课题1 金刚石、石墨、C60
作业布置
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
