4.3 化学方程式书写与应用(第3课时)(课件18页)-2022-2023学年九年级化学上册同步精品课堂(沪教版)
文档属性
| 名称 | 4.3 化学方程式书写与应用(第3课时)(课件18页)-2022-2023学年九年级化学上册同步精品课堂(沪教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-21 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
第4章 认识化学变化
第3节 化学方程式的书写与应用
(第3课时)
【学习目标】
2. 认识定量研究对化学科学发展的意义。
1. 能利用化学方程式进行简单的计算。。
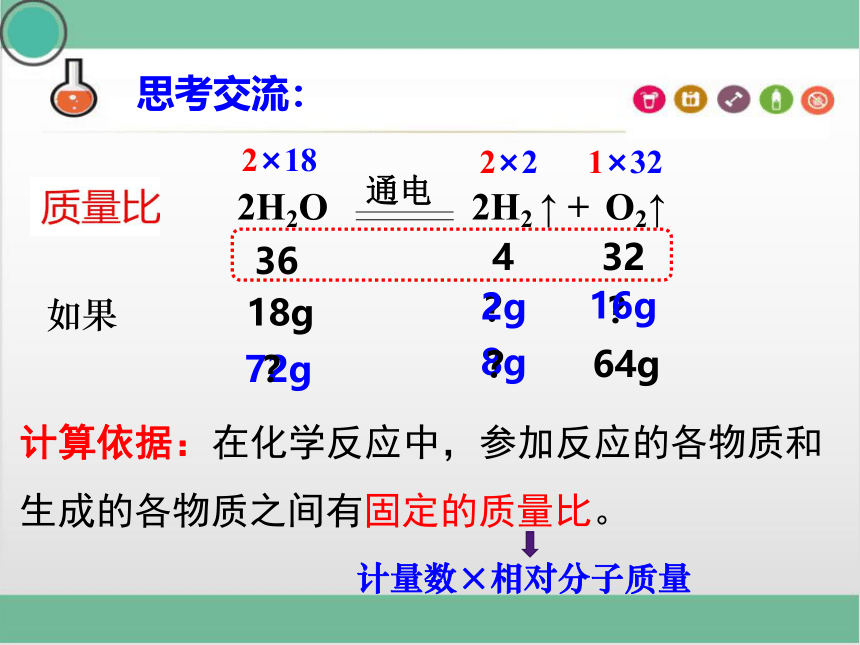
36
4
32
计算依据:在化学反应中,参加反应的各物质和生成的各物质之间有固定的质量比。
如果 18g
?
8g
?
16g
64g
?
72g
?
2g
计量数×相对分子质量
2×18
2×2
1×32
2H2O 2H2 ↑ + O2↑
通电
思考交流:
例1:18g水完全电解可产生多少克氢气?
=
(5)作答:
(1)设未知量:
① 解:设产生氢气质量为x
② 2H2O 2H2 ↑+ O2↑
通电
(2)写化学方程式:
(3)标出有关物质相对分子质量(不要忘乘化学计量数)及实际质量:
36 4
18g X
(4)列比例式,求解:
X=2g
④
⑤答:产生氢气质量为2g。
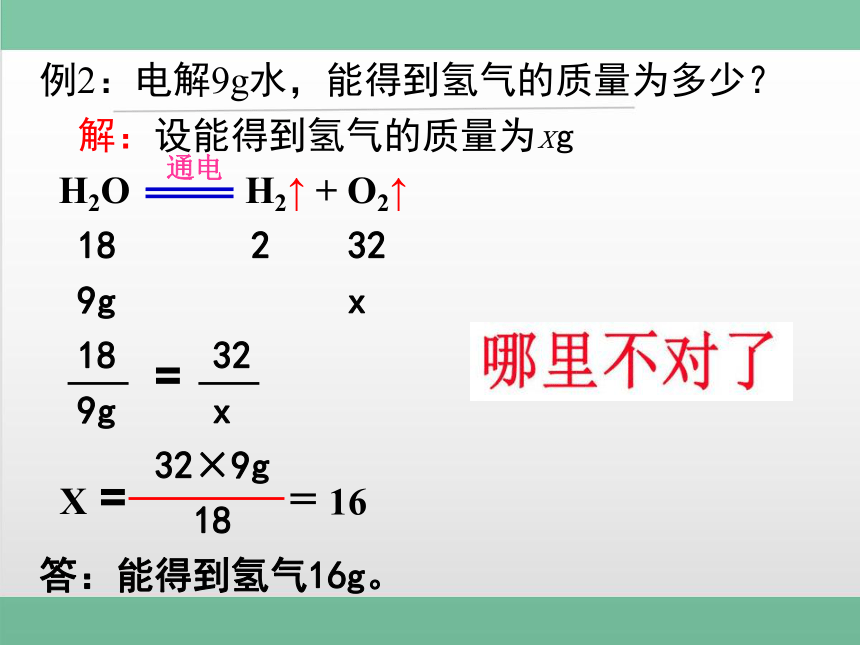
例2:电解9g水,能得到氢气的质量为多少?
解:设能得到氢气的质量为xg
H2O H2↑ + O2↑
18 2 32
9g x
18 32
9g x
32×9g
18
答:能得到氢气16g。
X =
= 16
通电
=
根据化学方程式计算步骤及格式:
1. 按题意设未知数
2. 写出题中反应的化学方程式
3. 找出反应物和生成物的质量关
系
4. 建立已知量和未知量的比例关
系
5. 计算 x,并作答
反应物和生成物的质量关系
相对质量=分子个数×相对分子质量
实际质量:数据要带单位
已知量和未知量的比例关系
相对质量
实际质量
上下相比
比值相等
1.两要领:
(1)步骤要完整;
(2)格式要规范。
2.两关键:
(1)书写化学方程式要准确;
(2)相对分子质量计算要准确。
化学方程式计算的要领和关键:
解:设能得到氢气的质量为x
2H2O 2H2↑ + O2↑
通电
36
4
9g
x
36
9g
4
x
=
x
=
1g
答:电解9g水,能得到氢气的质量为1g。
思路1:利用化学方程式来计算
例2:电解9g水,能得到氢气的质量为多少?
理由:水中的氢元素全部转化为氢气
解:9g水中所含氢元素的质量
1×2
1×2+16
×100%
=
= 1g
思路2:根据化学式的计算
9g×
答:电解9g水,能得到氢气的质量为1g。
例2:电解9g水,能得到氢气的质量为多少?
例3:加热完全分解31.6g高锰酸钾,得到氧气质量多少克?
2KMnO4 K2MnO4+MnO2+O2↑
△
316 32
31.6g x
316 32
31.6g x
=
x =3.2 g
解:设得到氧气质量为x
答:得到氧气质量为3.2g。
例4:加热31.6g高锰酸钾,当产生3.2g氧气时,固体剩余物的成分是( )
A. K2MnO4 和 MnO2
B. KMnO4、K2MnO4 和 MnO2
C. KMnO4 和 MnO2
D. KMnO4 和 K2MnO4
32
例5:足量的镁带在标准状况下与11.2L的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
体积不能直接代入方程式计算,代入量必须是质量
2Mg + O2 2MgO
点燃
32 80
11.6L x
例5:足量的镁带在标准状况下与11.2L的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
32 80
11.2L×1.43g/L x
解:设可以生成多少克氧化镁的质量为x
2Mg + O2 2MgO
点燃
32 80
11.2L×1.43g/L x
=
x = 40g
答:可以生成氧化镁的质量为40g。
例6:将氯酸钾、二氧化锰的混合物26g,加热至完全反应,得剩余固体的质量为16.4g。
求:(1)则生成的氧气质量为多少g
(2)原混合物中有多少g氯酸钾
26g
KCl
O2
MnO2
KClO3
MnO2
剩余固体16.4g
26g-16.4g=9.6g
反应前
反应后
=
26g
16.4g
26g
26g
代入方程式的量是纯物质质量,不能是混合物质量
2KClO3
2KCl + 3O2↑
MnO2
解:
26g-16.4g = 9.6g
O
2
m
=
(1)
(2)
设原混合物中氯酸钾质量为x
二氧化锰质量
26g-24.5g=1.5g
例6:将氯酸钾、二氧化锰的混合物26g,加热至完全反应,得剩余固体的质量为16.4g。
求:(1)则生成的氧气质量为多少g
(2)原混合物中有多少g氯酸钾
2KClO3
2KCl + 3O2↑
MnO2
245 96
x 9.6g
245 96
x 9.6g
=
x = 24.5 g
答:原混合物中氯酸钾的质量为24.5 g。
(1) 各代入量均是纯净物的质量;
(2) 计算过程中单位要统一;
(3) 注意“充分反应”“恰好完全反应”
“适量”等词。
化学方程式计算的要领和关键:
【中考链接】
1.(2022·山东菏泽)我国古代将炉甘石(主要成分ZnCO3)和木炭粉混合后加热到约800℃,可得到锌。主要发生的化学反应:
某同学用100t含ZnCO398%的炉甘石,计算生成ZnO质量的过程如下,请判断该计算过程是否正确?
答:可得到氧化锌的质量是64.8t。
② C+ZnO
2ZnO + CO2↑
高温
① ZnCO3
ZnO + CO2↑
高温
解:设可得到氧化锌的质量为x
【中考链接】
2.(2022·湖南衡阳)以下是某同学解答一道计算题的过程:
题目:将氯酸钾和二氧化锰的混合物共27.5g放入试管中加热,反应中剩余固体质量与反应时间的关系如图所示。完全反应后,生成氯化钾的质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成KCl的质量为x
x=16.7g
答:生成KC1的质量为16.7g。
第4章 认识化学变化
第3节 化学方程式的书写与应用
(第3课时)
【学习目标】
2. 认识定量研究对化学科学发展的意义。
1. 能利用化学方程式进行简单的计算。。
36
4
32
计算依据:在化学反应中,参加反应的各物质和生成的各物质之间有固定的质量比。
如果 18g
?
8g
?
16g
64g
?
72g
?
2g
计量数×相对分子质量
2×18
2×2
1×32
2H2O 2H2 ↑ + O2↑
通电
思考交流:
例1:18g水完全电解可产生多少克氢气?
=
(5)作答:
(1)设未知量:
① 解:设产生氢气质量为x
② 2H2O 2H2 ↑+ O2↑
通电
(2)写化学方程式:
(3)标出有关物质相对分子质量(不要忘乘化学计量数)及实际质量:
36 4
18g X
(4)列比例式,求解:
X=2g
④
⑤答:产生氢气质量为2g。
例2:电解9g水,能得到氢气的质量为多少?
解:设能得到氢气的质量为xg
H2O H2↑ + O2↑
18 2 32
9g x
18 32
9g x
32×9g
18
答:能得到氢气16g。
X =
= 16
通电
=
根据化学方程式计算步骤及格式:
1. 按题意设未知数
2. 写出题中反应的化学方程式
3. 找出反应物和生成物的质量关
系
4. 建立已知量和未知量的比例关
系
5. 计算 x,并作答
反应物和生成物的质量关系
相对质量=分子个数×相对分子质量
实际质量:数据要带单位
已知量和未知量的比例关系
相对质量
实际质量
上下相比
比值相等
1.两要领:
(1)步骤要完整;
(2)格式要规范。
2.两关键:
(1)书写化学方程式要准确;
(2)相对分子质量计算要准确。
化学方程式计算的要领和关键:
解:设能得到氢气的质量为x
2H2O 2H2↑ + O2↑
通电
36
4
9g
x
36
9g
4
x
=
x
=
1g
答:电解9g水,能得到氢气的质量为1g。
思路1:利用化学方程式来计算
例2:电解9g水,能得到氢气的质量为多少?
理由:水中的氢元素全部转化为氢气
解:9g水中所含氢元素的质量
1×2
1×2+16
×100%
=
= 1g
思路2:根据化学式的计算
9g×
答:电解9g水,能得到氢气的质量为1g。
例2:电解9g水,能得到氢气的质量为多少?
例3:加热完全分解31.6g高锰酸钾,得到氧气质量多少克?
2KMnO4 K2MnO4+MnO2+O2↑
△
316 32
31.6g x
316 32
31.6g x
=
x =3.2 g
解:设得到氧气质量为x
答:得到氧气质量为3.2g。
例4:加热31.6g高锰酸钾,当产生3.2g氧气时,固体剩余物的成分是( )
A. K2MnO4 和 MnO2
B. KMnO4、K2MnO4 和 MnO2
C. KMnO4 和 MnO2
D. KMnO4 和 K2MnO4
32
例5:足量的镁带在标准状况下与11.2L的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
体积不能直接代入方程式计算,代入量必须是质量
2Mg + O2 2MgO
点燃
32 80
11.6L x
例5:足量的镁带在标准状况下与11.2L的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
32 80
11.2L×1.43g/L x
解:设可以生成多少克氧化镁的质量为x
2Mg + O2 2MgO
点燃
32 80
11.2L×1.43g/L x
=
x = 40g
答:可以生成氧化镁的质量为40g。
例6:将氯酸钾、二氧化锰的混合物26g,加热至完全反应,得剩余固体的质量为16.4g。
求:(1)则生成的氧气质量为多少g
(2)原混合物中有多少g氯酸钾
26g
KCl
O2
MnO2
KClO3
MnO2
剩余固体16.4g
26g-16.4g=9.6g
反应前
反应后
=
26g
16.4g
26g
26g
代入方程式的量是纯物质质量,不能是混合物质量
2KClO3
2KCl + 3O2↑
MnO2
解:
26g-16.4g = 9.6g
O
2
m
=
(1)
(2)
设原混合物中氯酸钾质量为x
二氧化锰质量
26g-24.5g=1.5g
例6:将氯酸钾、二氧化锰的混合物26g,加热至完全反应,得剩余固体的质量为16.4g。
求:(1)则生成的氧气质量为多少g
(2)原混合物中有多少g氯酸钾
2KClO3
2KCl + 3O2↑
MnO2
245 96
x 9.6g
245 96
x 9.6g
=
x = 24.5 g
答:原混合物中氯酸钾的质量为24.5 g。
(1) 各代入量均是纯净物的质量;
(2) 计算过程中单位要统一;
(3) 注意“充分反应”“恰好完全反应”
“适量”等词。
化学方程式计算的要领和关键:
【中考链接】
1.(2022·山东菏泽)我国古代将炉甘石(主要成分ZnCO3)和木炭粉混合后加热到约800℃,可得到锌。主要发生的化学反应:
某同学用100t含ZnCO398%的炉甘石,计算生成ZnO质量的过程如下,请判断该计算过程是否正确?
答:可得到氧化锌的质量是64.8t。
② C+ZnO
2ZnO + CO2↑
高温
① ZnCO3
ZnO + CO2↑
高温
解:设可得到氧化锌的质量为x
【中考链接】
2.(2022·湖南衡阳)以下是某同学解答一道计算题的过程:
题目:将氯酸钾和二氧化锰的混合物共27.5g放入试管中加热,反应中剩余固体质量与反应时间的关系如图所示。完全反应后,生成氯化钾的质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成KCl的质量为x
x=16.7g
答:生成KC1的质量为16.7g。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
