浙教版2022-2023学年上学期九年级科学精讲精练(七):物质的转化【word,含答案】
文档属性
| 名称 | 浙教版2022-2023学年上学期九年级科学精讲精练(七):物质的转化【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 595.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-10-22 19:04:53 | ||
图片预览

文档简介
一、金属的冶炼
常见还原剂:C、CO、H2
C+2CuO2Cu+CO2↑ H2+CuOCu+H2O 3CO+Fe2O32Fe+3CO2
C:黑色固体逐渐变为红色,澄清石灰水变浑浊
H2:试管内黑色粉末变红色,试管口出现水珠
步骤:实验开始时先通入H2, 一段时间后再加热(防止氢气与空气混合加热时试管爆裂);
实验结束后,先熄灭酒精灯,继续通入H2, 直到试管冷却为止(防止灼热的铜被空气中的氧气氧化成氧化铜)
提示:试管口要略低于试管底,防止反应生成的水倒流。导管贴试管上壁伸入试管底部
CO:最好在通风橱中进行。实验时应该先通一会CO,以排除试管中的空气,防止CO
与空气混合加热时引起爆炸。多余的CO不能直接排到空气中,应对着火焰烧掉(实验装置末端设置点燃的酒精灯燃烧尾气)
物质转化规律
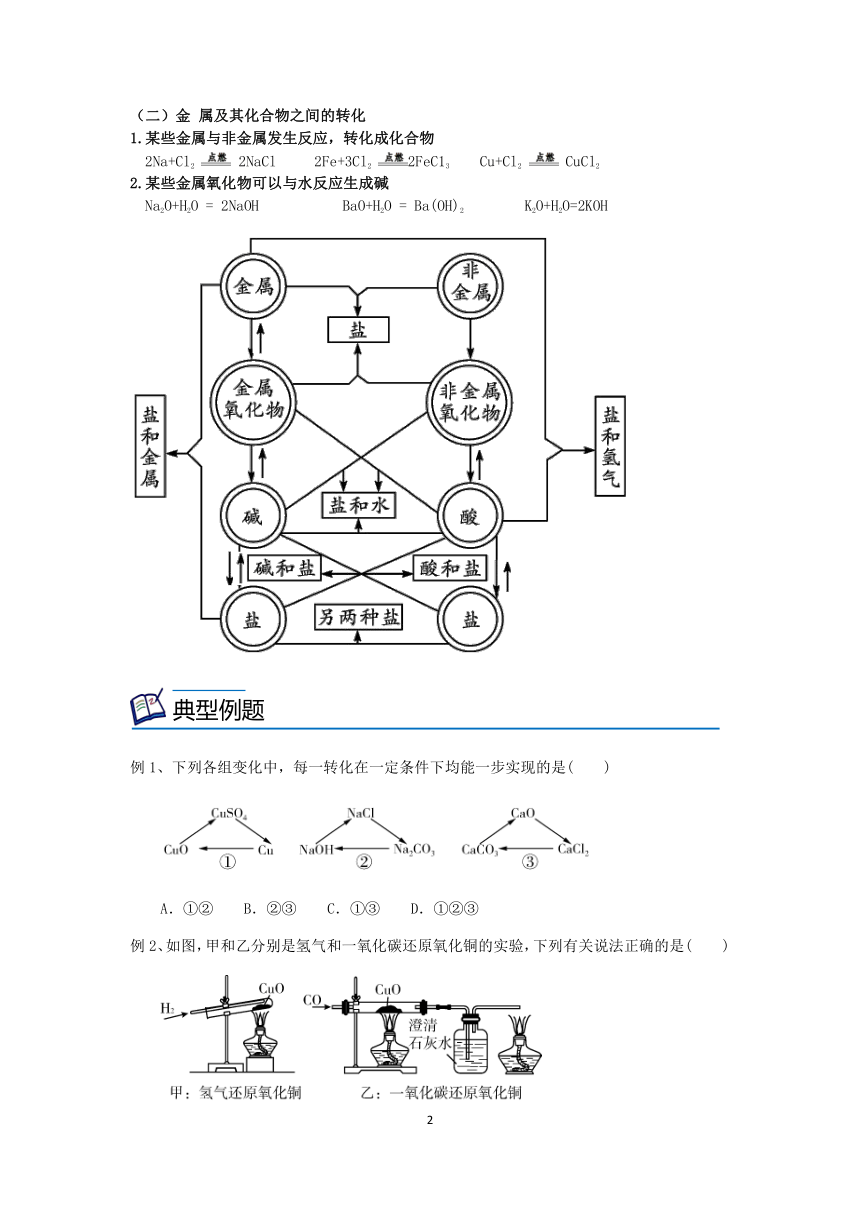
(一)非金属及其化合物之间的转化
1.某些非金属可以转化为非金属氧化物
4P+5O22P2O5 C+O2 CO2 2H2+O2 2H2O
2.非金属氧化物可以转化生成酸,不稳定的酸受热分解后又重新生成非金属氧化物
SO2+H2O = H2SO3 SO3+H2O = H2SO4 CO2+H2O==H2CO3 H2CO3CO2↑+ H2O
3.非金属与其他化合物的转化
非金属 → 非金属氧化物 → 酸 → 盐 非金属 → 非金属氧化物 → 盐+水
(二)金 属及其化合物之间的转化
1.某些金属与非金属发生反应,转化成化合物
2Na+Cl2 2NaCl 2Fe+3Cl2 2FeC13 Cu+Cl2 CuCl2
2.某些金属氧化物可以与水反应生成碱
Na2O+H2O = 2NaOH BaO+H2O = Ba(OH)2 K2O+H2O=2KOH
例1、下列各组变化中,每一转化在一定条件下均能一步实现的是( )
A.①② B.②③ C.①③ D.①②③
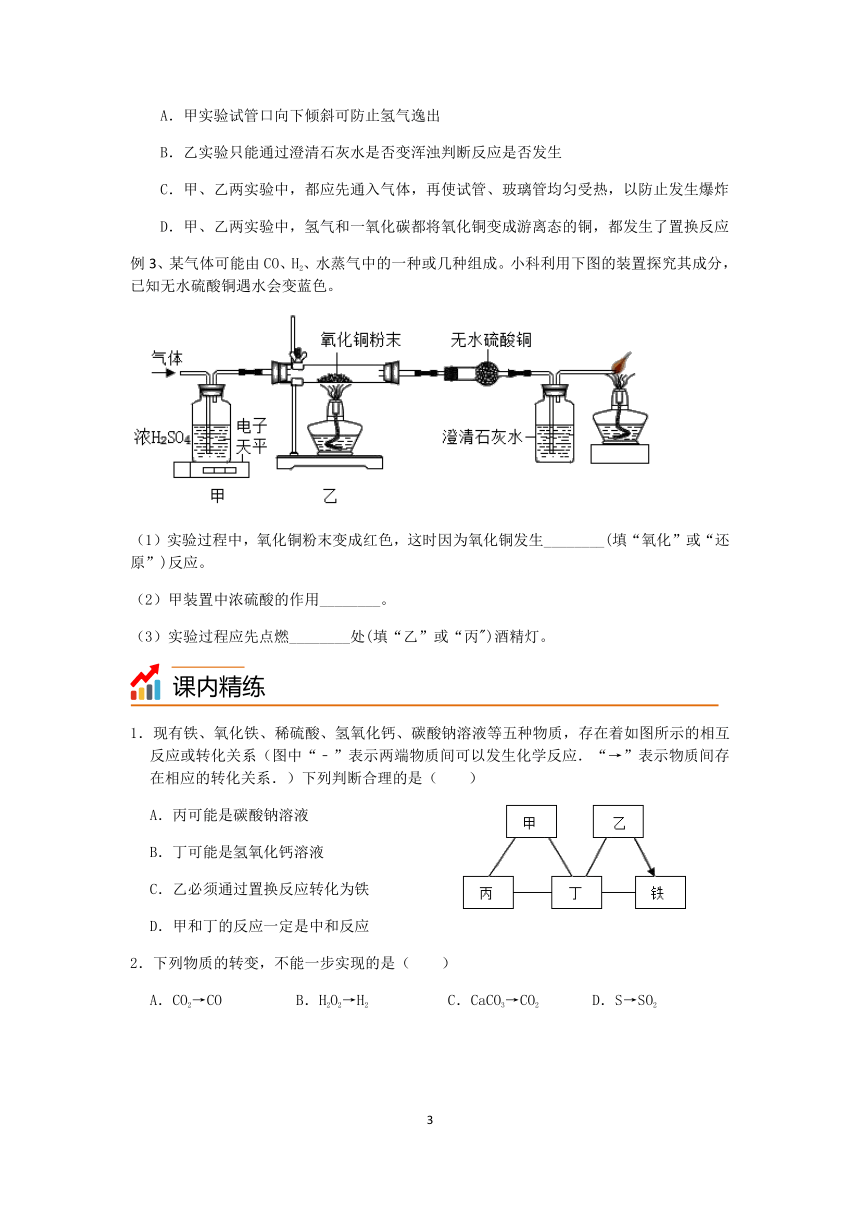
例2、如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验试管口向下倾斜可防止氢气逸出
B.乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C.甲、乙两实验中,都应先通入气体,再使试管、玻璃管均匀受热,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
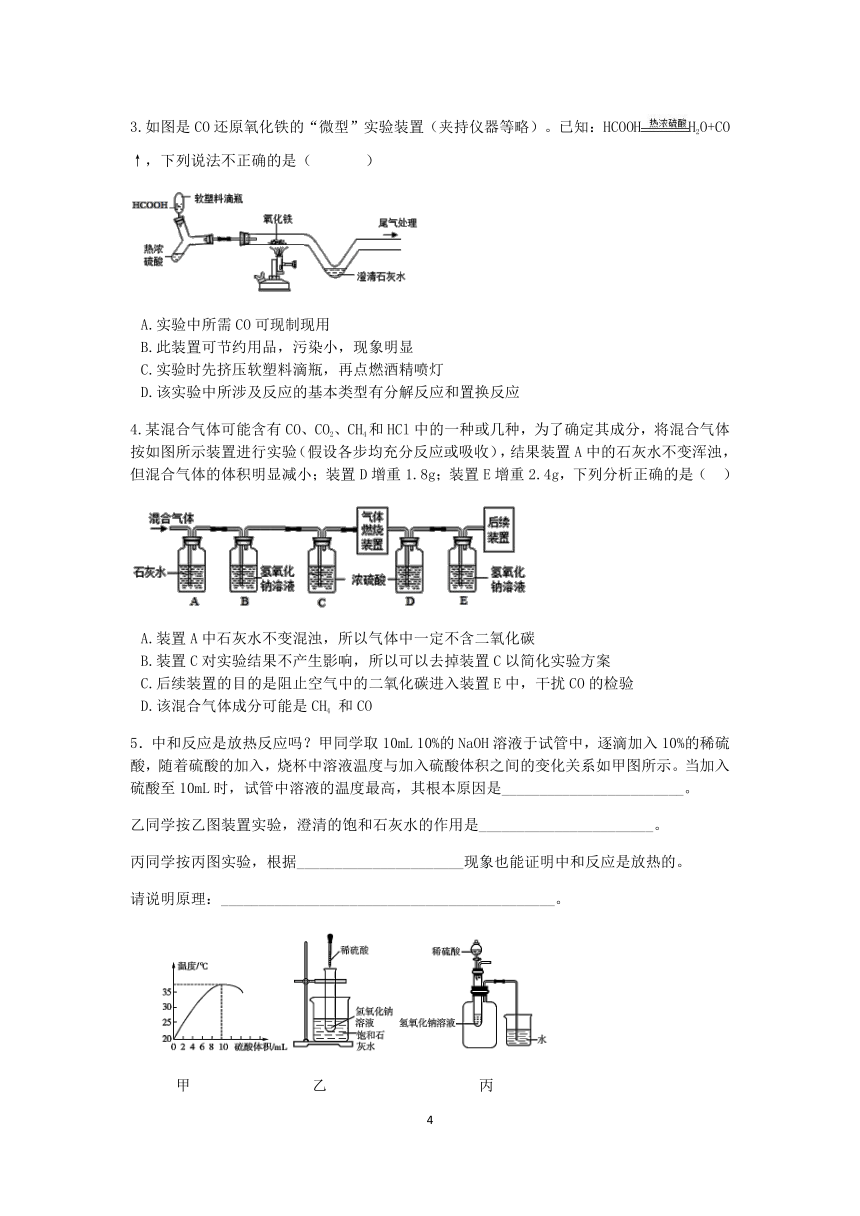
例3、某气体可能由CO、H2、水蒸气中的一种或几种组成。小科利用下图的装置探究其成分,已知无水硫酸铜遇水会变蓝色。
(1)实验过程中,氧化铜粉末变成红色,这时因为氧化铜发生________(填“氧化”或“还原”)反应。
(2)甲装置中浓硫酸的作用________。
(3)实验过程应先点燃________处(填“乙”或“丙")酒精灯。
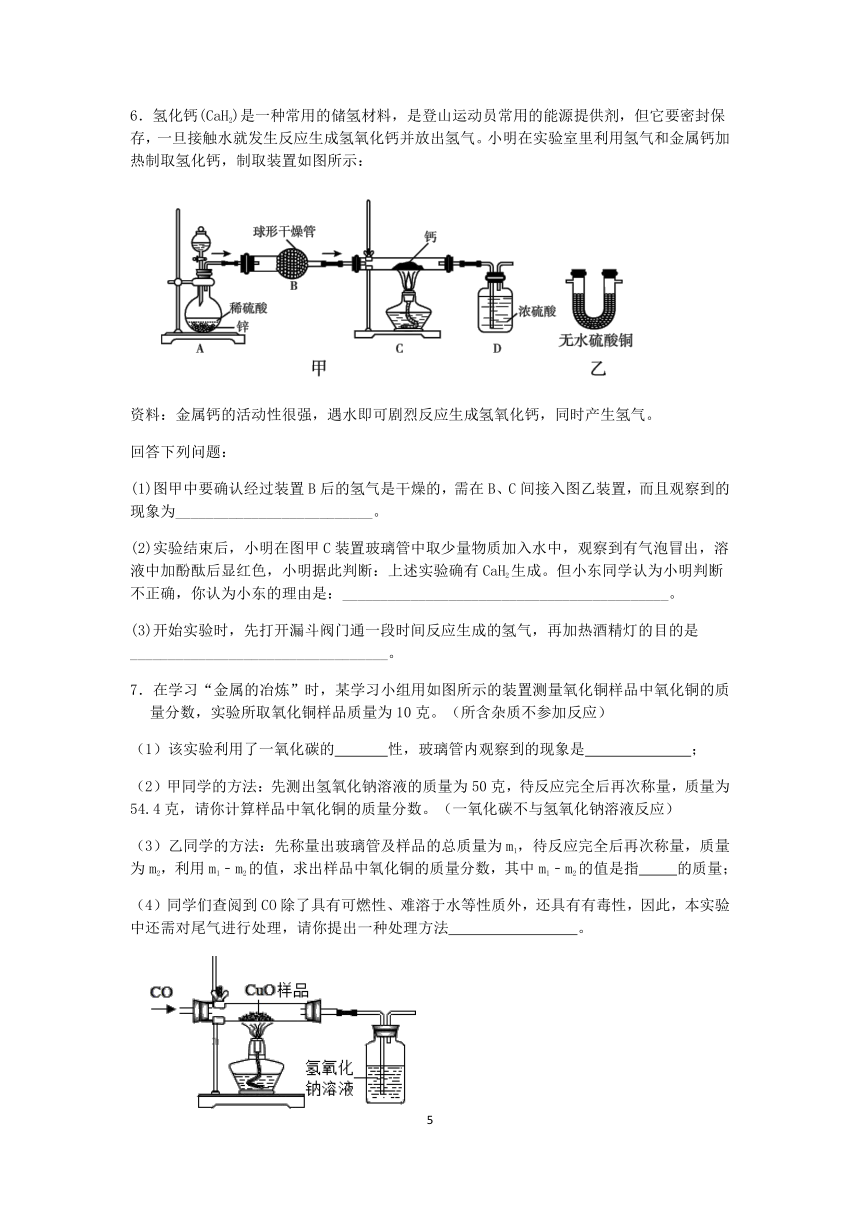
1.现有铁、氧化铁、稀硫酸、氢氧化钙、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“﹣”表示两端物质间可以发生化学反应.“→”表示物质间存在相应的转化关系.)下列判断合理的是( )
A.丙可能是碳酸钠溶液
B.丁可能是氢氧化钙溶液
C.乙必须通过置换反应转化为铁
D.甲和丁的反应一定是中和反应
2.下列物质的转变,不能一步实现的是( )
A.CO2→CO B.H2O2→H2 C.CaCO3→CO2 D.S→SO2
3.如图是CO还原氧化铁的“微型”实验装置(夹持仪器等略)。已知:HCOOHH2O+CO↑,下列说法不正确的是( )
A.实验中所需CO可现制现用
B.此装置可节约用品,污染小,现象明显
C.实验时先挤压软塑料滴瓶,再点燃酒精喷灯
D.该实验中所涉及反应的基本类型有分解反应和置换反应
4.某混合气体可能含有CO、CO2、CH4和HCl中的一种或几种,为了确定其成分,将混合气体按如图所示装置进行实验(假设各步均充分反应或吸收),结果装置A中的石灰水不变浑浊,但混合气体的体积明显减小;装置D增重1.8g;装置E增重2.4g,下列分析正确的是( )
A.装置A中石灰水不变混浊,所以气体中一定不含二氧化碳
B.装置C对实验结果不产生影响,所以可以去掉装置C以简化实验方案
C.后续装置的目的是阻止空气中的二氧化碳进入装置E中,干扰CO的检验
D.该混合气体成分可能是CH4 和CO
5.中和反应是放热反应吗?甲同学取10mL 10%的NaOH溶液于试管中,逐滴加入10%的稀硫酸,随着硫酸的加入,烧杯中溶液温度与加入硫酸体积之间的变化关系如甲图所示。当加入硫酸至10mL时,试管中溶液的温度最高,其根本原因是________________________。
乙同学按乙图装置实验,澄清的饱和石灰水的作用是_______________________。
丙同学按丙图实验,根据______________________现象也能证明中和反应是放热的。
请说明原理:____________________________________________。
甲 乙 丙
6.氢化钙(CaH2)是一种常用的储氢材料,是登山运动员常用的能源提供剂,但它要密封保存,一旦接触水就发生反应生成氢氧化钙并放出氢气。小明在实验室里利用氢气和金属钙加热制取氢化钙,制取装置如图所示:
资料:金属钙的活动性很强,遇水即可剧烈反应生成氢氧化钙,同时产生氢气。
回答下列问题:
(1)图甲中要确认经过装置B后的氢气是干燥的,需在B、C间接入图乙装置,而且观察到的现象为__________________________。
(2)实验结束后,小明在图甲C装置玻璃管中取少量物质加入水中,观察到有气泡冒出,溶液中加酚酞后显红色,小明据此判断:上述实验确有CaH2生成。但小东同学认为小明判断不正确,你认为小东的理由是:___________________________________________。
(3)开始实验时,先打开漏斗阀门通一段时间反应生成的氢气,再加热酒精灯的目的是__________________________________。
7.在学习“金属的冶炼”时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克。(所含杂质不参加反应)
(1)该实验利用了一氧化碳的 性,玻璃管内观察到的现象是 ;
(2)甲同学的方法:先测出氢氧化钠溶液的质量为50克,待反应完全后再次称量,质量为54.4克,请你计算样品中氧化铜的质量分数。(一氧化碳不与氢氧化钠溶液反应)
(3)乙同学的方法:先称量出玻璃管及样品的总质量为m1,待反应完全后再次称量,质量为m2,利用m1﹣m2的值,求出样品中氧化铜的质量分数,其中m1﹣m2的值是指 的质量;
(4)同学们查阅到CO除了具有可燃性、难溶于水等性质外,还具有有毒性,因此,本实验中还需对尾气进行处理,请你提出一种处理方法 。
1.下列转化能一步完成的是( )
①CO2→CO②HNO3→HCl ③Cu(OH)2→CuO④Ca(OH)2→NaOH ⑤Cl2→NaCl
A.①③④⑤ B.②③④⑤ C.①②④ D.②③④
2.如图为一氧化碳还原氧化铜的实验装置。下列说法正确的是( )
A.实验中可观察到玻璃管中的黑色固体变红色
B.该实验说明一氧化碳具有还原性,没有可燃性
C.该实验只能通过澄清石灰水是否变浑浊来判断反应是否发生
D.为防止发生爆炸,实验前应先加热玻璃管,再通入CO气体
3.“碳中和”是指一定时间内CO2的排放量与吸收量基本相当。CO2的捕集、利用是实现“碳中和”的重要途径我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。CO2与H2在一定条件下转化为CH4(反应过程如图所示,虚线处部分中间产物略去),可实现CO2的再利用。以下说法合理的是( )
A.二氧化碳会造成空气严重污染
B.MgO在上述转化中质量不变
C.上述反应中的产物只有CH4
D.参加该反应的CO2与H2分子个数之比是1:2
4.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳的质量比为40∶7
D.将尾气点燃或收集,可防止一氧化碳污染空气
5.某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2),查阅资料可知Mg、Mg3N2能发生如下反应:
①2Mg+O22MgO ②3Mg+N2Mg3N2 ③2Mg+CO22MgO+C
④Mg+H2OMgO+H2↑ ⑤Mg3N2+6H2O===3Mg(OH)2 ↓+2NH3↑
(NH3能使湿润的红色石蕊试纸变蓝)
(1)制取氮化镁的实验设计思路:用镁和氮气反应。反应之前必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2。装置B灼烧铁粉为了除去空气中的___________。
(2)气流流经装置的顺序是D→C→_____________(选填“B→A”或“A→B”)。
(3)通入空气后,应先点燃B装置的酒精灯,如果同时点燃A、B装置的酒精灯,对实验结果可能产生影响是_______________________________。
(4)设计一个实验,验证A中产物是氮化镁,方案
________________________________________(写出操作和现象)。
6.某混合气体可能是 CO、CO2、H2O、H2 中的一种或几种,为确定成分,将 8 克混合气体通入如图装置中(假设每步吸收和反应均完全)。
实验测定的部分实验装置数据如下表:
装置 A B C F
实验前装置和药品总质量/g 100.0 100.0 100.0 100.0
实验后装置和药品总质量/g 100.8 104.2 100.2 104.4
则(1)混合气体中含有的气体成分为________;
(2)E、F 中的实验现象分别是________。
答案及解析
例1、C
【解析】①铜在空气中加热生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜和水,铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,每一转化在一定条件下均能一步实现。②氢氧化钠与稀盐酸反应生成氯化钠和水,氯化钠转化为碳酸钠,假设能实现,生成物应是碳酸钠和氯化银沉淀,但碳酸银难溶于水,不能与氯化钠发生复分解反应,这一转化在一定条件下不能一步实现。③碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙与稀盐酸反应生成氯化钙和水,氯化钙与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,每一转化在一定条件下均能一步实现。故①和③每一转化在一定条件下均能一步实现。
例2、C
【解析】A.氢气还原氧化铜生成水,为了防止冷水倒流回试管底部将试管炸裂,所以试管口应略向下倾斜,故错误;B.乙实验中还会观察到黑色的粉末慢慢变成红色,来判断反应的发生,故错误;C.两实验都先通入一段时间的气体,以排净装置内的空气,再进行加热,以免发生爆炸,故正确;D.一氧化碳与氧化铜在加热的条件下反应生成铜和二氧化碳,反应物是两种化合物,不属于置换反应,故错误。
例3、(1)还原 (2)吸收和检验水 (3)丙
【解析】(1)氧化铜粉末为黑色,变成红色,说明发生了还原反应,生成了铜;
(2)浓硫酸具有吸水性,甲装置中浓硫酸作用是吸收和检验水;
(3)因一氧化碳或氢气还原氧化铜要先通入气体排除装置内空气,而一氧化碳有毒,不能排放到空气中,所以实验时要先点燃丙处酒精灯;
1.A
解:铁、氧化铁会与稀硫酸反应,氧化铁会转化成铁,因此乙是氧化铁,丁是稀硫酸;硫酸会与碳酸钠和氢氧化钙反应,碳酸钠和氢氧化钙可以相互反应,因此甲和丙是氢氧化钙、碳酸钠中的一种,因此:
A、根据推断,丙可能是碳酸钠,故判断合理;
B、丁是稀硫酸,故判断错误;
C、氧化铁可以和一氧化碳反应产生铁,不是置换反应,故判断错误;
D、甲和丁的反应可以是稀硫酸和氢氧化钙或碳酸钠的反应,因此不一定是中和反应,故判断错误;
故选:A。
2.B
【解答】解:A、二氧化碳与碳在高温下反应生成一氧化碳,能一步实现,故选项错误。
B、过氧化氢分解生成水和氧气,不能一步实现,故选项正确。
C、碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,能一步实现,故选项错误。
D、硫在氧气中燃烧生成二氧化硫,能一步实现,故选项错误。
故选:B。
3.D
【解析】A、该实验中利用甲酸与浓硫酸制取CO,所需CO可现制现用 ,不符合题意;
B、此装置为微型装置,可节约用品,污染小,现象明显,不符合题意;
C、实验时要先制取CO,排除装置内空气,所以先挤压软塑料滴瓶,使药品接触产生CO,通入CO后再点燃酒精喷灯 ,不符合题意;
D、该实验中没有涉及置换反应 ,符合题意;
4.C
【解析】A.如果混合气体中含有HCl,那么其中二氧化碳就能使装置A中澄清的石灰水不变浑浊,故A错误;
B.C装置中的浓硫酸对从B装置中出来气体进行干燥,防止干扰其他气体的检测,故B错误;
C.后续装置的目的是阻止空气中的二氧化碳进入装置E中,干扰CO的检验,故C正确;
D.装置D增重1.8g,是生成水的质量;装置E增2.4g,生成二氧化碳的质量为2.4g。
设生成1.8g水,同时生成二氧化碳质量为x
CH4+2O2 CO2+2H2O
44 36
x 1.8g
解得:x=2.2g<2.4g;
因此多余的二氧化碳肯定是一氧化碳燃烧生成的,
则该混合气体一定含有CO和CH4,故D错误。
5.此时二者恰好完全反应,放出的热量最多 证明氢氧化钠与硫酸反应能放热 烧杯内的导管口有气泡产生 反应若放出热量,则会使烧瓶中的气体受热而膨胀,从而烧杯内的导管口有气泡产生
【解析】(1)据图可以看出,当加入盐酸至10mL时烧杯中溶液的温度最高,说明此时二者恰好完全反应,放出的热量最多;(2)氢氧化钙的溶解度随温度的升高而降低,饱和石灰水变浑浊,说明氢氧化钠与盐酸反应能放出热量;(3)反应若放出热量,则会使烧瓶中的气体受热而膨胀,所以若观察到烧杯内的导管口有气泡产生,则说明中和反应放热。
6.(1)无水硫酸铜不变色 (2)钙也能与水反应生成氢氧化钙和氢气,既有气泡产生,又能使酚酞试液变红 (3)除去玻璃管中的空气,防止发生爆炸
【解析】(1)无水硫酸铜遇到水变为蓝色的五水硫酸铜,要确认经过装置B后的氢气是干燥的,只要观察到无水硫酸铜的颜色没有变化即可;(2)钙也能与水反应生成氢氧化钙和氢气,既有气泡产生,又能使酚酞试液变红.(3)根据装置特点和氢化钙与水反应生成氢气,氢气和氧气的混合气点燃,可能发生爆炸。
7.解:(1)一氧化碳具有还原性,可以将金属氧化物还原成金属,一氧化碳和氧化铜加热生成氧化铜是二氧化碳,所以玻璃管内观察到的现象是:黑色粉末变成红色;
(2)生成二氧化碳的质量为:54.4g﹣50g=4.4g,
设样品中氧化铜的质量为x,
CuO+COCO2+Cu
80 44
x 4.4g
x=8g
100%=80%;
(3)化学反应前后原子个数不变,所以先称量出玻璃管及样品的总质量为m1,待反应完全后再次称量,质量为m2,利用m1﹣m2的值,求出样品中氧化铜的质量分数,其中m1﹣m2的值是指氧元素的质量;
(4)一氧化碳具有可燃性,可以将一氧化碳进行点燃处理。
故答案为:(1)还原性,黑色粉末变成红色;(2)80%;(3)氧元素;(4)将尾气点燃。
1.A
【解答】解:①高温条件下,二氧化碳和碳反应生成一氧化碳,该选项能够一步实现;
②硝酸不能通过一步反应生成盐酸,该选项不能一步实现;
③加热条件下,氢氧化铜分解生成氧化铜和水,该选项能够一步实现;
④氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,该选项能够一步实现;
⑤钠在氯气中燃烧生成氯化钠,该选项能够一步实现。
故选:A。
2.A
【解析】根据一氧化碳与氧化铜反应生成铜和二氧化碳,以及操作步骤分析,CO的实验用点燃方法处理尾气,可证明物质的可燃性。
A、CO与氧化铜反应生成铜,玻璃管内黑色固体变成红色,符合题意;
B、该实验尾气点燃处理,可说明一氧化碳的可燃性,不符合题意;
C、该实验也可通过玻璃内固体颜色变化证明反应发生,不符合题意;
D、为防止发生爆炸,应先通入纯净CO,再加热玻璃管,不符合题意;
3.B
【解答】解:A、二氧化碳不是空气污染物,A说法错误;
B、在反应过程中,氧化镁的作用是催化作用,故质量和化学性质均未改变,B说法正确;
C、由流程图可知,该反应中,除CH4外另一种生成物为H2O,C说法错误;
D、根据流程图可以知道,该反应的化学方程式为:CO2+4H2CH4+2H2O,所得CO2与H2分子的分子个数之比为1:4,D说法错误;
故选:B。
4.D
【解析】A、实验开始先通入一氧化碳,排出装置内的空气后,再点燃酒精喷灯加热玻璃管中的氧化铁,先通入一氧化碳后加热的原因是排尽玻璃管中的空气,防止发生爆炸,故选项说法错误。B、一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,实验进行一段时间后,玻璃管A中出现的现象是红棕色粉末逐渐变黑,故选项说法错误。C、反应的化学方程式为:Fe2O3+3CO2Fe+3CO2,参加反应的氧化铁和一氧化碳质量比为160:(28×3)=40:21,故选项说法错误。D、一氧化碳有毒,直接排放到空气中会污染环境,本实验的缺陷是没有设计尾气处理装置,可将玻璃管改成尖嘴点燃或用气球收集,故选项说法正确。
5.(1)氧气 (2)B→A (3)制取的氮化镁中会混有氧化镁 (4)将产物取少量置于试管中,加入适量水,将湿润的红色石蕊试纸置于试管口,能够看到湿润的红色石蕊试纸变蓝
【解析】(1)根据题中信息可知Mg在空气中点燃可以和O2、CO2、H2O反应,所以镁和氮气反应必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2,浓硫酸作用是除去水蒸气,浓氢氧化钠是除去空气中二氧化碳,灼热的铁粉为了除去空气中氧气;
(2)除去水蒸气选用浓硫酸,除去氧气用能与空气中氧气反应的物质即可,除去二氧化碳用氢氧化钙溶液吸收,但要先除去二氧化碳再干燥然后除去氧气,故答案为:D→C→B→A;
(3)通气后,应向点燃B装置的酒精灯,如果同时点燃A、B装置的酒精灯,A没有排完空气就加热会让空气中的氧气、氮气和水与镁反应生成其他物质,制得的氮化镁不纯;
(4)依据氮化镁和水反应生成氨气,方程式为 Mg3N2+6H2O=3Mg(OH)2+2NH3↑,将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
6.(1)CO、CO2、H2O、H2 (2)E 中白色粉末变为蓝色、F 中溶液变浑浊
【解析】将混合气体通过A中硫酸铜粉末,A装置的质量增加,说明它吸收了水蒸气,即混合气体肯定含有H2O;再通过B中氢氧化钠溶液,B的质量增加,说明它吸收了二氧化碳,即混合气体中肯定含有CO2;将混合气体通过浓硫酸,去除其中剩余的水蒸气,与D中的氧化铜反应后,得到的气体通入E中的硫酸铜粉末,因为E的质量增大,说明有水生成,因此混合气体中肯定含有H2;再将得到的气体通过F中的Ba(OH)2溶液,F质量增大,说明有二氧化碳产生,即混合气体肯定含有CO,据此解答即可。
【解答】(1)混合气体中含有的气体成分为:CO、CO2、H2O、H2;
(2)E中的白色硫酸铜粉末吸收水后变成蓝色,F中的Ba(OH)2溶液吸收二氧化碳后生成碳酸钡白色沉淀,使溶液变浑浊。
2022-2023学年上学期浙教版科学九年级“精讲精练”讲义(七)
物质的转化
知识精讲
典型例题
课内精练
课后提分
典型例题
课内精练
课后提分
常见还原剂:C、CO、H2
C+2CuO2Cu+CO2↑ H2+CuOCu+H2O 3CO+Fe2O32Fe+3CO2
C:黑色固体逐渐变为红色,澄清石灰水变浑浊
H2:试管内黑色粉末变红色,试管口出现水珠
步骤:实验开始时先通入H2, 一段时间后再加热(防止氢气与空气混合加热时试管爆裂);
实验结束后,先熄灭酒精灯,继续通入H2, 直到试管冷却为止(防止灼热的铜被空气中的氧气氧化成氧化铜)
提示:试管口要略低于试管底,防止反应生成的水倒流。导管贴试管上壁伸入试管底部
CO:最好在通风橱中进行。实验时应该先通一会CO,以排除试管中的空气,防止CO
与空气混合加热时引起爆炸。多余的CO不能直接排到空气中,应对着火焰烧掉(实验装置末端设置点燃的酒精灯燃烧尾气)
物质转化规律
(一)非金属及其化合物之间的转化
1.某些非金属可以转化为非金属氧化物
4P+5O22P2O5 C+O2 CO2 2H2+O2 2H2O
2.非金属氧化物可以转化生成酸,不稳定的酸受热分解后又重新生成非金属氧化物
SO2+H2O = H2SO3 SO3+H2O = H2SO4 CO2+H2O==H2CO3 H2CO3CO2↑+ H2O
3.非金属与其他化合物的转化
非金属 → 非金属氧化物 → 酸 → 盐 非金属 → 非金属氧化物 → 盐+水
(二)金 属及其化合物之间的转化
1.某些金属与非金属发生反应,转化成化合物
2Na+Cl2 2NaCl 2Fe+3Cl2 2FeC13 Cu+Cl2 CuCl2
2.某些金属氧化物可以与水反应生成碱
Na2O+H2O = 2NaOH BaO+H2O = Ba(OH)2 K2O+H2O=2KOH
例1、下列各组变化中,每一转化在一定条件下均能一步实现的是( )
A.①② B.②③ C.①③ D.①②③
例2、如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验试管口向下倾斜可防止氢气逸出
B.乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C.甲、乙两实验中,都应先通入气体,再使试管、玻璃管均匀受热,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
例3、某气体可能由CO、H2、水蒸气中的一种或几种组成。小科利用下图的装置探究其成分,已知无水硫酸铜遇水会变蓝色。
(1)实验过程中,氧化铜粉末变成红色,这时因为氧化铜发生________(填“氧化”或“还原”)反应。
(2)甲装置中浓硫酸的作用________。
(3)实验过程应先点燃________处(填“乙”或“丙")酒精灯。
1.现有铁、氧化铁、稀硫酸、氢氧化钙、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“﹣”表示两端物质间可以发生化学反应.“→”表示物质间存在相应的转化关系.)下列判断合理的是( )
A.丙可能是碳酸钠溶液
B.丁可能是氢氧化钙溶液
C.乙必须通过置换反应转化为铁
D.甲和丁的反应一定是中和反应
2.下列物质的转变,不能一步实现的是( )
A.CO2→CO B.H2O2→H2 C.CaCO3→CO2 D.S→SO2
3.如图是CO还原氧化铁的“微型”实验装置(夹持仪器等略)。已知:HCOOHH2O+CO↑,下列说法不正确的是( )
A.实验中所需CO可现制现用
B.此装置可节约用品,污染小,现象明显
C.实验时先挤压软塑料滴瓶,再点燃酒精喷灯
D.该实验中所涉及反应的基本类型有分解反应和置换反应
4.某混合气体可能含有CO、CO2、CH4和HCl中的一种或几种,为了确定其成分,将混合气体按如图所示装置进行实验(假设各步均充分反应或吸收),结果装置A中的石灰水不变浑浊,但混合气体的体积明显减小;装置D增重1.8g;装置E增重2.4g,下列分析正确的是( )
A.装置A中石灰水不变混浊,所以气体中一定不含二氧化碳
B.装置C对实验结果不产生影响,所以可以去掉装置C以简化实验方案
C.后续装置的目的是阻止空气中的二氧化碳进入装置E中,干扰CO的检验
D.该混合气体成分可能是CH4 和CO
5.中和反应是放热反应吗?甲同学取10mL 10%的NaOH溶液于试管中,逐滴加入10%的稀硫酸,随着硫酸的加入,烧杯中溶液温度与加入硫酸体积之间的变化关系如甲图所示。当加入硫酸至10mL时,试管中溶液的温度最高,其根本原因是________________________。
乙同学按乙图装置实验,澄清的饱和石灰水的作用是_______________________。
丙同学按丙图实验,根据______________________现象也能证明中和反应是放热的。
请说明原理:____________________________________________。
甲 乙 丙
6.氢化钙(CaH2)是一种常用的储氢材料,是登山运动员常用的能源提供剂,但它要密封保存,一旦接触水就发生反应生成氢氧化钙并放出氢气。小明在实验室里利用氢气和金属钙加热制取氢化钙,制取装置如图所示:
资料:金属钙的活动性很强,遇水即可剧烈反应生成氢氧化钙,同时产生氢气。
回答下列问题:
(1)图甲中要确认经过装置B后的氢气是干燥的,需在B、C间接入图乙装置,而且观察到的现象为__________________________。
(2)实验结束后,小明在图甲C装置玻璃管中取少量物质加入水中,观察到有气泡冒出,溶液中加酚酞后显红色,小明据此判断:上述实验确有CaH2生成。但小东同学认为小明判断不正确,你认为小东的理由是:___________________________________________。
(3)开始实验时,先打开漏斗阀门通一段时间反应生成的氢气,再加热酒精灯的目的是__________________________________。
7.在学习“金属的冶炼”时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克。(所含杂质不参加反应)
(1)该实验利用了一氧化碳的 性,玻璃管内观察到的现象是 ;
(2)甲同学的方法:先测出氢氧化钠溶液的质量为50克,待反应完全后再次称量,质量为54.4克,请你计算样品中氧化铜的质量分数。(一氧化碳不与氢氧化钠溶液反应)
(3)乙同学的方法:先称量出玻璃管及样品的总质量为m1,待反应完全后再次称量,质量为m2,利用m1﹣m2的值,求出样品中氧化铜的质量分数,其中m1﹣m2的值是指 的质量;
(4)同学们查阅到CO除了具有可燃性、难溶于水等性质外,还具有有毒性,因此,本实验中还需对尾气进行处理,请你提出一种处理方法 。
1.下列转化能一步完成的是( )
①CO2→CO②HNO3→HCl ③Cu(OH)2→CuO④Ca(OH)2→NaOH ⑤Cl2→NaCl
A.①③④⑤ B.②③④⑤ C.①②④ D.②③④
2.如图为一氧化碳还原氧化铜的实验装置。下列说法正确的是( )
A.实验中可观察到玻璃管中的黑色固体变红色
B.该实验说明一氧化碳具有还原性,没有可燃性
C.该实验只能通过澄清石灰水是否变浑浊来判断反应是否发生
D.为防止发生爆炸,实验前应先加热玻璃管,再通入CO气体
3.“碳中和”是指一定时间内CO2的排放量与吸收量基本相当。CO2的捕集、利用是实现“碳中和”的重要途径我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。CO2与H2在一定条件下转化为CH4(反应过程如图所示,虚线处部分中间产物略去),可实现CO2的再利用。以下说法合理的是( )
A.二氧化碳会造成空气严重污染
B.MgO在上述转化中质量不变
C.上述反应中的产物只有CH4
D.参加该反应的CO2与H2分子个数之比是1:2
4.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳的质量比为40∶7
D.将尾气点燃或收集,可防止一氧化碳污染空气
5.某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2),查阅资料可知Mg、Mg3N2能发生如下反应:
①2Mg+O22MgO ②3Mg+N2Mg3N2 ③2Mg+CO22MgO+C
④Mg+H2OMgO+H2↑ ⑤Mg3N2+6H2O===3Mg(OH)2 ↓+2NH3↑
(NH3能使湿润的红色石蕊试纸变蓝)
(1)制取氮化镁的实验设计思路:用镁和氮气反应。反应之前必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2。装置B灼烧铁粉为了除去空气中的___________。
(2)气流流经装置的顺序是D→C→_____________(选填“B→A”或“A→B”)。
(3)通入空气后,应先点燃B装置的酒精灯,如果同时点燃A、B装置的酒精灯,对实验结果可能产生影响是_______________________________。
(4)设计一个实验,验证A中产物是氮化镁,方案
________________________________________(写出操作和现象)。
6.某混合气体可能是 CO、CO2、H2O、H2 中的一种或几种,为确定成分,将 8 克混合气体通入如图装置中(假设每步吸收和反应均完全)。
实验测定的部分实验装置数据如下表:
装置 A B C F
实验前装置和药品总质量/g 100.0 100.0 100.0 100.0
实验后装置和药品总质量/g 100.8 104.2 100.2 104.4
则(1)混合气体中含有的气体成分为________;
(2)E、F 中的实验现象分别是________。
答案及解析
例1、C
【解析】①铜在空气中加热生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜和水,铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,每一转化在一定条件下均能一步实现。②氢氧化钠与稀盐酸反应生成氯化钠和水,氯化钠转化为碳酸钠,假设能实现,生成物应是碳酸钠和氯化银沉淀,但碳酸银难溶于水,不能与氯化钠发生复分解反应,这一转化在一定条件下不能一步实现。③碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙与稀盐酸反应生成氯化钙和水,氯化钙与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,每一转化在一定条件下均能一步实现。故①和③每一转化在一定条件下均能一步实现。
例2、C
【解析】A.氢气还原氧化铜生成水,为了防止冷水倒流回试管底部将试管炸裂,所以试管口应略向下倾斜,故错误;B.乙实验中还会观察到黑色的粉末慢慢变成红色,来判断反应的发生,故错误;C.两实验都先通入一段时间的气体,以排净装置内的空气,再进行加热,以免发生爆炸,故正确;D.一氧化碳与氧化铜在加热的条件下反应生成铜和二氧化碳,反应物是两种化合物,不属于置换反应,故错误。
例3、(1)还原 (2)吸收和检验水 (3)丙
【解析】(1)氧化铜粉末为黑色,变成红色,说明发生了还原反应,生成了铜;
(2)浓硫酸具有吸水性,甲装置中浓硫酸作用是吸收和检验水;
(3)因一氧化碳或氢气还原氧化铜要先通入气体排除装置内空气,而一氧化碳有毒,不能排放到空气中,所以实验时要先点燃丙处酒精灯;
1.A
解:铁、氧化铁会与稀硫酸反应,氧化铁会转化成铁,因此乙是氧化铁,丁是稀硫酸;硫酸会与碳酸钠和氢氧化钙反应,碳酸钠和氢氧化钙可以相互反应,因此甲和丙是氢氧化钙、碳酸钠中的一种,因此:
A、根据推断,丙可能是碳酸钠,故判断合理;
B、丁是稀硫酸,故判断错误;
C、氧化铁可以和一氧化碳反应产生铁,不是置换反应,故判断错误;
D、甲和丁的反应可以是稀硫酸和氢氧化钙或碳酸钠的反应,因此不一定是中和反应,故判断错误;
故选:A。
2.B
【解答】解:A、二氧化碳与碳在高温下反应生成一氧化碳,能一步实现,故选项错误。
B、过氧化氢分解生成水和氧气,不能一步实现,故选项正确。
C、碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,能一步实现,故选项错误。
D、硫在氧气中燃烧生成二氧化硫,能一步实现,故选项错误。
故选:B。
3.D
【解析】A、该实验中利用甲酸与浓硫酸制取CO,所需CO可现制现用 ,不符合题意;
B、此装置为微型装置,可节约用品,污染小,现象明显,不符合题意;
C、实验时要先制取CO,排除装置内空气,所以先挤压软塑料滴瓶,使药品接触产生CO,通入CO后再点燃酒精喷灯 ,不符合题意;
D、该实验中没有涉及置换反应 ,符合题意;
4.C
【解析】A.如果混合气体中含有HCl,那么其中二氧化碳就能使装置A中澄清的石灰水不变浑浊,故A错误;
B.C装置中的浓硫酸对从B装置中出来气体进行干燥,防止干扰其他气体的检测,故B错误;
C.后续装置的目的是阻止空气中的二氧化碳进入装置E中,干扰CO的检验,故C正确;
D.装置D增重1.8g,是生成水的质量;装置E增2.4g,生成二氧化碳的质量为2.4g。
设生成1.8g水,同时生成二氧化碳质量为x
CH4+2O2 CO2+2H2O
44 36
x 1.8g
解得:x=2.2g<2.4g;
因此多余的二氧化碳肯定是一氧化碳燃烧生成的,
则该混合气体一定含有CO和CH4,故D错误。
5.此时二者恰好完全反应,放出的热量最多 证明氢氧化钠与硫酸反应能放热 烧杯内的导管口有气泡产生 反应若放出热量,则会使烧瓶中的气体受热而膨胀,从而烧杯内的导管口有气泡产生
【解析】(1)据图可以看出,当加入盐酸至10mL时烧杯中溶液的温度最高,说明此时二者恰好完全反应,放出的热量最多;(2)氢氧化钙的溶解度随温度的升高而降低,饱和石灰水变浑浊,说明氢氧化钠与盐酸反应能放出热量;(3)反应若放出热量,则会使烧瓶中的气体受热而膨胀,所以若观察到烧杯内的导管口有气泡产生,则说明中和反应放热。
6.(1)无水硫酸铜不变色 (2)钙也能与水反应生成氢氧化钙和氢气,既有气泡产生,又能使酚酞试液变红 (3)除去玻璃管中的空气,防止发生爆炸
【解析】(1)无水硫酸铜遇到水变为蓝色的五水硫酸铜,要确认经过装置B后的氢气是干燥的,只要观察到无水硫酸铜的颜色没有变化即可;(2)钙也能与水反应生成氢氧化钙和氢气,既有气泡产生,又能使酚酞试液变红.(3)根据装置特点和氢化钙与水反应生成氢气,氢气和氧气的混合气点燃,可能发生爆炸。
7.解:(1)一氧化碳具有还原性,可以将金属氧化物还原成金属,一氧化碳和氧化铜加热生成氧化铜是二氧化碳,所以玻璃管内观察到的现象是:黑色粉末变成红色;
(2)生成二氧化碳的质量为:54.4g﹣50g=4.4g,
设样品中氧化铜的质量为x,
CuO+COCO2+Cu
80 44
x 4.4g
x=8g
100%=80%;
(3)化学反应前后原子个数不变,所以先称量出玻璃管及样品的总质量为m1,待反应完全后再次称量,质量为m2,利用m1﹣m2的值,求出样品中氧化铜的质量分数,其中m1﹣m2的值是指氧元素的质量;
(4)一氧化碳具有可燃性,可以将一氧化碳进行点燃处理。
故答案为:(1)还原性,黑色粉末变成红色;(2)80%;(3)氧元素;(4)将尾气点燃。
1.A
【解答】解:①高温条件下,二氧化碳和碳反应生成一氧化碳,该选项能够一步实现;
②硝酸不能通过一步反应生成盐酸,该选项不能一步实现;
③加热条件下,氢氧化铜分解生成氧化铜和水,该选项能够一步实现;
④氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,该选项能够一步实现;
⑤钠在氯气中燃烧生成氯化钠,该选项能够一步实现。
故选:A。
2.A
【解析】根据一氧化碳与氧化铜反应生成铜和二氧化碳,以及操作步骤分析,CO的实验用点燃方法处理尾气,可证明物质的可燃性。
A、CO与氧化铜反应生成铜,玻璃管内黑色固体变成红色,符合题意;
B、该实验尾气点燃处理,可说明一氧化碳的可燃性,不符合题意;
C、该实验也可通过玻璃内固体颜色变化证明反应发生,不符合题意;
D、为防止发生爆炸,应先通入纯净CO,再加热玻璃管,不符合题意;
3.B
【解答】解:A、二氧化碳不是空气污染物,A说法错误;
B、在反应过程中,氧化镁的作用是催化作用,故质量和化学性质均未改变,B说法正确;
C、由流程图可知,该反应中,除CH4外另一种生成物为H2O,C说法错误;
D、根据流程图可以知道,该反应的化学方程式为:CO2+4H2CH4+2H2O,所得CO2与H2分子的分子个数之比为1:4,D说法错误;
故选:B。
4.D
【解析】A、实验开始先通入一氧化碳,排出装置内的空气后,再点燃酒精喷灯加热玻璃管中的氧化铁,先通入一氧化碳后加热的原因是排尽玻璃管中的空气,防止发生爆炸,故选项说法错误。B、一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,实验进行一段时间后,玻璃管A中出现的现象是红棕色粉末逐渐变黑,故选项说法错误。C、反应的化学方程式为:Fe2O3+3CO2Fe+3CO2,参加反应的氧化铁和一氧化碳质量比为160:(28×3)=40:21,故选项说法错误。D、一氧化碳有毒,直接排放到空气中会污染环境,本实验的缺陷是没有设计尾气处理装置,可将玻璃管改成尖嘴点燃或用气球收集,故选项说法正确。
5.(1)氧气 (2)B→A (3)制取的氮化镁中会混有氧化镁 (4)将产物取少量置于试管中,加入适量水,将湿润的红色石蕊试纸置于试管口,能够看到湿润的红色石蕊试纸变蓝
【解析】(1)根据题中信息可知Mg在空气中点燃可以和O2、CO2、H2O反应,所以镁和氮气反应必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2,浓硫酸作用是除去水蒸气,浓氢氧化钠是除去空气中二氧化碳,灼热的铁粉为了除去空气中氧气;
(2)除去水蒸气选用浓硫酸,除去氧气用能与空气中氧气反应的物质即可,除去二氧化碳用氢氧化钙溶液吸收,但要先除去二氧化碳再干燥然后除去氧气,故答案为:D→C→B→A;
(3)通气后,应向点燃B装置的酒精灯,如果同时点燃A、B装置的酒精灯,A没有排完空气就加热会让空气中的氧气、氮气和水与镁反应生成其他物质,制得的氮化镁不纯;
(4)依据氮化镁和水反应生成氨气,方程式为 Mg3N2+6H2O=3Mg(OH)2+2NH3↑,将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
6.(1)CO、CO2、H2O、H2 (2)E 中白色粉末变为蓝色、F 中溶液变浑浊
【解析】将混合气体通过A中硫酸铜粉末,A装置的质量增加,说明它吸收了水蒸气,即混合气体肯定含有H2O;再通过B中氢氧化钠溶液,B的质量增加,说明它吸收了二氧化碳,即混合气体中肯定含有CO2;将混合气体通过浓硫酸,去除其中剩余的水蒸气,与D中的氧化铜反应后,得到的气体通入E中的硫酸铜粉末,因为E的质量增大,说明有水生成,因此混合气体中肯定含有H2;再将得到的气体通过F中的Ba(OH)2溶液,F质量增大,说明有二氧化碳产生,即混合气体肯定含有CO,据此解答即可。
【解答】(1)混合气体中含有的气体成分为:CO、CO2、H2O、H2;
(2)E中的白色硫酸铜粉末吸收水后变成蓝色,F中的Ba(OH)2溶液吸收二氧化碳后生成碳酸钡白色沉淀,使溶液变浑浊。
2022-2023学年上学期浙教版科学九年级“精讲精练”讲义(七)
物质的转化
知识精讲
典型例题
课内精练
课后提分
典型例题
课内精练
课后提分
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
