化学人教版(2019)必修第一册3.1.1.铁及其化合物(共42张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.1.铁及其化合物(共42张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-22 10:42:14 | ||
图片预览











文档简介
(共42张PPT)
第三章 铁 金属材料
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
人类在四千五百多年前就开始使用铁器。铁是目前产量最大、使用最广泛的金属。铁及其化合物具有怎样的性质?应如何进行研究呢?通过研究铁及其化合物的性质和用途,可以使我们从物质类别和元素价态的视角认识物质间的转化关系,深化对物质及其变化多样性的认识。
金属材料对于促进生产发展、改善人类生活发挥了巨大作用。对不同类型合金的性能和用途的认识,可以进一步强化性能决定用途的观念。
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
第一节 铁及其化合物
第1课时
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
人类最早使用的铁,是来自太空的陨铁
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
陨铁
铁在自然界中可以像陨铁中的铁那样以单质形态存在,但主要是以+2价和+3价化合物的形态存在于矿石中。
铁元素在地壳中的含量仪次于氧、硅和铝,居第四位。
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
我国目前发现最早的人工冶铁制品是甘肃灵台出土的春秋初年秦国的铜柄铁剑,这说明春秋初年我国已掌握了冶铁技术。战国中期以后,铁制工具在社会生产中发挥了巨大的作用。
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
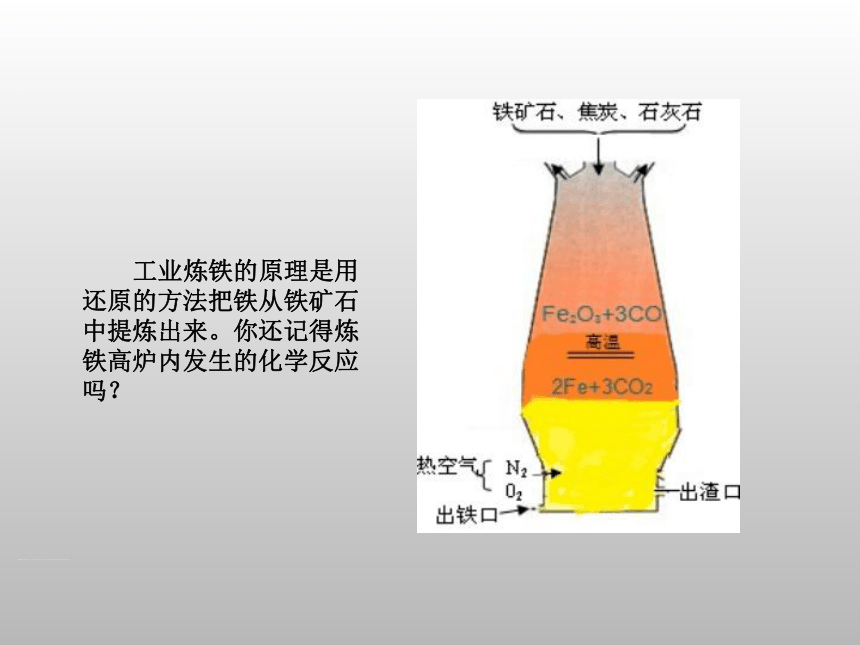
工业炼铁的原理是用还原的方法把铁从铁矿石中提炼出来。你还记得炼铁高炉内发生的化学反应吗?
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
一、铁的单质
铁有延展性和导热性。铁能导电,但其导电性不如铜和铝。铁能被磁体吸引。铁的化学性质比较活泼,它能与许多物质发生化学反应。
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
1.铁的单质——Fe
(1)物理性质
铁(iron)是银白色的,有金属光泽。熔点1538℃、沸点2750℃
(2)化学性质
①与活泼非金属反应:
②与酸反应:
Fe+ 2H+ = Fe2++H2↑
Fe — 2e— = Fe2+
Fe — 3e— = Fe3+
小结:
思考与讨论
我们学习过铁与一些物质的反应,例如,铁与氯气的反应,铁与盐酸的反应,铁与硫酸铜溶液的反应等。在上述三个反应中,铁的化合价的变化有何异同?为什么会有这样的异同?
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液等具有氧化性的物质反应。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物:
Fe + 2HCl = FeCl + H ↑
Fe + CuSO = FeSO + Cu
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物:
2Fe + 3Cl2 === 2FeCl3
点燃
2Fe + 3Br2 === 2FeBr3
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
在铁厂的生产中,炽热的铁水或钢水注人模具之前,模具必须进行充分的干燥处理,不得留有水。
这是为什么呢?
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
生活经验告诉我们,铁与水在常温或加热条件下是不反应的。那么,在高温下,铁能否与水反应呢?
有人设计了如右图所示装置,进行了还原铁粉与水蒸气反应的实验。根据实验现象,会有什么样的生成物呢?
现象:铁粉失去光泽,变成黑色粉末(可被磁铁吸引)并有气泡冒出,点燃肥皂泡可听到爆鸣声。
3Fe+4H2O(g)===Fe3O4+4H2
高温
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
实验结束时,应先从肥皂水中撤出导管,再移去燃着的酒精灯。
注意:此反应生成的是Fe3O4
水是以气态(g)形式参加反应
氢气不加气体符号
条件是 高温
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
水蒸气的发生装置
水蒸气与铁粉反应装置
产物收集装置
方案1:
方案2:
此外,还可用如下方案进行还原铁粉与水反应的实验:
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
铁是人体必需的微量元素中含量最多的一种(约4~5克),缺铁性贫血已成为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。那铁元素在人体中又是以什么形式存在呢?
食补
药补
都是亚铁!
浅绿色
浅绿色
白色
红褐色
棕黄色
棕黄色
二、铁的重要化合物
Fe3O4
黄铁矿(FeS2)
赤铁矿(Fe2O3)
硫酸亚铁
二、铁的重要化合物
磁铁矿
赤铁矿
氧化亚铁
二、铁的重要化合物
1、铁的氧化物
铁元素可形成3种氧化物,分别是
氧化亚铁( FeO),氧化铁 (Fe2O3),四氧化三铁( Fe3O4)
以Fe2O3作为红墙的涂料
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
1、 铁的氧化物
化学式 FeO Fe2O3 Fe3O4
俗名
色态
铁的价态
水溶性
稳定性
与非氧化性酸反应
氧化性
——
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
+2价
+3价
+2价、+3价
不溶
不溶
不溶
不稳定
稳定
稳定
FeO + 2H+ = Fe2+ + H2O
Fe2O3 + 6H+ = Fe3+ + 3H2O
Fe3O4 + 8H+= Fe2++ 2Fe3++4 H2O
高温时,都能与C、CO、H2反应,被还原生成Fe(炼铁原理)
练习:写出以上三种铁的氧化物与一氧化碳反应的化学方程式。
名称 氧化亚铁 氧化铁 四氧化三铁
共 性 与酸
与还原剂
fe2o3 + 6h+ = 2fe3+ + 3h2o
fe2o3 + 3co === 2fe + 3co2
高温
feo + 2h+ = fe2+ + h2o
fe3o4 + 8h+ = 2fe3+ + fe2+ + 4h2o
feo + co === fe + co2
高温
fe3o4+ 4co === 3fe + 4co2
高温
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
砖的颜色为何有青有红?
同学们大都见过红砖和青砖,你们是否知道它们是由同种砖胚烧制而成的?为什么用相同的材料制成的砖的颜色会不相同呢?
在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成________而制得红色的砖瓦。若烘烧后期从窑顶慢慢浇水,窑内会产生大量的________气体,它们把红色的物质还原成的黑色化合物是___________,同时还有没烧完的碳颗粒,从而制得了青色砖瓦。
Fe2O3
H2、CO
FeO 、Fe3O4
砖瓦的颜色为何有青有红?
FeCl3溶液 FeSO4溶液
加入NaOH 溶液
化学方程式
白色絮状沉淀 →灰绿色
→ 红褐色沉淀
FeCl3 + 3NaOH = Fe(OH)3 +3NaCl
FeSO4 + 2NaOH =
Fe(OH)2 + Na2SO4
4Fe(OH) 2 + O2
+2H2O = 4Fe(OH)3
铁的两种氢氧化物可以分别由相对应的可溶性盐和碱溶液反应制得。
红褐色沉淀
1)制取(实验3-1)
2、铁的氢氧化物
思考:
如何在溶液中制得稳定的Fe(OH)2?
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入_____________;
(2)除去蒸馏水中溶解的O2常采用________的方法;
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面以下,再挤出NaOH溶液。这样操作的理由是__________________________。
方法:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
在溶液中制得稳定的Fe(OH)2的方法
铁粉
煮沸
防止滴加NaOH过程中带进氧气
(1)氢氧化铁
①与酸反应
②受热可分解
一种难溶于水的红褐色固体
(2)氢氧化亚铁
①与酸反应
② 不稳定,易被空气中的氧气氧化
Fe(OH)2+2HCl=FeCl2+2H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(氧化剂)
(还原剂)
2Fe(OH)3 = Fe2O3 + 3H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3+3H+== Fe3++3H2O;
Fe(OH)2+2H+== Fe2++2H2O;
一种难溶于水的白色固体
2、铁的氢氧化物
2)性质
3、铁盐和亚铁盐
(1)Fe3+的检验
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
结论和运用
溶液呈血红色
溶液颜色无变化
FeCl2 FeCl3
加入KSCN溶液变红色可检验Fe 3+
【实验3—2】在2支试管里分别加入5ml FeCl2和5ml FeCl3溶液分别滴入KSCN溶液,观察现象并记录。
Fe3++3SCN-=Fe(SCN)3 (血红色)
鉴别方法
直 接 观 色
显色反应
利 用
与KSCN
利用沉淀反应
与 作用
浅绿色
棕黄色
血红色
不显红色
白色沉淀迅速变灰绿色最后呈红褐色
立即产生红褐
色沉淀
还有哪些方法可以鉴别FeCl3溶液和FeCl2溶液
思考与交流:
(2)Fe3+和Fe 2+的相互转化
【实验3—3】在FeCl3溶液中加入足量Fe粉,振荡。再滴入几滴KSCN溶液,观察现象;在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2),再观察现象。
2Fe3+ + Fe = 3Fe2+
FeCl3溶液中加入 现象 反应的离子方程式
Fe粉,KSCN溶液
氯水,振荡
溶液不显血红色
溶液变成血红色
2Fe2+ + Cl2 = 2Fe3+ +2Cl
3、铁盐和亚铁盐
Fe2+
Fe3+
Cl2等强氧化剂
铁等强还原剂
【课堂习题】
1.为什么实验室在配制FeCl2或FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?
答:防止Fe2+被氧化成Fe3+
Fe+2Fe3+=3Fe2+
2.除去FeCl2溶液中的少量FeCl3,可加入 ;除去FeCl3溶液中的少量FeCl2,可加入 ;除去FeCl2溶液中的少量CuCl2,可加入 。
Fe粉
氯水
Fe粉
课堂练习
1.证明溶液中是否有Fe 2+,其操作正确的顺序是
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A.①② B.②③ C.①②③ D.③②
2.下列物质充分反应后,滴入KSCN溶液,显红色的是
FeO+ HCl(溶液) B. 过量铁+ 稀硫酸
C. FeCl2(溶液) + Cl2 D. Fe + CuSO4(溶液)
D
C
课堂练习
3. 下列检验Fe 3+的方法错误的是
A. 加入NaOH溶液,生成灰白色沉淀迅速变成灰绿色,最后变成红褐色
B. 加入NaOH溶液,生成红褐色沉淀
C. 加入硫氰化钾溶液,显示红色
D. 加入氨水,生成红褐色沉淀
4. 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质
A.锌粉 B.镁粉 C.铁粉 D. 铝粉
A
C
动动手
写出下列反应方程式,是离子反应写出离子方程式:
①Fe与硫酸铜溶液反应
②FeCl2溶液中加入锌粒
③FeCl2溶液中通入Cl2
④FeCl3溶液中加入铁粉
⑤Fe2O3与CO反应
⑥铁在氯气中燃烧
“铁三角”
还原性(主)
氧化性
还原性
氧化性
强氧化剂
Fe
Fe2+
Fe3+
还
原
剂
剂
弱
氧
化
(H+,Cu2+ )
Cl2等
氧化剂
(Cl2, O2)
还原剂
(Fe,Cu,I-)
还
原
剂
Zn,H2,
H2,CO
练习
1、运用铁及其化合物的知识,完成下列各题。
①既有氧化性,又有还原性的微粒是( )
A. Fe B. Fe2+ C. Fe3+
② 要除去FeCl2溶液中的少量FeCl3,可行的办法是( )
A. 滴入KSCN溶液 B. 通入氯气
C. 加入铜粉 D. 加入铁粉
B
D
2、下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是 ( )
①金属钠在纯氧中燃烧;
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间;
③FeCl3溶液中滴入KSCN溶液;
④无水硫酸铜放入水中。
A、②③①④ B、③②①④
C、③①②④ D、①②③④
B
练习
【课堂习题】
物质 杂质 试剂或方法 化学方程式
FeCl3溶液 FeCl2
FeCl2溶液 FeCl3
FeSO4溶液 CuSO4
Fe2O3 Al2O3
Fe2O3 Fe(OH)3
Fe(OH)3 Al(OH)3
3、下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将杂质除去.
通入足量Cl2
加足量铁粉
加足量铁粉
加过量NaOH溶液
加热
加过量NaOH溶液
4、下列离子方程式中,正确的是( )
(A)、铁与盐酸反应:
2Fe+6H+==2Fe3++3H2↑
(B)、氯气与氯化亚铁溶液反应: 2FeCl2+Cl2=2FeCl3
(C)、氯化铁溶液与铁反应: Fe3++Fe=2Fe2+
(D)、氯化铁溶液与氢氧化钠溶液反应: Fe3++3OH- =Fe(OH)3↓
电荷不守恒
不是离子方程式
不符合客观事实
【课堂习题】
5、制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2 ,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A、烧杯中有铜无铁 B、烧杯中有铁无铜
C、烧杯中铁铜都有 D、烧杯中铁铜都无
【课堂习题】
B
6、下列物质受热不易分解的氢氧化物是
A. Al2O3 B. NaOH
C. Mg(OH)2 D. Fe2O3
B
7、已知有以下物质相互转化
(1) A转化为B及气体这步反应中应加入的试剂是 。
(2)写出B的化学式 D的化学式 。
(3)写出由E转变成F的化学方程式
(4)写出鉴别G溶液的离子方程式 ;向G溶液中加入A的有关离子反应方程式是
【课堂习题】
第三章 铁 金属材料
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
人类在四千五百多年前就开始使用铁器。铁是目前产量最大、使用最广泛的金属。铁及其化合物具有怎样的性质?应如何进行研究呢?通过研究铁及其化合物的性质和用途,可以使我们从物质类别和元素价态的视角认识物质间的转化关系,深化对物质及其变化多样性的认识。
金属材料对于促进生产发展、改善人类生活发挥了巨大作用。对不同类型合金的性能和用途的认识,可以进一步强化性能决定用途的观念。
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
第一节 铁及其化合物
第1课时
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
人类最早使用的铁,是来自太空的陨铁
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
陨铁
铁在自然界中可以像陨铁中的铁那样以单质形态存在,但主要是以+2价和+3价化合物的形态存在于矿石中。
铁元素在地壳中的含量仪次于氧、硅和铝,居第四位。
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
我国目前发现最早的人工冶铁制品是甘肃灵台出土的春秋初年秦国的铜柄铁剑,这说明春秋初年我国已掌握了冶铁技术。战国中期以后,铁制工具在社会生产中发挥了巨大的作用。
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
工业炼铁的原理是用还原的方法把铁从铁矿石中提炼出来。你还记得炼铁高炉内发生的化学反应吗?
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
一、铁的单质
铁有延展性和导热性。铁能导电,但其导电性不如铜和铝。铁能被磁体吸引。铁的化学性质比较活泼,它能与许多物质发生化学反应。
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
1.铁的单质——Fe
(1)物理性质
铁(iron)是银白色的,有金属光泽。熔点1538℃、沸点2750℃
(2)化学性质
①与活泼非金属反应:
②与酸反应:
Fe+ 2H+ = Fe2++H2↑
Fe — 2e— = Fe2+
Fe — 3e— = Fe3+
小结:
思考与讨论
我们学习过铁与一些物质的反应,例如,铁与氯气的反应,铁与盐酸的反应,铁与硫酸铜溶液的反应等。在上述三个反应中,铁的化合价的变化有何异同?为什么会有这样的异同?
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液等具有氧化性的物质反应。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物:
Fe + 2HCl = FeCl + H ↑
Fe + CuSO = FeSO + Cu
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物:
2Fe + 3Cl2 === 2FeCl3
点燃
2Fe + 3Br2 === 2FeBr3
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
在铁厂的生产中,炽热的铁水或钢水注人模具之前,模具必须进行充分的干燥处理,不得留有水。
这是为什么呢?
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
生活经验告诉我们,铁与水在常温或加热条件下是不反应的。那么,在高温下,铁能否与水反应呢?
有人设计了如右图所示装置,进行了还原铁粉与水蒸气反应的实验。根据实验现象,会有什么样的生成物呢?
现象:铁粉失去光泽,变成黑色粉末(可被磁铁吸引)并有气泡冒出,点燃肥皂泡可听到爆鸣声。
3Fe+4H2O(g)===Fe3O4+4H2
高温
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
实验结束时,应先从肥皂水中撤出导管,再移去燃着的酒精灯。
注意:此反应生成的是Fe3O4
水是以气态(g)形式参加反应
氢气不加气体符号
条件是 高温
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
水蒸气的发生装置
水蒸气与铁粉反应装置
产物收集装置
方案1:
方案2:
此外,还可用如下方案进行还原铁粉与水反应的实验:
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
铁是人体必需的微量元素中含量最多的一种(约4~5克),缺铁性贫血已成为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。那铁元素在人体中又是以什么形式存在呢?
食补
药补
都是亚铁!
浅绿色
浅绿色
白色
红褐色
棕黄色
棕黄色
二、铁的重要化合物
Fe3O4
黄铁矿(FeS2)
赤铁矿(Fe2O3)
硫酸亚铁
二、铁的重要化合物
磁铁矿
赤铁矿
氧化亚铁
二、铁的重要化合物
1、铁的氧化物
铁元素可形成3种氧化物,分别是
氧化亚铁( FeO),氧化铁 (Fe2O3),四氧化三铁( Fe3O4)
以Fe2O3作为红墙的涂料
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
1、 铁的氧化物
化学式 FeO Fe2O3 Fe3O4
俗名
色态
铁的价态
水溶性
稳定性
与非氧化性酸反应
氧化性
——
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
+2价
+3价
+2价、+3价
不溶
不溶
不溶
不稳定
稳定
稳定
FeO + 2H+ = Fe2+ + H2O
Fe2O3 + 6H+ = Fe3+ + 3H2O
Fe3O4 + 8H+= Fe2++ 2Fe3++4 H2O
高温时,都能与C、CO、H2反应,被还原生成Fe(炼铁原理)
练习:写出以上三种铁的氧化物与一氧化碳反应的化学方程式。
名称 氧化亚铁 氧化铁 四氧化三铁
共 性 与酸
与还原剂
fe2o3 + 6h+ = 2fe3+ + 3h2o
fe2o3 + 3co === 2fe + 3co2
高温
feo + 2h+ = fe2+ + h2o
fe3o4 + 8h+ = 2fe3+ + fe2+ + 4h2o
feo + co === fe + co2
高温
fe3o4+ 4co === 3fe + 4co2
高温
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
【新教材】人教版(2019)高中化学必修 第一册 第三章 第1节 铁及其化合物 第1课时(共19张PPT)
砖的颜色为何有青有红?
同学们大都见过红砖和青砖,你们是否知道它们是由同种砖胚烧制而成的?为什么用相同的材料制成的砖的颜色会不相同呢?
在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成________而制得红色的砖瓦。若烘烧后期从窑顶慢慢浇水,窑内会产生大量的________气体,它们把红色的物质还原成的黑色化合物是___________,同时还有没烧完的碳颗粒,从而制得了青色砖瓦。
Fe2O3
H2、CO
FeO 、Fe3O4
砖瓦的颜色为何有青有红?
FeCl3溶液 FeSO4溶液
加入NaOH 溶液
化学方程式
白色絮状沉淀 →灰绿色
→ 红褐色沉淀
FeCl3 + 3NaOH = Fe(OH)3 +3NaCl
FeSO4 + 2NaOH =
Fe(OH)2 + Na2SO4
4Fe(OH) 2 + O2
+2H2O = 4Fe(OH)3
铁的两种氢氧化物可以分别由相对应的可溶性盐和碱溶液反应制得。
红褐色沉淀
1)制取(实验3-1)
2、铁的氢氧化物
思考:
如何在溶液中制得稳定的Fe(OH)2?
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入_____________;
(2)除去蒸馏水中溶解的O2常采用________的方法;
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面以下,再挤出NaOH溶液。这样操作的理由是__________________________。
方法:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
在溶液中制得稳定的Fe(OH)2的方法
铁粉
煮沸
防止滴加NaOH过程中带进氧气
(1)氢氧化铁
①与酸反应
②受热可分解
一种难溶于水的红褐色固体
(2)氢氧化亚铁
①与酸反应
② 不稳定,易被空气中的氧气氧化
Fe(OH)2+2HCl=FeCl2+2H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(氧化剂)
(还原剂)
2Fe(OH)3 = Fe2O3 + 3H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3+3H+== Fe3++3H2O;
Fe(OH)2+2H+== Fe2++2H2O;
一种难溶于水的白色固体
2、铁的氢氧化物
2)性质
3、铁盐和亚铁盐
(1)Fe3+的检验
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
结论和运用
溶液呈血红色
溶液颜色无变化
FeCl2 FeCl3
加入KSCN溶液变红色可检验Fe 3+
【实验3—2】在2支试管里分别加入5ml FeCl2和5ml FeCl3溶液分别滴入KSCN溶液,观察现象并记录。
Fe3++3SCN-=Fe(SCN)3 (血红色)
鉴别方法
直 接 观 色
显色反应
利 用
与KSCN
利用沉淀反应
与 作用
浅绿色
棕黄色
血红色
不显红色
白色沉淀迅速变灰绿色最后呈红褐色
立即产生红褐
色沉淀
还有哪些方法可以鉴别FeCl3溶液和FeCl2溶液
思考与交流:
(2)Fe3+和Fe 2+的相互转化
【实验3—3】在FeCl3溶液中加入足量Fe粉,振荡。再滴入几滴KSCN溶液,观察现象;在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2),再观察现象。
2Fe3+ + Fe = 3Fe2+
FeCl3溶液中加入 现象 反应的离子方程式
Fe粉,KSCN溶液
氯水,振荡
溶液不显血红色
溶液变成血红色
2Fe2+ + Cl2 = 2Fe3+ +2Cl
3、铁盐和亚铁盐
Fe2+
Fe3+
Cl2等强氧化剂
铁等强还原剂
【课堂习题】
1.为什么实验室在配制FeCl2或FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?
答:防止Fe2+被氧化成Fe3+
Fe+2Fe3+=3Fe2+
2.除去FeCl2溶液中的少量FeCl3,可加入 ;除去FeCl3溶液中的少量FeCl2,可加入 ;除去FeCl2溶液中的少量CuCl2,可加入 。
Fe粉
氯水
Fe粉
课堂练习
1.证明溶液中是否有Fe 2+,其操作正确的顺序是
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A.①② B.②③ C.①②③ D.③②
2.下列物质充分反应后,滴入KSCN溶液,显红色的是
FeO+ HCl(溶液) B. 过量铁+ 稀硫酸
C. FeCl2(溶液) + Cl2 D. Fe + CuSO4(溶液)
D
C
课堂练习
3. 下列检验Fe 3+的方法错误的是
A. 加入NaOH溶液,生成灰白色沉淀迅速变成灰绿色,最后变成红褐色
B. 加入NaOH溶液,生成红褐色沉淀
C. 加入硫氰化钾溶液,显示红色
D. 加入氨水,生成红褐色沉淀
4. 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质
A.锌粉 B.镁粉 C.铁粉 D. 铝粉
A
C
动动手
写出下列反应方程式,是离子反应写出离子方程式:
①Fe与硫酸铜溶液反应
②FeCl2溶液中加入锌粒
③FeCl2溶液中通入Cl2
④FeCl3溶液中加入铁粉
⑤Fe2O3与CO反应
⑥铁在氯气中燃烧
“铁三角”
还原性(主)
氧化性
还原性
氧化性
强氧化剂
Fe
Fe2+
Fe3+
还
原
剂
剂
弱
氧
化
(H+,Cu2+ )
Cl2等
氧化剂
(Cl2, O2)
还原剂
(Fe,Cu,I-)
还
原
剂
Zn,H2,
H2,CO
练习
1、运用铁及其化合物的知识,完成下列各题。
①既有氧化性,又有还原性的微粒是( )
A. Fe B. Fe2+ C. Fe3+
② 要除去FeCl2溶液中的少量FeCl3,可行的办法是( )
A. 滴入KSCN溶液 B. 通入氯气
C. 加入铜粉 D. 加入铁粉
B
D
2、下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是 ( )
①金属钠在纯氧中燃烧;
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间;
③FeCl3溶液中滴入KSCN溶液;
④无水硫酸铜放入水中。
A、②③①④ B、③②①④
C、③①②④ D、①②③④
B
练习
【课堂习题】
物质 杂质 试剂或方法 化学方程式
FeCl3溶液 FeCl2
FeCl2溶液 FeCl3
FeSO4溶液 CuSO4
Fe2O3 Al2O3
Fe2O3 Fe(OH)3
Fe(OH)3 Al(OH)3
3、下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将杂质除去.
通入足量Cl2
加足量铁粉
加足量铁粉
加过量NaOH溶液
加热
加过量NaOH溶液
4、下列离子方程式中,正确的是( )
(A)、铁与盐酸反应:
2Fe+6H+==2Fe3++3H2↑
(B)、氯气与氯化亚铁溶液反应: 2FeCl2+Cl2=2FeCl3
(C)、氯化铁溶液与铁反应: Fe3++Fe=2Fe2+
(D)、氯化铁溶液与氢氧化钠溶液反应: Fe3++3OH- =Fe(OH)3↓
电荷不守恒
不是离子方程式
不符合客观事实
【课堂习题】
5、制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2 ,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A、烧杯中有铜无铁 B、烧杯中有铁无铜
C、烧杯中铁铜都有 D、烧杯中铁铜都无
【课堂习题】
B
6、下列物质受热不易分解的氢氧化物是
A. Al2O3 B. NaOH
C. Mg(OH)2 D. Fe2O3
B
7、已知有以下物质相互转化
(1) A转化为B及气体这步反应中应加入的试剂是 。
(2)写出B的化学式 D的化学式 。
(3)写出由E转变成F的化学方程式
(4)写出鉴别G溶液的离子方程式 ;向G溶液中加入A的有关离子反应方程式是
【课堂习题】
