2.1.3碳酸钠和碳酸氢钠课件-2022-2023学年高一化学人教版(2019)必修第一册(21张)
文档属性
| 名称 | 2.1.3碳酸钠和碳酸氢钠课件-2022-2023学年高一化学人教版(2019)必修第一册(21张) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-22 10:48:41 | ||
图片预览





文档简介
(共18张PPT)
2.1.3 碳酸钠和碳酸氢钠
(钠及其化合物 第3课时)
第二节
第二章 海水中的重要元素—— 钠和氯
人教版 必修 1
2022.10.21
情景 引入
Na2CO3和NaHCO3的广泛应用
观察 思考
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名
离子组成及个数比
相对分子质量
外观(色、态)
与少量水混合
溶解性 等浓度溶液的碱性
用途
1.物理性质
Na2CO3和NaHCO3
细小的白色晶体
白色粉末
Na+ :CO32- = 2 : 1
Na+ :HCO3- = 1 : 1
纯碱或苏打
小苏打
106
84
结晶 ( Na2CO3+10H2O = Na2CO3 10H2O )
伴随放热现象
溶解,伴随吸热现象
强
弱
均易溶于水,溶解度:Na2CO3 > NaHCO3
制肥皂、玻璃
胃药、灭火剂、发酵粉
Na2CO3和NaHCO3
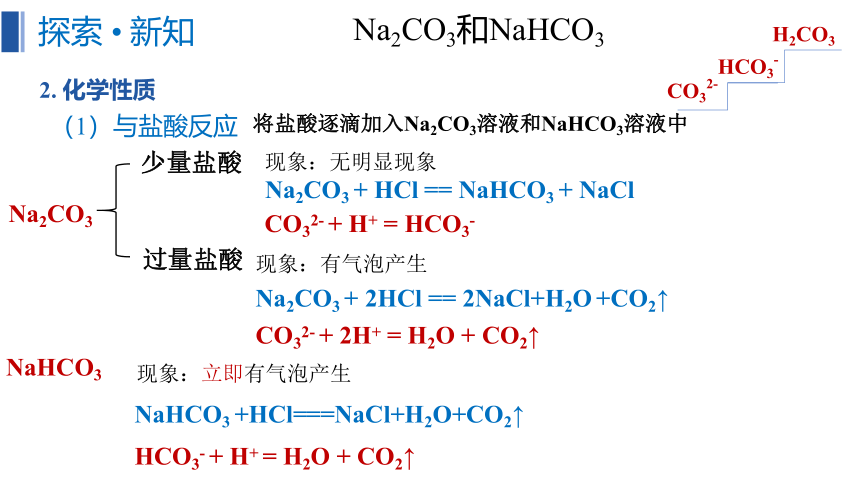
2. 化学性质
探索 新知
(1)与盐酸反应
Na2CO3
少量盐酸
过量盐酸
CO32- + H+ = HCO3-
Na2CO3 + HCl == NaHCO3 + NaCl
Na2CO3 + 2HCl == 2NaCl+H2O +CO2↑
CO32- + 2H+ = H2O + CO2↑
NaHCO3 +HCl===NaCl+H2O+CO2↑
NaHCO3
HCO3- + H+ = H2O + CO2↑
CO32-
HCO3-
H2CO3
将盐酸逐滴加入Na2CO3溶液和NaHCO3溶液中
现象:无明显现象
现象:有气泡产生
现象:立即有气泡产生
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(1)与盐酸反应
Na2CO3
Na2CO3 + 2HCl == 2NaCl+H2O +CO2↑
CO32- + 2H+ = H2O + CO2↑
NaHCO3 +HCl===NaCl+H2O+CO2↑
NaHCO3
HCO3- + H+ = H2O + CO2↑
分别将Na2CO3溶液和NaHCO3溶液逐滴加入盐酸中
现象:产生气泡速率较慢
现象:产生气泡速率较快
Na2CO3和NaHCO3
2. 化学性质
探索 新知
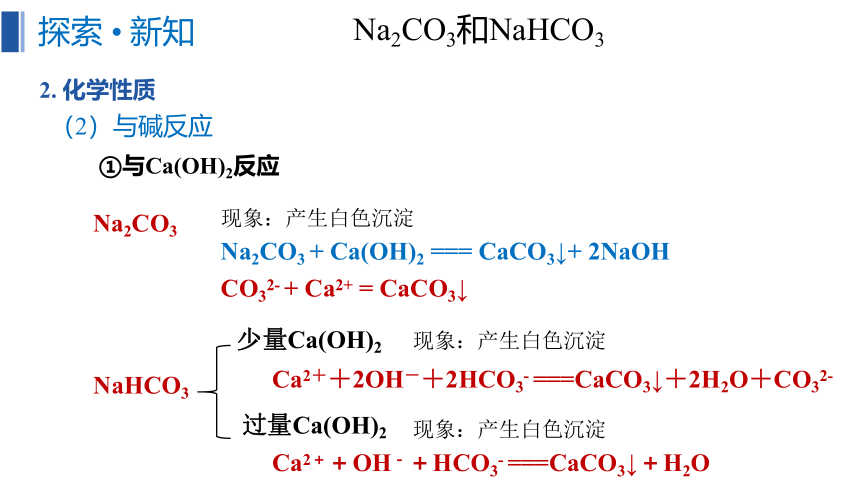
(2)与碱反应
①与Ca(OH)2反应
Na2CO3
NaHCO3
少量Ca(OH)2
过量Ca(OH)2
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
CO32- + Ca2+ = CaCO3↓
Ca2++OH-+HCO3- ===CaCO3↓+H2O
Ca2++2OH-+2HCO3- ===CaCO3↓+2H2O+CO32-
现象:产生白色沉淀
现象:产生白色沉淀
现象:产生白色沉淀
②与NaOH反应
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(2)与碱反应
Na2CO3
NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
HCO3- + OH- = H2O + CO32-
不反应
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(3)与CO2反应
不反应
Na2CO3
NaHCO3
Na2CO3+H2O+CO2 = 2NaHCO3
CO32- + CO2 + H2O = 2HCO3-
【思考】往饱和Na2CO3溶液中通入过量CO2,会有何现象?
有白色固体析出
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(4)与可溶性钙盐(钡盐)反应
Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl
CO32- + Ba2+ = BaCO3↓
不反应
Na2CO3
NaHCO3
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
CO32- + Ca2+ = CaCO3↓
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(5)热稳定性
2NaHCO3 = Na2CO3+H2O+CO2 ↑
Na2CO3 > NaHCO3
Na2CO3和NaHCO3
3.相互转化
归纳 总结
Na2CO3
NaHCO3
(2)少量盐酸
(1)通过量CO2
(1)加热
(2)少量NaOH 或少量Ca(OH)2
(2) Na2CO3 + HCl=== NaHCO3 + NaCl
(1) Na2CO3+H2O+CO2 = 2NaHCO3
(1) 2NaHCO3 = Na2CO3+H2O+CO2 ↑
(2) Ca(OH)2+2NaHCO3 ===CaCO3↓+2H2O+Na2CO3
(2) NaHCO3 + NaOH = Na2CO3 + H2O
Na2CO3和NaHCO3
4. 鉴别与除杂
归纳 总结
(1)鉴别
溶液
BaCl2溶液或CaCl2溶液
产生白色沉淀的是Na2CO3
不产生白色沉淀的是NaHCO3
①利用阴离子的不同
【思考】能否用加入Ba(OH)2溶液的方法鉴别Na2CO3和NaHCO3?
不能,均会产生白色沉淀
Na2CO3和NaHCO3
4. 鉴别与除杂
归纳 总结
(1)鉴别
固体
加热
② 利用热稳定性的不同
无明显变化的是Na2CO3
放出无色无味的使澄清石灰水变浑浊的气体是NaHCO3
【思考】能否用加热溶液,观察有无气泡产生的方法鉴别Na2CO3和NaHCO3?
不能,均无明显现象
Na2CO3和NaHCO3
4. 鉴别与除杂
归纳 总结
(1)鉴别
③ 利用与酸反应现象的不同
固体
(或溶液)
盐酸
产生气泡速率快的是NaHCO3
反应速率
逐滴加入盐酸
产生气泡速率慢的是Na2CO3
滴加盐酸立即产生气泡的是NaHCO3
滴加盐酸开始不产生气泡的是Na2CO3
Na2CO3和NaHCO3
4. 鉴别与除杂
探索 新知
(2)除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3固体)
Na2CO3溶液(NaHCO3)
NaHCO3溶液(Na2CO3)
加热
通入足量的CO2气体
加入适量的NaOH溶液
原则:① 不增加新杂质 ② 不减少被提纯物质 ③简便,易操作
总结 提升
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名
离子组成及个数比
相对分子质量
外观(色、态)
与少量水混合
溶解性 等浓度溶液的碱性
用途
细小的白色晶体
白色粉末
Na+ :CO32- = 2 : 1
Na+ :HCO3- = 1 : 1
纯碱或苏打
小苏打
106
84
结晶,伴随放热现象
( Na2CO3+10H2O = Na2CO3 10H2O )
溶解,伴随吸热现象
强(使酚酞变红)
弱(使酚酞变浅红)
均易溶于水,溶解度:Na2CO3 > NaHCO3
制肥皂、玻璃
胃药、灭火剂、发酵粉
总结 提升
Na2CO3 NaHCO3
稀盐酸滴入溶液中
溶液滴入稀盐酸中
与BaCl2溶液反应
热稳定性
相互转化 开始无明显现象,随后有气泡
CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO2↑
立即产生气泡
HCO3- + H+ = H2O + CO2↑
立即产生气泡,速率较慢
CO32- + 2H+ = H2O + CO2↑
立即产生气泡,速率较快
HCO3- + H+ = H2O + CO2↑
有白色沉淀产生
CO32- + Ba2+ = BaCO3↓
无明显现象
受热不分解
受热分解
2NaHCO3 = Na2CO3+H2O+CO2 ↑
Na2CO3
NaHCO3
(2)少量盐酸
(1)通过量CO2
(1)加热
(2)少量NaOH 或少量Ca(OH)2
2.1.3 碳酸钠和碳酸氢钠
(钠及其化合物 第3课时)
第二节
第二章 海水中的重要元素—— 钠和氯
人教版 必修 1
2022.10.21
情景 引入
Na2CO3和NaHCO3的广泛应用
观察 思考
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名
离子组成及个数比
相对分子质量
外观(色、态)
与少量水混合
溶解性 等浓度溶液的碱性
用途
1.物理性质
Na2CO3和NaHCO3
细小的白色晶体
白色粉末
Na+ :CO32- = 2 : 1
Na+ :HCO3- = 1 : 1
纯碱或苏打
小苏打
106
84
结晶 ( Na2CO3+10H2O = Na2CO3 10H2O )
伴随放热现象
溶解,伴随吸热现象
强
弱
均易溶于水,溶解度:Na2CO3 > NaHCO3
制肥皂、玻璃
胃药、灭火剂、发酵粉
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(1)与盐酸反应
Na2CO3
少量盐酸
过量盐酸
CO32- + H+ = HCO3-
Na2CO3 + HCl == NaHCO3 + NaCl
Na2CO3 + 2HCl == 2NaCl+H2O +CO2↑
CO32- + 2H+ = H2O + CO2↑
NaHCO3 +HCl===NaCl+H2O+CO2↑
NaHCO3
HCO3- + H+ = H2O + CO2↑
CO32-
HCO3-
H2CO3
将盐酸逐滴加入Na2CO3溶液和NaHCO3溶液中
现象:无明显现象
现象:有气泡产生
现象:立即有气泡产生
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(1)与盐酸反应
Na2CO3
Na2CO3 + 2HCl == 2NaCl+H2O +CO2↑
CO32- + 2H+ = H2O + CO2↑
NaHCO3 +HCl===NaCl+H2O+CO2↑
NaHCO3
HCO3- + H+ = H2O + CO2↑
分别将Na2CO3溶液和NaHCO3溶液逐滴加入盐酸中
现象:产生气泡速率较慢
现象:产生气泡速率较快
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(2)与碱反应
①与Ca(OH)2反应
Na2CO3
NaHCO3
少量Ca(OH)2
过量Ca(OH)2
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
CO32- + Ca2+ = CaCO3↓
Ca2++OH-+HCO3- ===CaCO3↓+H2O
Ca2++2OH-+2HCO3- ===CaCO3↓+2H2O+CO32-
现象:产生白色沉淀
现象:产生白色沉淀
现象:产生白色沉淀
②与NaOH反应
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(2)与碱反应
Na2CO3
NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
HCO3- + OH- = H2O + CO32-
不反应
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(3)与CO2反应
不反应
Na2CO3
NaHCO3
Na2CO3+H2O+CO2 = 2NaHCO3
CO32- + CO2 + H2O = 2HCO3-
【思考】往饱和Na2CO3溶液中通入过量CO2,会有何现象?
有白色固体析出
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(4)与可溶性钙盐(钡盐)反应
Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl
CO32- + Ba2+ = BaCO3↓
不反应
Na2CO3
NaHCO3
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
CO32- + Ca2+ = CaCO3↓
Na2CO3和NaHCO3
2. 化学性质
探索 新知
(5)热稳定性
2NaHCO3 = Na2CO3+H2O+CO2 ↑
Na2CO3 > NaHCO3
Na2CO3和NaHCO3
3.相互转化
归纳 总结
Na2CO3
NaHCO3
(2)少量盐酸
(1)通过量CO2
(1)加热
(2)少量NaOH 或少量Ca(OH)2
(2) Na2CO3 + HCl=== NaHCO3 + NaCl
(1) Na2CO3+H2O+CO2 = 2NaHCO3
(1) 2NaHCO3 = Na2CO3+H2O+CO2 ↑
(2) Ca(OH)2+2NaHCO3 ===CaCO3↓+2H2O+Na2CO3
(2) NaHCO3 + NaOH = Na2CO3 + H2O
Na2CO3和NaHCO3
4. 鉴别与除杂
归纳 总结
(1)鉴别
溶液
BaCl2溶液或CaCl2溶液
产生白色沉淀的是Na2CO3
不产生白色沉淀的是NaHCO3
①利用阴离子的不同
【思考】能否用加入Ba(OH)2溶液的方法鉴别Na2CO3和NaHCO3?
不能,均会产生白色沉淀
Na2CO3和NaHCO3
4. 鉴别与除杂
归纳 总结
(1)鉴别
固体
加热
② 利用热稳定性的不同
无明显变化的是Na2CO3
放出无色无味的使澄清石灰水变浑浊的气体是NaHCO3
【思考】能否用加热溶液,观察有无气泡产生的方法鉴别Na2CO3和NaHCO3?
不能,均无明显现象
Na2CO3和NaHCO3
4. 鉴别与除杂
归纳 总结
(1)鉴别
③ 利用与酸反应现象的不同
固体
(或溶液)
盐酸
产生气泡速率快的是NaHCO3
反应速率
逐滴加入盐酸
产生气泡速率慢的是Na2CO3
滴加盐酸立即产生气泡的是NaHCO3
滴加盐酸开始不产生气泡的是Na2CO3
Na2CO3和NaHCO3
4. 鉴别与除杂
探索 新知
(2)除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3固体)
Na2CO3溶液(NaHCO3)
NaHCO3溶液(Na2CO3)
加热
通入足量的CO2气体
加入适量的NaOH溶液
原则:① 不增加新杂质 ② 不减少被提纯物质 ③简便,易操作
总结 提升
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名
离子组成及个数比
相对分子质量
外观(色、态)
与少量水混合
溶解性 等浓度溶液的碱性
用途
细小的白色晶体
白色粉末
Na+ :CO32- = 2 : 1
Na+ :HCO3- = 1 : 1
纯碱或苏打
小苏打
106
84
结晶,伴随放热现象
( Na2CO3+10H2O = Na2CO3 10H2O )
溶解,伴随吸热现象
强(使酚酞变红)
弱(使酚酞变浅红)
均易溶于水,溶解度:Na2CO3 > NaHCO3
制肥皂、玻璃
胃药、灭火剂、发酵粉
总结 提升
Na2CO3 NaHCO3
稀盐酸滴入溶液中
溶液滴入稀盐酸中
与BaCl2溶液反应
热稳定性
相互转化 开始无明显现象,随后有气泡
CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO2↑
立即产生气泡
HCO3- + H+ = H2O + CO2↑
立即产生气泡,速率较慢
CO32- + 2H+ = H2O + CO2↑
立即产生气泡,速率较快
HCO3- + H+ = H2O + CO2↑
有白色沉淀产生
CO32- + Ba2+ = BaCO3↓
无明显现象
受热不分解
受热分解
2NaHCO3 = Na2CO3+H2O+CO2 ↑
Na2CO3
NaHCO3
(2)少量盐酸
(1)通过量CO2
(1)加热
(2)少量NaOH 或少量Ca(OH)2
