化学人教版(2019)必修第一册1.2.1 电解质的电离 课件(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.1 电解质的电离 课件(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 621.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-23 09:39:17 | ||
图片预览






文档简介
(共20张PPT)
电解质的电离
我们应该都遇到过这样一种情况:
湿手触摸电器会导致触电,但小鸟在高压电线上筑巢确一点也没事,这是为什么呢?这是因为水能导电吗?
联系生活实际
实验与思考
实验三:蒸馏水的导电性演示实验
蒸馏水(纯水)能不能导电?是不是电解质?
所以蒸馏水是电解质,但是其导电的能力非常弱,不足以让小灯泡发亮。
说明蒸馏水中存在自由移动的离子,蒸馏水能导电。
资料补充: 25℃,在5.56x108个水分子中有一个分子发生电离。
1
思考与交流
为什么NaCl在干燥时不导电,而溶于水或者熔化后却能导电?
导电原理分析
导电原理分析
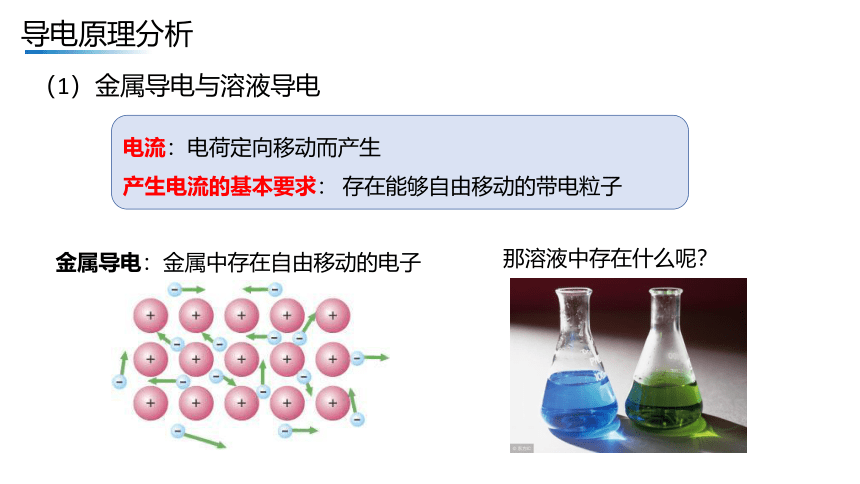
(1)金属导电与溶液导电
电流:电荷定向移动而产生
产生电流的基本要求: 存在能够自由移动的带电粒子
金属导电:金属中存在自由移动的电子
那溶液中存在什么呢?
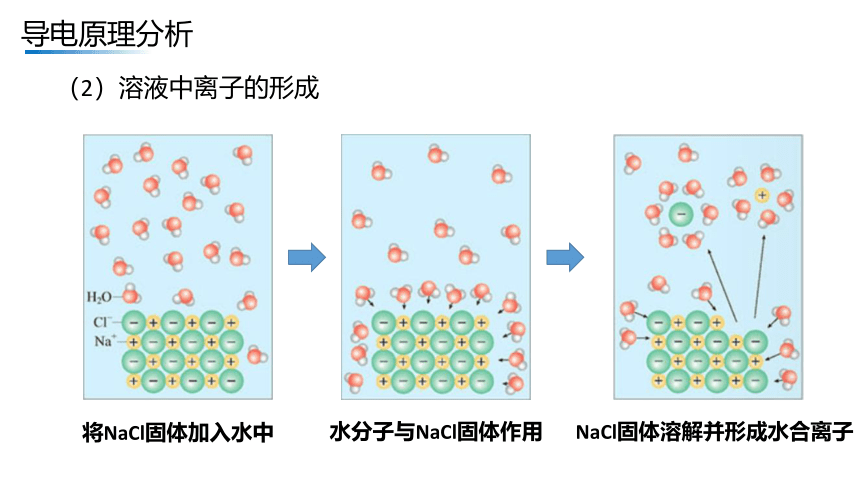
(2)溶液中离子的形成
将NaCl固体加入水中
水分子与NaCl固体作用
NaCl固体溶解并形成水合离子
导电原理分析
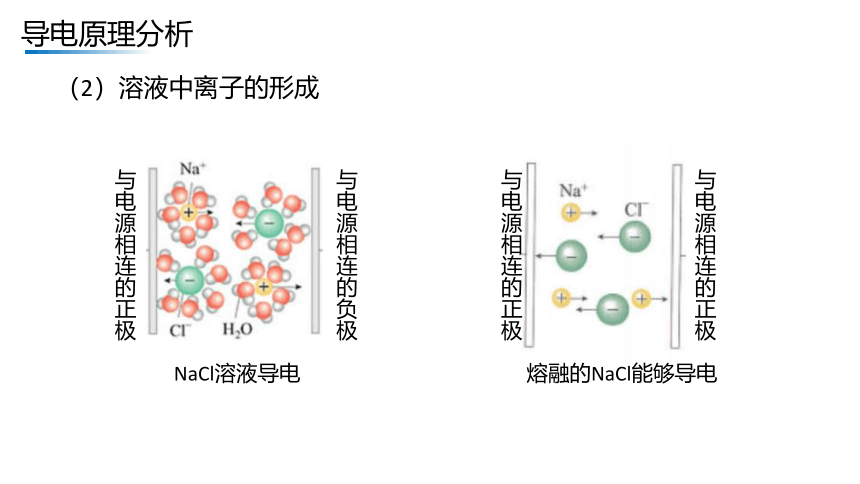
(2)溶液中离子的形成
与电源相连的正极
与电源相连的负极
NaCl溶液导电
导电原理分析
与电源相连的正极
与电源相连的正极
熔融的NaCl能够导电
电解质:在水溶液或熔融状态下可以导电的化合物
对象:化合物
电解质导电前提:在水溶液或熔融状态
酸
碱
物质类别: 盐
金属氧化物
水
知道了电解质的概念,你能举一反三写出非电解质的概念吗?
非电解质:在水溶液和熔融状态下都不导电的化合物。
物质类别:
大部分非金属氧化物:如二氧化碳、二氧化硫等;
部分非金属氢化物:如NH3、PH3、CH4等
大部分有机物:如乙醇、蔗糖等
课堂练习:学与测第3题
电解质的电离
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
(1)电离
注意:电离不需要通电,电离是受水分子作用或受高温作用的,产生离子的过程。
1、同等条件下,所有的电解质导电能力都一样吗?
2、同浓度的盐酸与醋酸相比,谁的导电性更强?
3、导电能力强弱由什么决定?
深度思考
资料补充: 25℃,在5.56x108个水分子中只有一个分子发生电离。
电解质的分类
说明水分子不能完全电离,是弱电解质。
弱电解质:在水溶液里只能部分电离出离子的电解质。
包括弱酸、弱碱、水。
强电解质:在水溶液里能完全电离出离子的电解质。包括强酸、强碱、大多数盐。
溶液的导电能力的强弱与什么因素有关呢?
离子的浓度:当离子所带电荷数相同时,离子浓度越大,导电能力越强。
离子所带电荷数:当离子浓度相同时,所带电荷数越多,导电能力越强。
NaCl
Na+ + Cl-
在水溶液中电离
(2)电离方程式
电离方程式:用化学式和离子符号表示电解质电离的过程。
书写时候要注意什么事项?
基本原则:
1、质量守恒
2、电荷守恒
3、强电解质用 ==,弱电解质用可逆符号“ ”
试着写出硫酸氢钠在水溶液和熔融状态下的电离方程式
水溶液:
NaHSO4==Na++H++SO42-
熔融状态:
NaHSO4==Na++HSO4-
能否试着写出盐酸、硫酸、硝酸的电离方程式?
HCl === H+ + Cl-
H2SO4 === 2H++SO42-
HNO3 === H++NO3-
酸:电离出的阳离子全是H+
能否试着写出氢氧化钠、氢氧化钾、氢氧化钡的电离方程式?
NaOH === Na+ + OH-
KOH === K++OH-
Ba(OH)2=Ba++2OH-
碱:电离出的阴离子全是OH-
能否试着写出氯化钠、氯化铵、硝酸钾的电离方程式?
盐:金属阳离子(包括铵根NH4+)以及酸根阴离子
NaCl === Na+ + Cl-
NH4CI === NH4++CI-
KNO3 === K++NO3-
盐:金属阳离子(包括铵根NH4+)以及酸根阴离子
NaCl === Na+ + Cl-
NH4CI === NH4++CI-
KNO3 === K++NO3-
NaOH === Na+ + OH-
KOH === K++OH-
Ba(OH)2=Ba++2OH-
碱:电离出的阴离子全是OH-
盐:金属阳离子(包括铵根NH4+)以及酸根阴离子
(3)从电离角度认识酸碱盐
HCl === H+ + Cl-
H2SO4 === 2H++SO42-
HNO3 === H++NO3-
酸:电离出的阳离子全是H+
电解质的电离
我们应该都遇到过这样一种情况:
湿手触摸电器会导致触电,但小鸟在高压电线上筑巢确一点也没事,这是为什么呢?这是因为水能导电吗?
联系生活实际
实验与思考
实验三:蒸馏水的导电性演示实验
蒸馏水(纯水)能不能导电?是不是电解质?
所以蒸馏水是电解质,但是其导电的能力非常弱,不足以让小灯泡发亮。
说明蒸馏水中存在自由移动的离子,蒸馏水能导电。
资料补充: 25℃,在5.56x108个水分子中有一个分子发生电离。
1
思考与交流
为什么NaCl在干燥时不导电,而溶于水或者熔化后却能导电?
导电原理分析
导电原理分析
(1)金属导电与溶液导电
电流:电荷定向移动而产生
产生电流的基本要求: 存在能够自由移动的带电粒子
金属导电:金属中存在自由移动的电子
那溶液中存在什么呢?
(2)溶液中离子的形成
将NaCl固体加入水中
水分子与NaCl固体作用
NaCl固体溶解并形成水合离子
导电原理分析
(2)溶液中离子的形成
与电源相连的正极
与电源相连的负极
NaCl溶液导电
导电原理分析
与电源相连的正极
与电源相连的正极
熔融的NaCl能够导电
电解质:在水溶液或熔融状态下可以导电的化合物
对象:化合物
电解质导电前提:在水溶液或熔融状态
酸
碱
物质类别: 盐
金属氧化物
水
知道了电解质的概念,你能举一反三写出非电解质的概念吗?
非电解质:在水溶液和熔融状态下都不导电的化合物。
物质类别:
大部分非金属氧化物:如二氧化碳、二氧化硫等;
部分非金属氢化物:如NH3、PH3、CH4等
大部分有机物:如乙醇、蔗糖等
课堂练习:学与测第3题
电解质的电离
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
(1)电离
注意:电离不需要通电,电离是受水分子作用或受高温作用的,产生离子的过程。
1、同等条件下,所有的电解质导电能力都一样吗?
2、同浓度的盐酸与醋酸相比,谁的导电性更强?
3、导电能力强弱由什么决定?
深度思考
资料补充: 25℃,在5.56x108个水分子中只有一个分子发生电离。
电解质的分类
说明水分子不能完全电离,是弱电解质。
弱电解质:在水溶液里只能部分电离出离子的电解质。
包括弱酸、弱碱、水。
强电解质:在水溶液里能完全电离出离子的电解质。包括强酸、强碱、大多数盐。
溶液的导电能力的强弱与什么因素有关呢?
离子的浓度:当离子所带电荷数相同时,离子浓度越大,导电能力越强。
离子所带电荷数:当离子浓度相同时,所带电荷数越多,导电能力越强。
NaCl
Na+ + Cl-
在水溶液中电离
(2)电离方程式
电离方程式:用化学式和离子符号表示电解质电离的过程。
书写时候要注意什么事项?
基本原则:
1、质量守恒
2、电荷守恒
3、强电解质用 ==,弱电解质用可逆符号“ ”
试着写出硫酸氢钠在水溶液和熔融状态下的电离方程式
水溶液:
NaHSO4==Na++H++SO42-
熔融状态:
NaHSO4==Na++HSO4-
能否试着写出盐酸、硫酸、硝酸的电离方程式?
HCl === H+ + Cl-
H2SO4 === 2H++SO42-
HNO3 === H++NO3-
酸:电离出的阳离子全是H+
能否试着写出氢氧化钠、氢氧化钾、氢氧化钡的电离方程式?
NaOH === Na+ + OH-
KOH === K++OH-
Ba(OH)2=Ba++2OH-
碱:电离出的阴离子全是OH-
能否试着写出氯化钠、氯化铵、硝酸钾的电离方程式?
盐:金属阳离子(包括铵根NH4+)以及酸根阴离子
NaCl === Na+ + Cl-
NH4CI === NH4++CI-
KNO3 === K++NO3-
盐:金属阳离子(包括铵根NH4+)以及酸根阴离子
NaCl === Na+ + Cl-
NH4CI === NH4++CI-
KNO3 === K++NO3-
NaOH === Na+ + OH-
KOH === K++OH-
Ba(OH)2=Ba++2OH-
碱:电离出的阴离子全是OH-
盐:金属阳离子(包括铵根NH4+)以及酸根阴离子
(3)从电离角度认识酸碱盐
HCl === H+ + Cl-
H2SO4 === 2H++SO42-
HNO3 === H++NO3-
酸:电离出的阳离子全是H+
