第四单元课题4 化学式与化合价课件-2022-2023学年九年级化学人教版上册(共57张PPT)
文档属性
| 名称 | 第四单元课题4 化学式与化合价课件-2022-2023学年九年级化学人教版上册(共57张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-23 16:57:50 | ||
图片预览









文档简介
(共57张PPT)
课题4 化学式与化合价
H2O
水
第一课时 化学式
第二课时 化合价
第三课时 化学式的计算
+1 -2
1.掌握化学式及其含义,会读会写,能用化学式表示某些常见物质的组成。
2.了解化合价的含义,并熟记常见元素及原子团的化合价,会用正确书写元素化合价。
3.能用化学式表示物质的组成,并能利用化合价推求化学式。
4.了解相对分子质量的含义,并能利用相对原子质量进行有关简单计算。
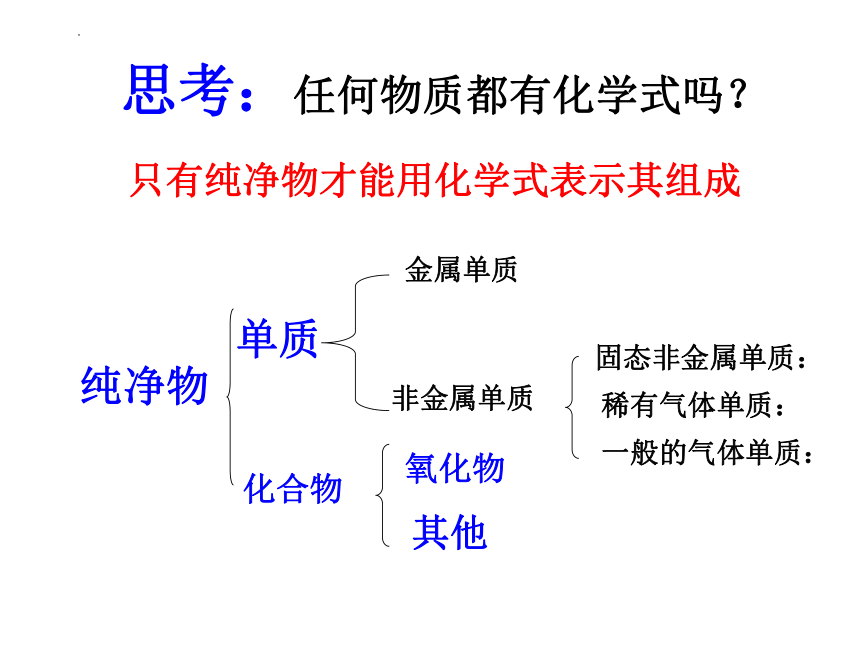
纯净物
单质
化合物
氧化物
其他
金属单质
稀有气体单质:
固态非金属单质:
非金属单质
思考:任何物质都有化学式吗?
只有纯净物才能用化学式表示其组成
一般的气体单质:
一、化学式
用元素符号和数字的组合表示物质组成的式子,叫做化学式。
1、定义:
比一比,赛一赛:看谁能把这些物质的化学符号又快又好的表示出来?
水 氢气 二氧化碳 氯化钠 四氧化三铁
H2O H2 CO2 NaCl Fe3O4
观察与思考:这些物质的化学符号表示
有什么特点?
2.化学式的写法:
(1).单质化学式的写法:
铁 铝
硫 磷
氖气 氦气 氩气
氧气 氢气
氮气 氯气
Ne
He
Fe
Al
S
P
O2
H2
N2
Cl2
稀有气体单质:
金属单质:
固态非金属单质:
非金属气体单质:
2、稀有气体单质、非金属气体单质的写法有什么不同?为什么?
②用“Xn”表示
Ar
①用元素符号表示化学式
比一比,赛一赛:看谁能把这些物质的化学式又快又好的表示出来?
观察与思考:
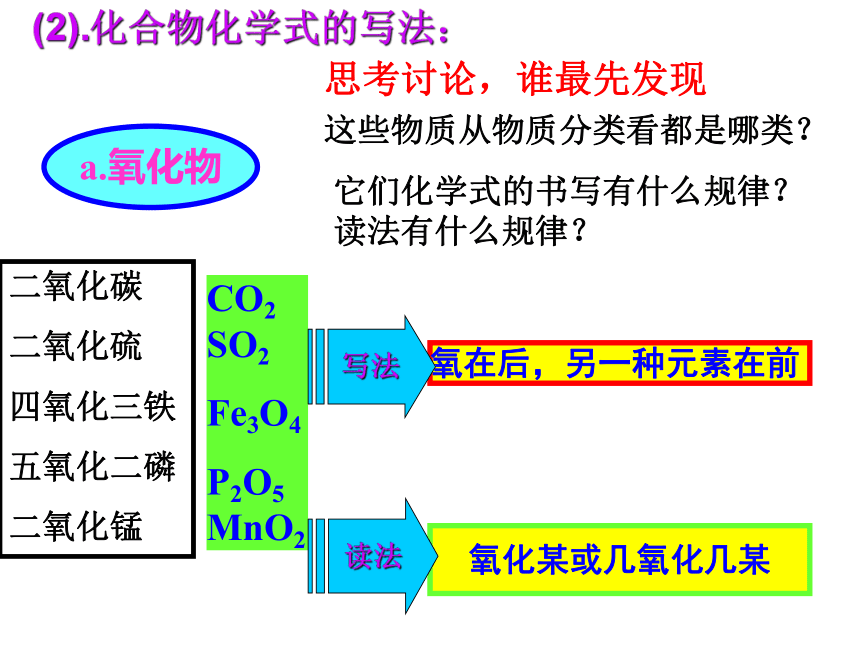
1、这些物质从物质分类看都是哪类?它们化学式的书写有什么规律?
(2).化合物化学式的写法:
a.氧化物
CO2 SO2
Fe3O4
P2O5 MnO2
氧在后,另一种元素在前
氧化某或几氧化几某
读法
写法
二氧化碳
二氧化硫
四氧化三铁
五氧化二磷
二氧化锰
思考讨论,谁最先发现
它们化学式的书写有什么规律?
读法有什么规律?
这些物质从物质分类看都是哪类?
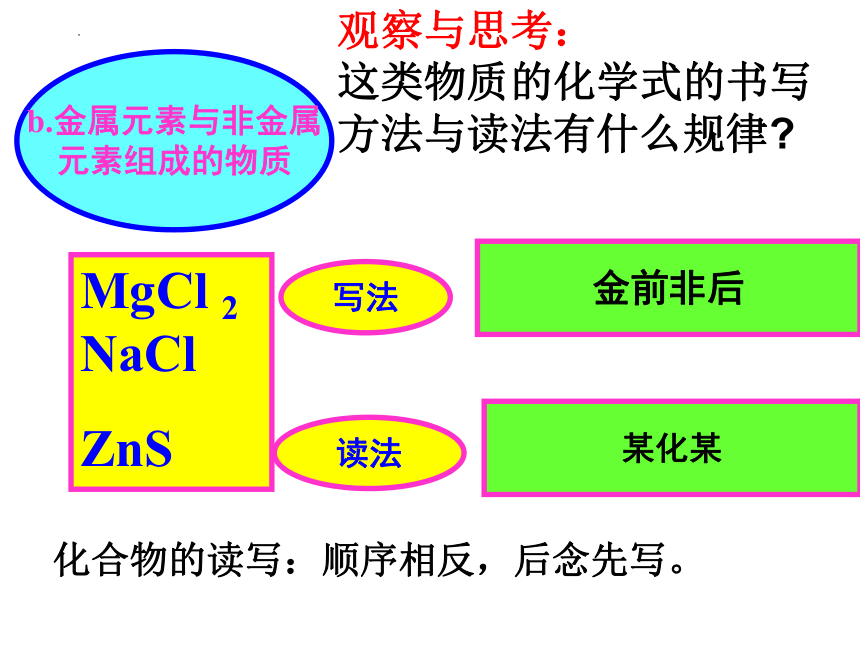
b.金属元素与非金属
元素组成的物质
MgCl 2 NaCl
ZnS
写法
金前非后
读法
某化某
化合物的读写:顺序相反,后念先写。
观察与思考:
这类物质的化学式的书写方法与读法有什么规律
纯净物
单质
化合物
氧化物
金属元素与非金属元素组成
金属单质
化学式
稀有气体单质:
固态非金属单质:
非金属气体单质:
用元素符号表示化学式.
用“Xn”表示
归纳与整理:
氧在后,另一种元素在前
写法
读法
氧化某或几氧化几某
写法
读法
金前非后
某化某或几化几某
化合物的读写顺序相反。
写出下列物质的化学式
铜 磷 氦气 四氧化三铁 氯化钠
Cu P He Fe3O4 NaCl
Au S Ne HgO KCI
读出下列物质的名称
金
硫
氖气
氧化汞
氯化钾
1、判断下列化学式的书写是否正确,如果不正确请说出为什么。
O5P2
ClNa
H2O1
2、下列物质读法正确的是( )
A N2O5 二氧化五氮
B KCl 钾化氯
C Fe2O3 三氧化二铁
C
考考你
只有纯净物才能用化学式表示其组成
化学式的书写必须依据实验的结果,不能随意写。
①任何物质都有化学式吗?
②同种物质可以有不同的化学式吗?
一种物质只能用一个化学式来表示
③化学式可以任意的书写吗?
想一想
猜一猜
这款化妆品最有可能属于下列哪种类型的产品:( )
A.祛皱型
B.美白型
C.保湿型
C
从化学式中能够得到哪些信息例:H2O表示的意义:
表示水这种物质
表示一个水分子
表示水由氢元素和氧元素组成
表示一个水分子由2个氢原子和1个氧原子构成
宏观意义
微观意义
O
H
H
1、化学式的意义(由分子构成的)
(1)表示一种物质。
(2)表示该物质由哪几种元素组成。
(3)表示物质的一个分子。
(4)表示该分子由哪些原子构成
观宏
观微
CO2
二氧化碳
二氧化碳由碳元素和氧元素组成
一个二氧化碳分子
一个二氧化碳分子由一个碳原子和两个氧原子构成
试一试
由分子构成的物质的化学式有四层意义,由原子或离子构成物质的化学式有哪些意义呢?
(1)表示一种物质。
(2)表示该物质由哪几种元素组成
(3)表示该物质由哪些原子
(或离子)构成。
如NaCl
H2O
2
表示2个水分子
表示每个水分子中有2个氢原子
2.化学式前面的数字表示分子个数。
注意:
1.化学式中元素符号右下角的数字表示每个分子中含有的原子个数。
?
探究这些阿拉伯数字的意义:
2C
2个碳原子
2H2O
2个水分子
2Al3+
每个铝离子带3
个单位的正电荷
2个铝离子
每个水分子里
有2个氢原子
归纳与整理:
如何表示
离子符号
如何表示几个原子、 几个分子、 几个离子?
n 离子符号
一种元素
一个原子
一种物质
一个分子
一种离子
一个离子
元素符号
化学式
n元素符号
n化学式
C
SO2
Mg2+
4C
5SO2
7Mg2+
注:符号前有数字,只表示几个微粒, 只有微观含义。(只有一个意义)
① H 表示氢元素,表示一个氢原子。
③ H2 表示氢气这种物质;
氢气是由氢元素组成;
一个氢分子;
一个氢分子由2个氢原子构成。
④ 2H2 表示两个氢分子
符号H、2H、H2、2H2各具有什么意义?
② 2H 表示2个氢原子。
2、将下列化学符号与其对应的示意图配对(填序号)
A、2O ①
B、O2 ②
C、2O2 ③
答:A与 ;B与 ;C与——。
课堂反馈练习
③
①
②
例 下列各符号中数字“2”表示的意义不正确的是( )
A.Fe2+:一个铁离子带两个单位的正电荷
B.N2:一个氮分子由两个氮原子构成
C.2Hg:两个汞原子
D.2NO3-:两个硝酸根离子
课堂教学展示
典例剖析
A
×
√
√
√
亚铁离子
1、下列符号N、N2、2N、2N2中
(1)既能表示氮气,又能表示一个氮分子的是 。(2)既能表示氮元素,又能表示一个氮原子的是 。(3)只能表示2个氮原子的是 。
(4)只能表示2个氮分子的是 。
N2
N
2N
练一练
2N2
2. 用元素符号或化学式填空
(1)4个二氧化碳分子
(2)7个铁原子
(3)1个氧离子
4CO2
7Fe
O2-
2、下列化学符号中,数字3表示的意义是
﹙填序号﹚
A、3H B、Al3+ C、3 Mg2+
D、O3 E、3O2
分子个数__ 原子个数__
离子个数__
一个分子中含某原子个数__
离子所带电荷数__
E
D
C
B
A
水 H2O
五氧化二磷 P2O5
二氧化碳 CO2
观察下列物质的化学式
?
为什么在以上三种物质的分子中原子个数比会不同?
实验测定 化学式的书写必须依据实验的结果
?
?
第二课时 化 合 价
观察一些物质组成元素的原子个数比
物质 HCl H2O NaCl Fe2O3
原子个数比 1∶1 2∶1 1∶1 2∶3
化学上用“化合价”来表示原子之间相互化合的数目。
化合价的表示方法:O Mg
-2
+2
在元素的上方写+或-号,后面加数值,注意1不能省略
问:元素的化合价由什么决定?
该元素原子的最外层电子数
你的发现:
不同元素间形成化合物,它们的原子相互化合时,具有确定的原子个数比。
二.化合价
Na+
2
8
+11
1
Na
2
8
+11
2
8
7
Cl
+17
Cl-
交流与讨论:氯化钠(NaCl)的化学式能否写成NaCl2?
钠原子能达到稳定结构,只有一个氯原子达到稳定结构,最终不能形成稳定化合物NaCl2 。
2
8
7
Cl
+17
2
8
8
+17
2
8
7
Cl
+17
一、元素的化合价怎样规定?
元素化合价由该元素原子最外层电子数决定.
Mg
2
8
+12
2
Mg
+2
O
2
6
+8
Al
2
8
+13
3
Al
+3
-2
O
用此方法判断(Na、Ca、Cl、S、的化合价)(参考课本54 85页)
例如:已知A、B元素原子最外层电子数分别为7、3,则A、B元素的化合价为 , 。
元素 元素符号 常见化合价 元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氯 Cl -1.+1.+5.+7
钙 Ca +2 溴 Br -1
镁 Mg +2 氧 O -2
钡 Ba +2 硫 S -2 +4 +6
铜 Cu +1、+2 碳 C +2、+4
铁 Fe +2、+3 硅 Si +4
铝 Al +3 氮 N -3.+2.+4.+5
锰 Mn +2.+4.+6.+7 磷 P -3、+3、+5
锌 Zn +2 非金属元素的化合价
金属元素跟非金属化合时,
非金属元素显负价。
金属元素的化合价
金属元素跟非金属化合时,
金属元素显正价。
离子符号 Na+ Mg2+ Al3+ F- O2-
化合价 Na Mg Al F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”“-”号在后;写在右上角。
化合价:数字在后,“+”“-”号在前;写在正上方。
化合价与离子所带电荷的联系:数字相同,正负号相同
比较并找规律
离子符号与化合价的比较:
原子团:作为一个整体参加反应的原子集团(就好像一个原子一样),原子团也叫做根。但有时也会被破坏,如氯酸钾(KClO3)中的氯酸根(ClO3-)在加热分解时被破坏。
注意:①原子团不能单独存在;
②带电荷的原子团也是离子,原子团的化合价是其组成元素的化合价的代数和,不为零。
NaOH、 Ca(OH)2 、Cu(NO3)2、NH4NO3、BaSO4、CaCO3、 H3PO4 KMnO4 K2MnO4
根:
离子:
OH-:
CO32-:
NH4+:
NO3- :
SO42-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
MnO4-:高锰酸根离子
MnO42-:锰酸根离子
PO43-:磷酸根离子
ClO3-:氯酸根离子
原 子 团 的 化 合 价
NaOH、Ca(OH)2、Cu(OH)2、Fe(OH)3
读氢氧化某
H2CO3、H2SO4、HNO3
根的名称 根的符号 常见化合价
氢氧根 OH- -1
硝酸根 NO3- -1
硫酸根 SO42- -2
碳酸根 CO32- -2
铵根 NH4+ +1
读某酸[中间元素的名称]
读某[酸根]酸某
CaCO3、CuSO4、NaNO3
(1)在任何化合物里,正负化合价的代数和为零。
(2)在化合物里氢通常显+1价,氧通常显-2价。
(3)在化合物里金属元素通常显正价,非金属元素通常显负价。
(4)单质里元素的化合价为零。
(5)许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价,如:FeO,Fe2O3中铁元素的化合价分别为+2和+3。极个别元素在同种物质中也显不同的化合价.如NH4NO3
1、化合价的有关规律
-3
+5
在确定元素的化合价时,需要注意以下几点:
化 合 价 的 法 则
一些常见元素化合价口诀
钾钠氢银正一价,钙镁钡锌正二价。
氟氯一般负一价,通常氧显负二价。铁正二正三铝正三,莫忘单质价为0.
一些常见原子团的化合价
负一硝酸氢氧根 负二硫酸碳酸根
正一价的是铵根
(1)根据化学式求某一元素化合价
原则:化合物里正负化合价的代数和为零
例1:试确定氯酸钾(KClO3)中氯元素的化合价
解:设氯元素的化合价为x,则
(+1)+ x +(-2)×3=0
x = +5
所以,在氯酸钾中,氯元素的化合价为+5价
2、化学式与化合价的关系
练习:1.已知X、Y、Z的化合价分别为+1、+6、
-2,则由X、Y、Z组成的化合物的化学式可能是( )
A、 XYZ
D、X2Y3Z
B、XY2Z3
C、X2YZ4
C
2.加碘食盐中含有碘酸钾KIOx,已知碘酸钾中K为+1价,I为+5价,O为-2价,则其化学式中X的数值为( )
A、 1
D、4
B、2
C、3
C
推求下列原子团(根)的化合价:
原子团的化合价
NaNO3、 NH4NO3、 NaOH、
H2SO4、 Na2CO3、 H3PO4
+1
-1
-1
+1
+1
+1
+1
+1
-1
-2
-2
-3
推求的依据:化合物中元素的化合价代数和为0。
注:在原子团中,各元素化合价代数和为原子团的化合价,一定不为0
化 合 价 的 计 算
1.已知氧为-2价,铝为+3价,如何计算Al2(SO4)3中硫的化合价?
【思路】
依据:在化合物里正负化合价的代数和为零。
设未知数
解:设硫的化合价为x
列等式(正负总价和为0)
+3×2+3x+(-2)×4 ×3 =0
解 答
x = +6
答: Al2(SO4)3里的硫的化合价为+6价。
练习:P89 3、4、
(2)根据化合价求化学式
步骤:(数字交叉法)
① 写符号
② 标化合价
③ 化合价绝对值交叉放置在元素符号右下角
④ 约简
⑤ 检查
例2 已知磷元素有两种氧化物,其中磷的化合价分别为+3和+5,写出这两种磷的氧化物的化学式
【思路】
(1)先写元素符号(正前负后)
(2)标出各元素的化合价(正上)
(3)把化合价数值化为最简
(4)把化简后的数字交叉写出(求最小公倍数)
P O
P O
+3 -2
P O
P2O3
P O
P2O5
+3 -2
+3 -2
P2O3
P O
+5 -2
P O
+ 5 -2
省略
P2O5
+ 5 -2
化 合 价 的 计 算 小 结
Fe2(SO4)3
小 结
数字交叉法书写化学式的一般步骤:
①写出组成的元素符号:先写正价,后写负价
②标出元素的化合价;
③定原子或原子团个数:
化合价的绝对值斜交叉下来得个数;
能约简的要先约简再交叉;
有2个以上原子团要加括号;
右下角数字是“1”的省略不写;
思路:先正 后负 化简 交叉
练习:P89 5、6
问:如果碰到有原子团的化学式又怎样书写呢?如已知铁为+3价,硫酸根(SO42-)为-2价,写出硫酸铁的化学式。
化 合 价 的 计 算
练一练P87
2.写出溴化钠、氯化钙、氧化铝、二氧化氮的化学式。
NaBr CaCl2 Al2O3 NO2
3.读出以下化学式的名称:
MnO2 CuO SO3 KI NaNO3
二氧化锰 氧化铜 三氧化硫 碘化钾 硝酸钠
相对分子质量的理解
三、有关相对分子质量的计算
H2O的意义:1个水分子是由2个氢原子和1个氧原子构成的。
真实质量:1个水分子的质量=2个氢原子质量+1个氧原子的质量
相对质量:1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量
所以H2O的相对分子质量=1×2+16×1=18
定义:化学式中各原子的相对原子质量的总和,就是相对分子质量。
相 对 分 子 质 量 的 计 算
化学式中各原子的相对原子质量总和
H2O的相对分子质量=1×2+16=18
O2的相对分子质量=16×2=32
相对分子质量 = 某元素的相对原子质量×原子个数+另一种元素的相对原子质量×原子个数+……
CO2
NH4NO3
Cu2(OH)2CO3
12+16×2=44
14+1×4+14+16×3=80
64×2+(16+1)×2+12+16×3=222
1、计算相对分子质量(Mr):
例:计算 (NH4)2SO4的相对分子质量
【解】(NH4)2SO4的相对分子质量
=(14+1×4)×2+32+16×4=132
算一算
请同学们计算下列物质的相对分子质量或相对分子质量总和。
⑴氢氧化钙[Ca(OH)2];
⑵CuSO4·5H2O
⑶5P2O5
相 对 分 子 质 量 的 计 算
2、计算物质组成元素的质量比
物质组成元素的质量比 = 某元素的相对原子质量×原子个数∶另一种元素的相对原子质量×原子个数+……
如:二氧化碳[CO2]中碳元素和氧元素的质量比等于
12 ∶ (16×2)= 3 ∶ 8
H2O
KMnO4
NH4NO3
Cu2(OH)2CO3
H:O=1 ∶ 8
K:Mn:O=39 ∶ 55 ∶ 64
N:H:O=7 ∶ 1 ∶ 12
Cu:O:H:C=64 ∶ 40 ∶ 1 ∶ 6
2.计算物质组成元素的质量比
各元素之间的质量比=各原子的相对原子质量总和之比
例:求Fe2O3中铁元素和氧元素的质量比。
Fe2O3中铁元素和氧元素的质量比
Fe:O=(56×2):(16×3)=112:48=7:3
相 对 分 子 质 量 的 计 算
3、计算物质中某元素的质量分数
例1:求硝酸铵[NH4NO3]中氮元素的质量分数?
NH4NO3的相对分子质量 =14+1 × 4+14+16 × 3=80
氮元素的质量分数= × 100%
N的相对原子质量× N的原子个数
NH4NO3的相对分子质量
= × 100%=35%
14 × 2
80
3.计算物质中某元素的质量分数
某元素的质量分数=
该元素相对原子质量×原子个数
化合物的相对分子质量
× 100﹪
注意事项:
①质量分数——用百分数来表示
该元素的质量与组成物质的元素总质量之比。(每100克该物质中含有某元素的质量)
②意义:
例2:⑴计算二氧化硫中硫元素的质量分数
⑵计算64t二氧化硫中含硫元素的质量。
解:⑴SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
⑵ 64t二氧化硫中含硫元素的质量=64t×50%=32t
元素质量=物质质量 × 化学式中元素质量分数
已知元素质量如何求物质质量
1.多少克水中含氢元素4g?
2.要炼56吨铁需Fe2O3多少吨?
练一练
想一想
小结:
相对分子质量是化学式中各原子的相对原子质量总和。它的符号是Mr,单位是一,一般不写。
⑴计算相对分子质量
相对分子质量=相对原子质量×个数之和
⑵计算组成物质元素的质量比
元素的质量比=此元素相对原子质量×个数之比
⑶物质中某元素的质量分数
某元素的质量分数=此元素相对原子质量×个数/相对分子质量x100%
⑷物质中某元素质量=物质的质量×该元素的质量分数
【典例1】甲醛(化学式为CH2O)是室内装潢时的主要污染物之一,下列说法正确的是( )
A.甲醛是由碳、氢、氧三种元素组成
B.甲醛是由碳原子和水分子构成
C.甲醛分子是由碳原子、氢气分子、氧原子构成
D.甲醛是由一个碳元素、二个氢元素、一个氧元素组成。
A
知识点一、化学式的意义
【典例2】(2010·龙岩中考)冲洗照片时,需将底片浸泡在大苏打(Na2S2O3)溶液中,使影像固定下来,这一过程叫“定影”。大苏打中硫元素的化合价为( )
A.0 B.+2
C.+4 D.+6
知识点二、化合价及化合价的应用
B
【典例3】(2010 ·泰安中考)维生素是人体必备的营养物质,维生素D2的化学式C28H44O。
试计算:
(1)维生素D2的相对分子质量 。
(2)维生素D2中的碳、氢、氧三种元素的质量比 。
(3)198g维生素D2中含碳元素的质量为 g。
知识点三、有关化学式的计算
396
84:11:4
168
4、(2010·肇庆中考)碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3)。下图是超市销售的一种加碘盐标签上的部分文字说明。
请回答下列问题:
(1)碘酸钾中钾、碘、氧三种元
素质量比为____________。
(2)每袋该食盐中碘元素的质量 mg。
(3)中国营养学会推荐:一个18岁的青年每天摄入碘元素的质量为0.15mg。假设碘的来源仅靠这种加碘食盐,该青年每天摄入这种食盐应为 g。
食 盐
成分:NaCl KIO3
含碘:20mg/kg
重量: 500g
食用注意:勿长时间加热
保存:防潮、放阴凉处
39:127:48
10
7.5
课题4 化学式与化合价
H2O
水
第一课时 化学式
第二课时 化合价
第三课时 化学式的计算
+1 -2
1.掌握化学式及其含义,会读会写,能用化学式表示某些常见物质的组成。
2.了解化合价的含义,并熟记常见元素及原子团的化合价,会用正确书写元素化合价。
3.能用化学式表示物质的组成,并能利用化合价推求化学式。
4.了解相对分子质量的含义,并能利用相对原子质量进行有关简单计算。
纯净物
单质
化合物
氧化物
其他
金属单质
稀有气体单质:
固态非金属单质:
非金属单质
思考:任何物质都有化学式吗?
只有纯净物才能用化学式表示其组成
一般的气体单质:
一、化学式
用元素符号和数字的组合表示物质组成的式子,叫做化学式。
1、定义:
比一比,赛一赛:看谁能把这些物质的化学符号又快又好的表示出来?
水 氢气 二氧化碳 氯化钠 四氧化三铁
H2O H2 CO2 NaCl Fe3O4
观察与思考:这些物质的化学符号表示
有什么特点?
2.化学式的写法:
(1).单质化学式的写法:
铁 铝
硫 磷
氖气 氦气 氩气
氧气 氢气
氮气 氯气
Ne
He
Fe
Al
S
P
O2
H2
N2
Cl2
稀有气体单质:
金属单质:
固态非金属单质:
非金属气体单质:
2、稀有气体单质、非金属气体单质的写法有什么不同?为什么?
②用“Xn”表示
Ar
①用元素符号表示化学式
比一比,赛一赛:看谁能把这些物质的化学式又快又好的表示出来?
观察与思考:
1、这些物质从物质分类看都是哪类?它们化学式的书写有什么规律?
(2).化合物化学式的写法:
a.氧化物
CO2 SO2
Fe3O4
P2O5 MnO2
氧在后,另一种元素在前
氧化某或几氧化几某
读法
写法
二氧化碳
二氧化硫
四氧化三铁
五氧化二磷
二氧化锰
思考讨论,谁最先发现
它们化学式的书写有什么规律?
读法有什么规律?
这些物质从物质分类看都是哪类?
b.金属元素与非金属
元素组成的物质
MgCl 2 NaCl
ZnS
写法
金前非后
读法
某化某
化合物的读写:顺序相反,后念先写。
观察与思考:
这类物质的化学式的书写方法与读法有什么规律
纯净物
单质
化合物
氧化物
金属元素与非金属元素组成
金属单质
化学式
稀有气体单质:
固态非金属单质:
非金属气体单质:
用元素符号表示化学式.
用“Xn”表示
归纳与整理:
氧在后,另一种元素在前
写法
读法
氧化某或几氧化几某
写法
读法
金前非后
某化某或几化几某
化合物的读写顺序相反。
写出下列物质的化学式
铜 磷 氦气 四氧化三铁 氯化钠
Cu P He Fe3O4 NaCl
Au S Ne HgO KCI
读出下列物质的名称
金
硫
氖气
氧化汞
氯化钾
1、判断下列化学式的书写是否正确,如果不正确请说出为什么。
O5P2
ClNa
H2O1
2、下列物质读法正确的是( )
A N2O5 二氧化五氮
B KCl 钾化氯
C Fe2O3 三氧化二铁
C
考考你
只有纯净物才能用化学式表示其组成
化学式的书写必须依据实验的结果,不能随意写。
①任何物质都有化学式吗?
②同种物质可以有不同的化学式吗?
一种物质只能用一个化学式来表示
③化学式可以任意的书写吗?
想一想
猜一猜
这款化妆品最有可能属于下列哪种类型的产品:( )
A.祛皱型
B.美白型
C.保湿型
C
从化学式中能够得到哪些信息例:H2O表示的意义:
表示水这种物质
表示一个水分子
表示水由氢元素和氧元素组成
表示一个水分子由2个氢原子和1个氧原子构成
宏观意义
微观意义
O
H
H
1、化学式的意义(由分子构成的)
(1)表示一种物质。
(2)表示该物质由哪几种元素组成。
(3)表示物质的一个分子。
(4)表示该分子由哪些原子构成
观宏
观微
CO2
二氧化碳
二氧化碳由碳元素和氧元素组成
一个二氧化碳分子
一个二氧化碳分子由一个碳原子和两个氧原子构成
试一试
由分子构成的物质的化学式有四层意义,由原子或离子构成物质的化学式有哪些意义呢?
(1)表示一种物质。
(2)表示该物质由哪几种元素组成
(3)表示该物质由哪些原子
(或离子)构成。
如NaCl
H2O
2
表示2个水分子
表示每个水分子中有2个氢原子
2.化学式前面的数字表示分子个数。
注意:
1.化学式中元素符号右下角的数字表示每个分子中含有的原子个数。
?
探究这些阿拉伯数字的意义:
2C
2个碳原子
2H2O
2个水分子
2Al3+
每个铝离子带3
个单位的正电荷
2个铝离子
每个水分子里
有2个氢原子
归纳与整理:
如何表示
离子符号
如何表示几个原子、 几个分子、 几个离子?
n 离子符号
一种元素
一个原子
一种物质
一个分子
一种离子
一个离子
元素符号
化学式
n元素符号
n化学式
C
SO2
Mg2+
4C
5SO2
7Mg2+
注:符号前有数字,只表示几个微粒, 只有微观含义。(只有一个意义)
① H 表示氢元素,表示一个氢原子。
③ H2 表示氢气这种物质;
氢气是由氢元素组成;
一个氢分子;
一个氢分子由2个氢原子构成。
④ 2H2 表示两个氢分子
符号H、2H、H2、2H2各具有什么意义?
② 2H 表示2个氢原子。
2、将下列化学符号与其对应的示意图配对(填序号)
A、2O ①
B、O2 ②
C、2O2 ③
答:A与 ;B与 ;C与——。
课堂反馈练习
③
①
②
例 下列各符号中数字“2”表示的意义不正确的是( )
A.Fe2+:一个铁离子带两个单位的正电荷
B.N2:一个氮分子由两个氮原子构成
C.2Hg:两个汞原子
D.2NO3-:两个硝酸根离子
课堂教学展示
典例剖析
A
×
√
√
√
亚铁离子
1、下列符号N、N2、2N、2N2中
(1)既能表示氮气,又能表示一个氮分子的是 。(2)既能表示氮元素,又能表示一个氮原子的是 。(3)只能表示2个氮原子的是 。
(4)只能表示2个氮分子的是 。
N2
N
2N
练一练
2N2
2. 用元素符号或化学式填空
(1)4个二氧化碳分子
(2)7个铁原子
(3)1个氧离子
4CO2
7Fe
O2-
2、下列化学符号中,数字3表示的意义是
﹙填序号﹚
A、3H B、Al3+ C、3 Mg2+
D、O3 E、3O2
分子个数__ 原子个数__
离子个数__
一个分子中含某原子个数__
离子所带电荷数__
E
D
C
B
A
水 H2O
五氧化二磷 P2O5
二氧化碳 CO2
观察下列物质的化学式
?
为什么在以上三种物质的分子中原子个数比会不同?
实验测定 化学式的书写必须依据实验的结果
?
?
第二课时 化 合 价
观察一些物质组成元素的原子个数比
物质 HCl H2O NaCl Fe2O3
原子个数比 1∶1 2∶1 1∶1 2∶3
化学上用“化合价”来表示原子之间相互化合的数目。
化合价的表示方法:O Mg
-2
+2
在元素的上方写+或-号,后面加数值,注意1不能省略
问:元素的化合价由什么决定?
该元素原子的最外层电子数
你的发现:
不同元素间形成化合物,它们的原子相互化合时,具有确定的原子个数比。
二.化合价
Na+
2
8
+11
1
Na
2
8
+11
2
8
7
Cl
+17
Cl-
交流与讨论:氯化钠(NaCl)的化学式能否写成NaCl2?
钠原子能达到稳定结构,只有一个氯原子达到稳定结构,最终不能形成稳定化合物NaCl2 。
2
8
7
Cl
+17
2
8
8
+17
2
8
7
Cl
+17
一、元素的化合价怎样规定?
元素化合价由该元素原子最外层电子数决定.
Mg
2
8
+12
2
Mg
+2
O
2
6
+8
Al
2
8
+13
3
Al
+3
-2
O
用此方法判断(Na、Ca、Cl、S、的化合价)(参考课本54 85页)
例如:已知A、B元素原子最外层电子数分别为7、3,则A、B元素的化合价为 , 。
元素 元素符号 常见化合价 元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氯 Cl -1.+1.+5.+7
钙 Ca +2 溴 Br -1
镁 Mg +2 氧 O -2
钡 Ba +2 硫 S -2 +4 +6
铜 Cu +1、+2 碳 C +2、+4
铁 Fe +2、+3 硅 Si +4
铝 Al +3 氮 N -3.+2.+4.+5
锰 Mn +2.+4.+6.+7 磷 P -3、+3、+5
锌 Zn +2 非金属元素的化合价
金属元素跟非金属化合时,
非金属元素显负价。
金属元素的化合价
金属元素跟非金属化合时,
金属元素显正价。
离子符号 Na+ Mg2+ Al3+ F- O2-
化合价 Na Mg Al F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”“-”号在后;写在右上角。
化合价:数字在后,“+”“-”号在前;写在正上方。
化合价与离子所带电荷的联系:数字相同,正负号相同
比较并找规律
离子符号与化合价的比较:
原子团:作为一个整体参加反应的原子集团(就好像一个原子一样),原子团也叫做根。但有时也会被破坏,如氯酸钾(KClO3)中的氯酸根(ClO3-)在加热分解时被破坏。
注意:①原子团不能单独存在;
②带电荷的原子团也是离子,原子团的化合价是其组成元素的化合价的代数和,不为零。
NaOH、 Ca(OH)2 、Cu(NO3)2、NH4NO3、BaSO4、CaCO3、 H3PO4 KMnO4 K2MnO4
根:
离子:
OH-:
CO32-:
NH4+:
NO3- :
SO42-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
MnO4-:高锰酸根离子
MnO42-:锰酸根离子
PO43-:磷酸根离子
ClO3-:氯酸根离子
原 子 团 的 化 合 价
NaOH、Ca(OH)2、Cu(OH)2、Fe(OH)3
读氢氧化某
H2CO3、H2SO4、HNO3
根的名称 根的符号 常见化合价
氢氧根 OH- -1
硝酸根 NO3- -1
硫酸根 SO42- -2
碳酸根 CO32- -2
铵根 NH4+ +1
读某酸[中间元素的名称]
读某[酸根]酸某
CaCO3、CuSO4、NaNO3
(1)在任何化合物里,正负化合价的代数和为零。
(2)在化合物里氢通常显+1价,氧通常显-2价。
(3)在化合物里金属元素通常显正价,非金属元素通常显负价。
(4)单质里元素的化合价为零。
(5)许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价,如:FeO,Fe2O3中铁元素的化合价分别为+2和+3。极个别元素在同种物质中也显不同的化合价.如NH4NO3
1、化合价的有关规律
-3
+5
在确定元素的化合价时,需要注意以下几点:
化 合 价 的 法 则
一些常见元素化合价口诀
钾钠氢银正一价,钙镁钡锌正二价。
氟氯一般负一价,通常氧显负二价。铁正二正三铝正三,莫忘单质价为0.
一些常见原子团的化合价
负一硝酸氢氧根 负二硫酸碳酸根
正一价的是铵根
(1)根据化学式求某一元素化合价
原则:化合物里正负化合价的代数和为零
例1:试确定氯酸钾(KClO3)中氯元素的化合价
解:设氯元素的化合价为x,则
(+1)+ x +(-2)×3=0
x = +5
所以,在氯酸钾中,氯元素的化合价为+5价
2、化学式与化合价的关系
练习:1.已知X、Y、Z的化合价分别为+1、+6、
-2,则由X、Y、Z组成的化合物的化学式可能是( )
A、 XYZ
D、X2Y3Z
B、XY2Z3
C、X2YZ4
C
2.加碘食盐中含有碘酸钾KIOx,已知碘酸钾中K为+1价,I为+5价,O为-2价,则其化学式中X的数值为( )
A、 1
D、4
B、2
C、3
C
推求下列原子团(根)的化合价:
原子团的化合价
NaNO3、 NH4NO3、 NaOH、
H2SO4、 Na2CO3、 H3PO4
+1
-1
-1
+1
+1
+1
+1
+1
-1
-2
-2
-3
推求的依据:化合物中元素的化合价代数和为0。
注:在原子团中,各元素化合价代数和为原子团的化合价,一定不为0
化 合 价 的 计 算
1.已知氧为-2价,铝为+3价,如何计算Al2(SO4)3中硫的化合价?
【思路】
依据:在化合物里正负化合价的代数和为零。
设未知数
解:设硫的化合价为x
列等式(正负总价和为0)
+3×2+3x+(-2)×4 ×3 =0
解 答
x = +6
答: Al2(SO4)3里的硫的化合价为+6价。
练习:P89 3、4、
(2)根据化合价求化学式
步骤:(数字交叉法)
① 写符号
② 标化合价
③ 化合价绝对值交叉放置在元素符号右下角
④ 约简
⑤ 检查
例2 已知磷元素有两种氧化物,其中磷的化合价分别为+3和+5,写出这两种磷的氧化物的化学式
【思路】
(1)先写元素符号(正前负后)
(2)标出各元素的化合价(正上)
(3)把化合价数值化为最简
(4)把化简后的数字交叉写出(求最小公倍数)
P O
P O
+3 -2
P O
P2O3
P O
P2O5
+3 -2
+3 -2
P2O3
P O
+5 -2
P O
+ 5 -2
省略
P2O5
+ 5 -2
化 合 价 的 计 算 小 结
Fe2(SO4)3
小 结
数字交叉法书写化学式的一般步骤:
①写出组成的元素符号:先写正价,后写负价
②标出元素的化合价;
③定原子或原子团个数:
化合价的绝对值斜交叉下来得个数;
能约简的要先约简再交叉;
有2个以上原子团要加括号;
右下角数字是“1”的省略不写;
思路:先正 后负 化简 交叉
练习:P89 5、6
问:如果碰到有原子团的化学式又怎样书写呢?如已知铁为+3价,硫酸根(SO42-)为-2价,写出硫酸铁的化学式。
化 合 价 的 计 算
练一练P87
2.写出溴化钠、氯化钙、氧化铝、二氧化氮的化学式。
NaBr CaCl2 Al2O3 NO2
3.读出以下化学式的名称:
MnO2 CuO SO3 KI NaNO3
二氧化锰 氧化铜 三氧化硫 碘化钾 硝酸钠
相对分子质量的理解
三、有关相对分子质量的计算
H2O的意义:1个水分子是由2个氢原子和1个氧原子构成的。
真实质量:1个水分子的质量=2个氢原子质量+1个氧原子的质量
相对质量:1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量
所以H2O的相对分子质量=1×2+16×1=18
定义:化学式中各原子的相对原子质量的总和,就是相对分子质量。
相 对 分 子 质 量 的 计 算
化学式中各原子的相对原子质量总和
H2O的相对分子质量=1×2+16=18
O2的相对分子质量=16×2=32
相对分子质量 = 某元素的相对原子质量×原子个数+另一种元素的相对原子质量×原子个数+……
CO2
NH4NO3
Cu2(OH)2CO3
12+16×2=44
14+1×4+14+16×3=80
64×2+(16+1)×2+12+16×3=222
1、计算相对分子质量(Mr):
例:计算 (NH4)2SO4的相对分子质量
【解】(NH4)2SO4的相对分子质量
=(14+1×4)×2+32+16×4=132
算一算
请同学们计算下列物质的相对分子质量或相对分子质量总和。
⑴氢氧化钙[Ca(OH)2];
⑵CuSO4·5H2O
⑶5P2O5
相 对 分 子 质 量 的 计 算
2、计算物质组成元素的质量比
物质组成元素的质量比 = 某元素的相对原子质量×原子个数∶另一种元素的相对原子质量×原子个数+……
如:二氧化碳[CO2]中碳元素和氧元素的质量比等于
12 ∶ (16×2)= 3 ∶ 8
H2O
KMnO4
NH4NO3
Cu2(OH)2CO3
H:O=1 ∶ 8
K:Mn:O=39 ∶ 55 ∶ 64
N:H:O=7 ∶ 1 ∶ 12
Cu:O:H:C=64 ∶ 40 ∶ 1 ∶ 6
2.计算物质组成元素的质量比
各元素之间的质量比=各原子的相对原子质量总和之比
例:求Fe2O3中铁元素和氧元素的质量比。
Fe2O3中铁元素和氧元素的质量比
Fe:O=(56×2):(16×3)=112:48=7:3
相 对 分 子 质 量 的 计 算
3、计算物质中某元素的质量分数
例1:求硝酸铵[NH4NO3]中氮元素的质量分数?
NH4NO3的相对分子质量 =14+1 × 4+14+16 × 3=80
氮元素的质量分数= × 100%
N的相对原子质量× N的原子个数
NH4NO3的相对分子质量
= × 100%=35%
14 × 2
80
3.计算物质中某元素的质量分数
某元素的质量分数=
该元素相对原子质量×原子个数
化合物的相对分子质量
× 100﹪
注意事项:
①质量分数——用百分数来表示
该元素的质量与组成物质的元素总质量之比。(每100克该物质中含有某元素的质量)
②意义:
例2:⑴计算二氧化硫中硫元素的质量分数
⑵计算64t二氧化硫中含硫元素的质量。
解:⑴SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
⑵ 64t二氧化硫中含硫元素的质量=64t×50%=32t
元素质量=物质质量 × 化学式中元素质量分数
已知元素质量如何求物质质量
1.多少克水中含氢元素4g?
2.要炼56吨铁需Fe2O3多少吨?
练一练
想一想
小结:
相对分子质量是化学式中各原子的相对原子质量总和。它的符号是Mr,单位是一,一般不写。
⑴计算相对分子质量
相对分子质量=相对原子质量×个数之和
⑵计算组成物质元素的质量比
元素的质量比=此元素相对原子质量×个数之比
⑶物质中某元素的质量分数
某元素的质量分数=此元素相对原子质量×个数/相对分子质量x100%
⑷物质中某元素质量=物质的质量×该元素的质量分数
【典例1】甲醛(化学式为CH2O)是室内装潢时的主要污染物之一,下列说法正确的是( )
A.甲醛是由碳、氢、氧三种元素组成
B.甲醛是由碳原子和水分子构成
C.甲醛分子是由碳原子、氢气分子、氧原子构成
D.甲醛是由一个碳元素、二个氢元素、一个氧元素组成。
A
知识点一、化学式的意义
【典例2】(2010·龙岩中考)冲洗照片时,需将底片浸泡在大苏打(Na2S2O3)溶液中,使影像固定下来,这一过程叫“定影”。大苏打中硫元素的化合价为( )
A.0 B.+2
C.+4 D.+6
知识点二、化合价及化合价的应用
B
【典例3】(2010 ·泰安中考)维生素是人体必备的营养物质,维生素D2的化学式C28H44O。
试计算:
(1)维生素D2的相对分子质量 。
(2)维生素D2中的碳、氢、氧三种元素的质量比 。
(3)198g维生素D2中含碳元素的质量为 g。
知识点三、有关化学式的计算
396
84:11:4
168
4、(2010·肇庆中考)碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3)。下图是超市销售的一种加碘盐标签上的部分文字说明。
请回答下列问题:
(1)碘酸钾中钾、碘、氧三种元
素质量比为____________。
(2)每袋该食盐中碘元素的质量 mg。
(3)中国营养学会推荐:一个18岁的青年每天摄入碘元素的质量为0.15mg。假设碘的来源仅靠这种加碘食盐,该青年每天摄入这种食盐应为 g。
食 盐
成分:NaCl KIO3
含碘:20mg/kg
重量: 500g
食用注意:勿长时间加热
保存:防潮、放阴凉处
39:127:48
10
7.5
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
