化学人教版(2019)选择性必修1 4.1.1原电池的工作原理(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1.1原电池的工作原理(共20张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-24 00:00:00 | ||
图片预览






文档简介
(共20张PPT)
第四章 化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
人教版(2019)选择性必修一
学习目标:
1.掌握原电池的结构和工作原理;
2.能够写出电极反应方程式和总反应方程式;
3.会利用氧化还原反应设计原电池。
判断下列装置哪些属于原电池
H2SO4
Zn Zn
(1)
石墨
石墨
H2SO4
(2)
H2SO4
Zn 石墨
(3)
Zn Cu
H2SO4
(4)
CuSO4
Zn Cu
(5)
C2H5OH
Zn Cu
(6)
Zn Cu
ZnSO4 CuSO4
(7)
1.形成的条件
有两种活动性不同的金属或金属和非金属单质作电极。
②电解质溶液
③形成闭合电路
④能自发进行氧化还原反应
两极,一液,一连线,自发进行的氧化还原反应
一、原电池
化学能转变为电能的装置
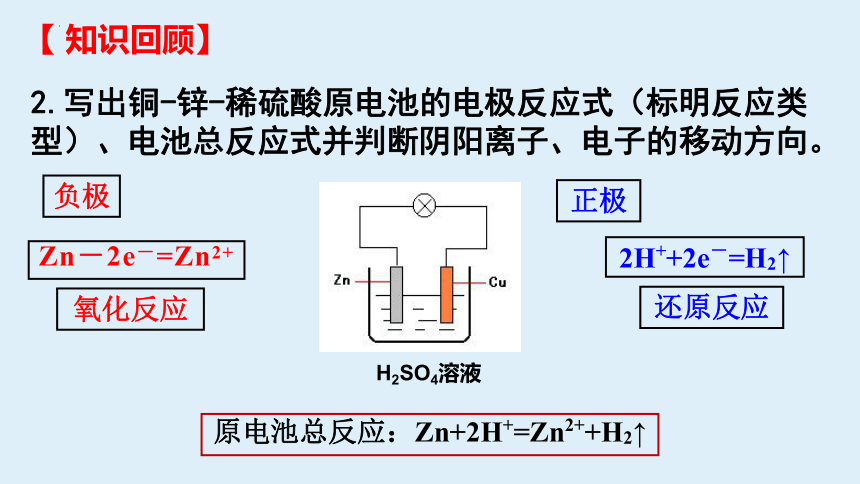
2.写出铜-锌-稀硫酸原电池的电极反应式(标明反应类型)、电池总反应式并判断阴阳离子、电子的移动方向。
H2SO4溶液
Zn-2e-=Zn2+
氧化反应
负极
2H++2e-=H2↑
还原反应
正极
原电池总反应:Zn+2H+=Zn2++H2↑
【 知识回顾】
得电子,发生 反应
失电子,发生 反应
①电极:
负极:
正极:
氧化
还原
溶液中离子移动方向:
②本质:发生氧化还原反应
2.工作原理
负氧正还
③电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
阴离子 负极
阳离子 正极
“电子不下水”
“离子不上岸”
3.如何避免H+在锌片上得电子,提高原电池能量转化效率
1. 该实验锌极上也有气泡产生,原因是什么
锌失去的电子没有完全经过导线,导致化学能转化成电能效率降低,最终电流会逐渐衰弱,电池寿命短。
锌片不能伸入H2SO4溶液中
2. H+在锌片上得电子会导致什么后果?
这种原电池中的氧化反应和还原反应没有完全隔开,一部分H+在锌直接表面得电子生成H2
思考与交流:
H2SO4溶液
Zn
Cu
A
H2SO4溶液
Zn
A
Cu
ZnSO4溶液
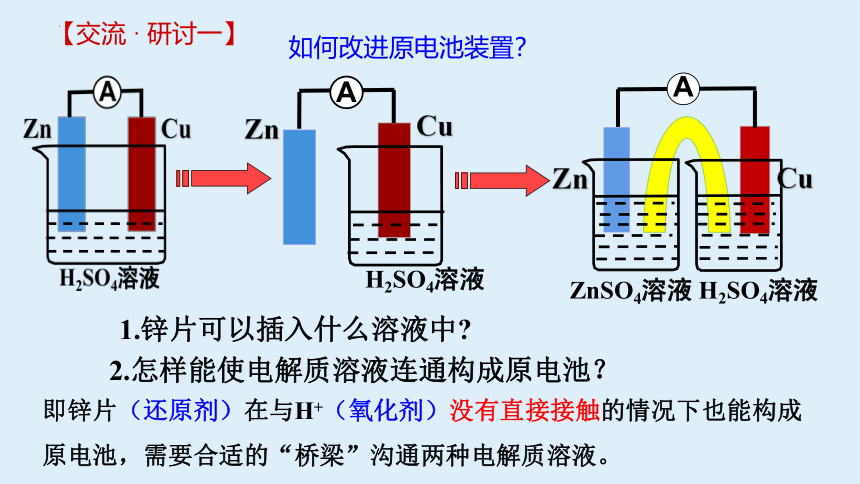
【交流 · 研讨一】
如何改进原电池装置?
1.锌片可以插入什么溶液中
2.怎样能使电解质溶液连通构成原电池?
即锌片(还原剂)在与H+(氧化剂)没有直接接触的情况下也能构成原电池,需要合适的“桥梁”沟通两种电解质溶液。
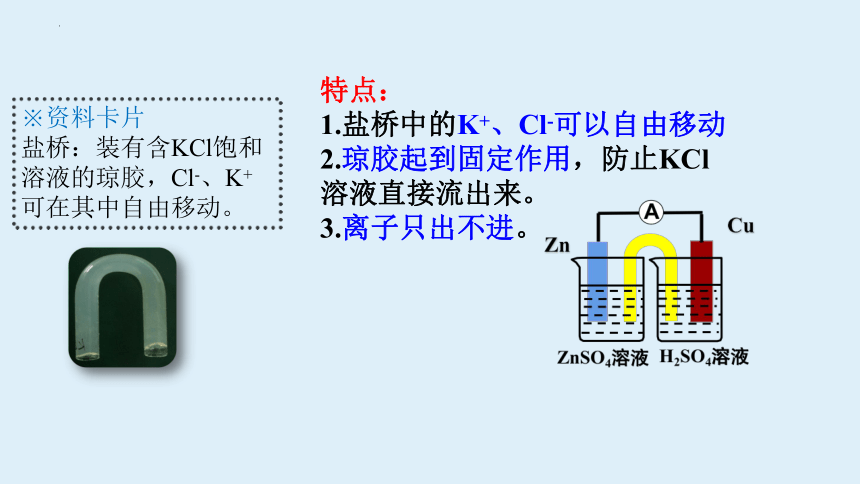
特点:
1.盐桥中的K+、Cl-可以自由移动
2.琼胶起到固定作用,防止KCl溶液直接流出来。
3.离子只出不进。
※资料卡片
盐桥:装有含KCl饱和溶液的琼胶,Cl-、K+可在其中自由移动。
现象:
有盐桥存在时电流表指针偏移
铜片表面有铜析出
锌片逐渐溶解
随着时间的延续,
能产生持续稳定的电流
取出盐桥无电流产生
Zn片
Cu片
ZnSO4
H2SO4
Zn2+
4.盐桥有什么作用?
3.盐桥中K+和Cl-的移动方向?
1.盐桥中有电子流过吗?
不能,两溶液中SO42-浓度不变
①沟通内电路,形成闭合回路;
②提供离子,保持两溶液电中性;
③提高能量转化效率
思考讨论
Zn片
Cu片
ZnSO4
H2SO4
Zn2+
H+
Cl-
K+
没有
2.两溶液中的离子能通过盐桥吗?
K+向正极移动,Cl-向负极移动;
K+
Cl-
只出不进
【实验 】
【观察提示】
1、电流表指针偏转情况
2、电解质溶液的变化
3、电极表面的变化
4、取出盐桥后的变化
Zn
Cu
A
ZnSO4溶液
CuSO4溶液
将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有ZnSO4溶液和CuSO4溶液的烧杯中。
结论:①电解质溶液一般要能够与负极发生反应。
②两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应 与电极材料具有相同的阳离子。
Zn-2e-=Zn2+
Cu2++2e-=Cu
总反应 Zn+Cu2+=Zn2++Cu
1.组成的条件
有两种活动性不同的金属或金属和非金属单质作电极。
②电解质溶液
③形成闭合电路(盐桥)
④能自发进行氧化还原反应
两极、两液、一连线,盐桥,自发进行的氧化还原反应
二、双液原电池
左右两个烧杯中的电解质溶液 与电极材料具有相同的阳离子
化学能转变为电能的装置,由两个半电池组成,一个发生氧化反应一个发生还原反应
Cu
A
ZnSO4溶液
CuSO4溶液
Zn
得电子,发生 反应
失电子,发生 反应
①电极:
负极:
正极:
氧化
还原
溶液中离子移动方向:
②本质:发生氧化还原反应
负氧正还
④电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
阴离子 负极
阳离子 正极
“电子不下水”
“离子不上岸”
2.双液原电池的工作原理
与单液原电池工作原理一样
设计思路
负极 负极材料______________
负极反应物____________
正极 正极材料______________
正极反应物_____________
电子导体 _________
离子导体 _________
1.请选择适当的材料和试剂,将反应 设计成一个原电池,请填表格:
在方框内画出简单的装置示意图,并标明使用的材料和试剂。
石墨
KI溶液
石墨
FeCl3溶液
导线
盐桥
练一练:双液原电池的设计
2.给以下反应设计一个原电池装置,画出装置图。
Cu+2AgNO3=Cu(NO3)2+2Ag
A
AgNO3
银片 铜片
AgNO3
Ag Cu
Cu(NO3 )2
A
三、原电池正、负极的判断
判断方法 负极 正极
①电极材料 较活泼金属 较不活泼金属或石墨
②通入物 通入还原剂的电极 通入氧化剂的电极
③两极反应类型 发生氧化反应的电极 发生还原反应的电极
④电子流向 (或电流方向) 电子流出的电极 (或电流流入的电极) 电子流入的电极
(或电流流出的电极)
⑤离子流向 阴离子流向的电极 阳离子流向的电极
⑥电极质量变化 质量减小的电极 质量增加的电极
⑦有无气泡 — 有气泡产生的电极
【注意】(1)金属的活动性受所处环境的影响。如Mg、Al的活动性:在中性或酸性溶液中活动性Mg>Al;而在碱性溶液中,Al可以与OH-反应,而Mg不反应,所以Mg与Al用导线连接后放入NaOH溶液中,Al是负极,Mg是正极。
(2)Fe、Cu相连,浸入稀HNO3中,Fe作负极;浸在浓HNO3中,Cu作负极(Fe发生钝化)。
四、原电池原理的应用
(1)比较金属的活动性强弱:原电池中,负极一般是活动性 的金属,正极一般是活动性较弱的金属(或非金属)。
(2)加快化学反应速率:氧化还原反应形成原电池时,反应速率加快。
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
(3)用于金属的防护:将需要保护的金属制品作原电池的 而受到保护。
钢铁中含有碳,C与Fe组成原电池,发生原电池反应而使钢铁(做负极)遭到腐蚀
(4)设计制作化学电源
①首先将氧化还原反应分成两个半反应。
②根据原电池的工作原理,结合两个半反应,选择正、负电极材料以及电解质溶液。
较强
正极
练习:某原电池总反应的离子方程式为2Fe3++Fe === 3Fe2+,能实现该反应的原电池是( B )
A.正极为Cu,负极为C,电解质为FeCl3溶液
B.正极为C,负极为Fe,电解质为Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质为CuSO4溶液
解析 将总反应拆分为氧化反应和还原反应两个半反应,即为负极Fe-2e- === Fe2+,正极2Fe3++2e- === 2Fe2+,然后根据原电池的构成条件确定正、负极材料和电解质溶液。因此,本题负极必是Fe,正极可为比Fe活动性弱的金属或非金属导体,电解质溶液为含Fe3+的盐溶液,所以B项正确。
(1)设计原电池的原理
原电池是一种将化学能转化为电能的装置。在电池中,通过电极和导线将电子转移变成了电子的定向移动,将氧化反应和还原反应分到两个电极上进行,使其成为两个“半反应”。
(2)设计原电池的思路
①电极材料的选择。负极一般是活动性强的金属材料,正极一般选用活动性比负极弱的金属材料或石墨等惰性电极。
②电解质溶液的选择。电解质溶液一般要能够与负极发生反应。
③保证设计出的原电池装置中,还原剂在负极上发生反应,氧化剂在正极上发生反应。
小结:规律方法
第四章 化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
人教版(2019)选择性必修一
学习目标:
1.掌握原电池的结构和工作原理;
2.能够写出电极反应方程式和总反应方程式;
3.会利用氧化还原反应设计原电池。
判断下列装置哪些属于原电池
H2SO4
Zn Zn
(1)
石墨
石墨
H2SO4
(2)
H2SO4
Zn 石墨
(3)
Zn Cu
H2SO4
(4)
CuSO4
Zn Cu
(5)
C2H5OH
Zn Cu
(6)
Zn Cu
ZnSO4 CuSO4
(7)
1.形成的条件
有两种活动性不同的金属或金属和非金属单质作电极。
②电解质溶液
③形成闭合电路
④能自发进行氧化还原反应
两极,一液,一连线,自发进行的氧化还原反应
一、原电池
化学能转变为电能的装置
2.写出铜-锌-稀硫酸原电池的电极反应式(标明反应类型)、电池总反应式并判断阴阳离子、电子的移动方向。
H2SO4溶液
Zn-2e-=Zn2+
氧化反应
负极
2H++2e-=H2↑
还原反应
正极
原电池总反应:Zn+2H+=Zn2++H2↑
【 知识回顾】
得电子,发生 反应
失电子,发生 反应
①电极:
负极:
正极:
氧化
还原
溶液中离子移动方向:
②本质:发生氧化还原反应
2.工作原理
负氧正还
③电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
阴离子 负极
阳离子 正极
“电子不下水”
“离子不上岸”
3.如何避免H+在锌片上得电子,提高原电池能量转化效率
1. 该实验锌极上也有气泡产生,原因是什么
锌失去的电子没有完全经过导线,导致化学能转化成电能效率降低,最终电流会逐渐衰弱,电池寿命短。
锌片不能伸入H2SO4溶液中
2. H+在锌片上得电子会导致什么后果?
这种原电池中的氧化反应和还原反应没有完全隔开,一部分H+在锌直接表面得电子生成H2
思考与交流:
H2SO4溶液
Zn
Cu
A
H2SO4溶液
Zn
A
Cu
ZnSO4溶液
【交流 · 研讨一】
如何改进原电池装置?
1.锌片可以插入什么溶液中
2.怎样能使电解质溶液连通构成原电池?
即锌片(还原剂)在与H+(氧化剂)没有直接接触的情况下也能构成原电池,需要合适的“桥梁”沟通两种电解质溶液。
特点:
1.盐桥中的K+、Cl-可以自由移动
2.琼胶起到固定作用,防止KCl溶液直接流出来。
3.离子只出不进。
※资料卡片
盐桥:装有含KCl饱和溶液的琼胶,Cl-、K+可在其中自由移动。
现象:
有盐桥存在时电流表指针偏移
铜片表面有铜析出
锌片逐渐溶解
随着时间的延续,
能产生持续稳定的电流
取出盐桥无电流产生
Zn片
Cu片
ZnSO4
H2SO4
Zn2+
4.盐桥有什么作用?
3.盐桥中K+和Cl-的移动方向?
1.盐桥中有电子流过吗?
不能,两溶液中SO42-浓度不变
①沟通内电路,形成闭合回路;
②提供离子,保持两溶液电中性;
③提高能量转化效率
思考讨论
Zn片
Cu片
ZnSO4
H2SO4
Zn2+
H+
Cl-
K+
没有
2.两溶液中的离子能通过盐桥吗?
K+向正极移动,Cl-向负极移动;
K+
Cl-
只出不进
【实验 】
【观察提示】
1、电流表指针偏转情况
2、电解质溶液的变化
3、电极表面的变化
4、取出盐桥后的变化
Zn
Cu
A
ZnSO4溶液
CuSO4溶液
将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有ZnSO4溶液和CuSO4溶液的烧杯中。
结论:①电解质溶液一般要能够与负极发生反应。
②两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应 与电极材料具有相同的阳离子。
Zn-2e-=Zn2+
Cu2++2e-=Cu
总反应 Zn+Cu2+=Zn2++Cu
1.组成的条件
有两种活动性不同的金属或金属和非金属单质作电极。
②电解质溶液
③形成闭合电路(盐桥)
④能自发进行氧化还原反应
两极、两液、一连线,盐桥,自发进行的氧化还原反应
二、双液原电池
左右两个烧杯中的电解质溶液 与电极材料具有相同的阳离子
化学能转变为电能的装置,由两个半电池组成,一个发生氧化反应一个发生还原反应
Cu
A
ZnSO4溶液
CuSO4溶液
Zn
得电子,发生 反应
失电子,发生 反应
①电极:
负极:
正极:
氧化
还原
溶液中离子移动方向:
②本质:发生氧化还原反应
负氧正还
④电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
阴离子 负极
阳离子 正极
“电子不下水”
“离子不上岸”
2.双液原电池的工作原理
与单液原电池工作原理一样
设计思路
负极 负极材料______________
负极反应物____________
正极 正极材料______________
正极反应物_____________
电子导体 _________
离子导体 _________
1.请选择适当的材料和试剂,将反应 设计成一个原电池,请填表格:
在方框内画出简单的装置示意图,并标明使用的材料和试剂。
石墨
KI溶液
石墨
FeCl3溶液
导线
盐桥
练一练:双液原电池的设计
2.给以下反应设计一个原电池装置,画出装置图。
Cu+2AgNO3=Cu(NO3)2+2Ag
A
AgNO3
银片 铜片
AgNO3
Ag Cu
Cu(NO3 )2
A
三、原电池正、负极的判断
判断方法 负极 正极
①电极材料 较活泼金属 较不活泼金属或石墨
②通入物 通入还原剂的电极 通入氧化剂的电极
③两极反应类型 发生氧化反应的电极 发生还原反应的电极
④电子流向 (或电流方向) 电子流出的电极 (或电流流入的电极) 电子流入的电极
(或电流流出的电极)
⑤离子流向 阴离子流向的电极 阳离子流向的电极
⑥电极质量变化 质量减小的电极 质量增加的电极
⑦有无气泡 — 有气泡产生的电极
【注意】(1)金属的活动性受所处环境的影响。如Mg、Al的活动性:在中性或酸性溶液中活动性Mg>Al;而在碱性溶液中,Al可以与OH-反应,而Mg不反应,所以Mg与Al用导线连接后放入NaOH溶液中,Al是负极,Mg是正极。
(2)Fe、Cu相连,浸入稀HNO3中,Fe作负极;浸在浓HNO3中,Cu作负极(Fe发生钝化)。
四、原电池原理的应用
(1)比较金属的活动性强弱:原电池中,负极一般是活动性 的金属,正极一般是活动性较弱的金属(或非金属)。
(2)加快化学反应速率:氧化还原反应形成原电池时,反应速率加快。
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
(3)用于金属的防护:将需要保护的金属制品作原电池的 而受到保护。
钢铁中含有碳,C与Fe组成原电池,发生原电池反应而使钢铁(做负极)遭到腐蚀
(4)设计制作化学电源
①首先将氧化还原反应分成两个半反应。
②根据原电池的工作原理,结合两个半反应,选择正、负电极材料以及电解质溶液。
较强
正极
练习:某原电池总反应的离子方程式为2Fe3++Fe === 3Fe2+,能实现该反应的原电池是( B )
A.正极为Cu,负极为C,电解质为FeCl3溶液
B.正极为C,负极为Fe,电解质为Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质为CuSO4溶液
解析 将总反应拆分为氧化反应和还原反应两个半反应,即为负极Fe-2e- === Fe2+,正极2Fe3++2e- === 2Fe2+,然后根据原电池的构成条件确定正、负极材料和电解质溶液。因此,本题负极必是Fe,正极可为比Fe活动性弱的金属或非金属导体,电解质溶液为含Fe3+的盐溶液,所以B项正确。
(1)设计原电池的原理
原电池是一种将化学能转化为电能的装置。在电池中,通过电极和导线将电子转移变成了电子的定向移动,将氧化反应和还原反应分到两个电极上进行,使其成为两个“半反应”。
(2)设计原电池的思路
①电极材料的选择。负极一般是活动性强的金属材料,正极一般选用活动性比负极弱的金属材料或石墨等惰性电极。
②电解质溶液的选择。电解质溶液一般要能够与负极发生反应。
③保证设计出的原电池装置中,还原剂在负极上发生反应,氧化剂在正极上发生反应。
小结:规律方法
