4.3.1化学键(1)离子键 课件(共23张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3.1化学键(1)离子键 课件(共23张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 15.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-25 08:09:10 | ||
图片预览





文档简介
(共23张PPT)
延时符
第四章 物质结构 元素周期律
第3节 化学键(1)离子键
学习目标
01
离子键
02
离子化合物
03
电子式
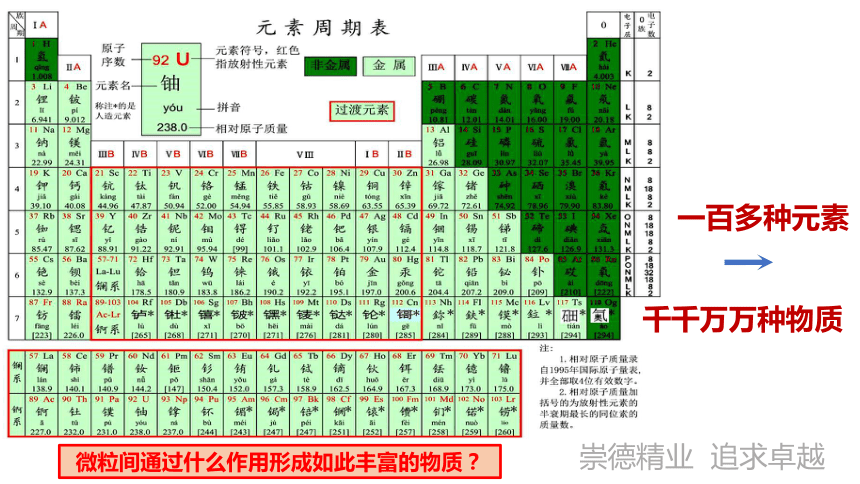
千千万万种物质
一百多种元素
微粒间通过什么作用形成如此丰富的物质?
崇德精业 追求卓越
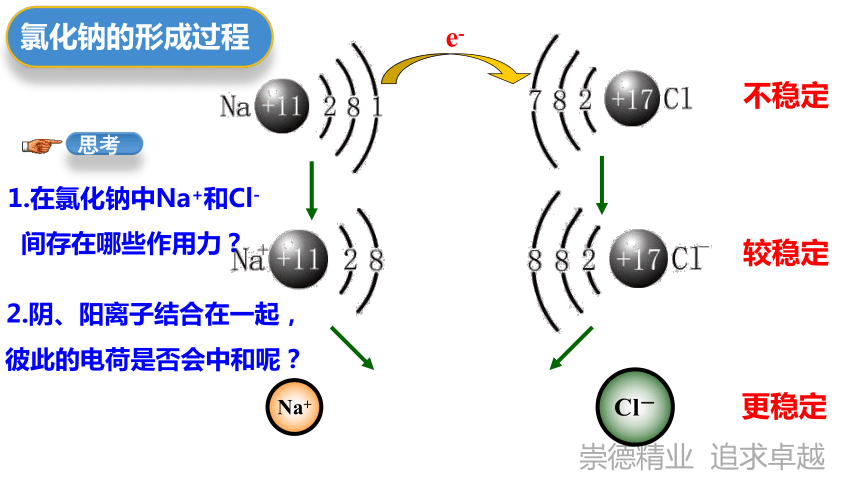
氯化钠的形成过程
如何从微观的角度来解析为什么金属钠和氯气能发生反应呢?(提示:从电子得失的角度分析)
【问题探究】
Na+
e-
11
1.在氯化钠中Na+和Cl-
间存在哪些作用力?
崇德精业 追求卓越
Cl-
氯化钠的形成过程
思考
2.阴、阳离子结合在一起,彼此的电荷是否会中和呢?
不稳定
较稳定
更稳定
氯化钠
的形成
离子键
1
使阴、阳离子结合成化合物的静电作用
阴、阳离子
静电作用(静电引力和静电排斥力)
阴、阳离子接近到某一定距离时,
吸引力和排斥力达到平衡
就形成了离子键
离子键
1
成键微粒
成键本质
成键过程
定义
所有金属和非金属化合都能形成离子键吗?
所有非金属化合都不能形成离子键吗?
离子键
1
思考
延时符
含有离子键的物质有:
如:KCl、Na2O、 Na2O2、 Na2S、MgCl2等
(2)金属阳离子和某些带负电的原子团形成的强碱和盐
(1)活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间形成的化合物
如:NaOH、K2SO4、Na2CO3、Mg(NO3)2 等
如:NH4Cl 、(NH4)2SO4 、(NH4)2S等
(3)铵盐:
延时符
典型例题
例2、下列物质中含有离子键的是 ( )
a.H2O b.CaCl2 c.NaOH d.H2SO4
e.Na2O f.CO2 g.Na2O2 h.NH4Cl
例1、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是 ( )
A.10与19 B.6与16 C.11与17 D.14与8
bcegh
C
离子化合物
2
离子化合物
2
(1)定义:含有离子键的化合物称为离子化合物
注意:
①离子化合物不一定含金属元素
如:铵盐 NH4Cl
如: AlCl3
②含金属元素的化合物不一定是离子化合物
强碱: NaOH、 Ba(OH)2
活泼金属氧化物:MgO、Na2O
(2)类别
大多数盐:NaCl、 MgSO4、NH4Cl
两个“不一定”
例3、正误判断:
(1)含有离子键的化合物一定是离子化合物。
(2)离子化合物中一定含有阴离子和阳离子。
(3)含有金属元素的化合物一定是离子化合物。
(4)阴、阳离子通过静电引力所形成的化学键叫做离子键.
例4、下列物质中不属于离子化合物的是 ( )
A.NH4NO3 B. NaOH C.MgCl2 D.H2SO4
×
D
√
√
×
典型例题
从上可以看出原子成键是和其最外层电子有关,
那么如何形象地表示原子的最外层电子呢?
电子式
请同学们
阅读课本107页
资料卡片
电子式
3
电子式
3
在元素符号周围用小黑点 ·(或×)
来表示原子的最外层电子的式子
( 1 ) 原子的电子式:
( 2 ) 离子的电子式:
① 简单阳离子的电子式
一般用 表示
R
n-
② 简单阴离子的电子式
即离子符号
定义
1
书写
2
(3)离子化合物的电子式:
由阳离子、阴离子的电子式组合而成.
AB型
AB2型
A2B型
【注意】相同的离子不能写在一起
Mg
2
Br
2
Mg
2
Br
Br
电子式
3
请你试一试
练习:写出 KF、Na2S、氧化钙、硫化钾 的电子式
电子式
3
原理
阳离子:离子符号、
R
n-
阴离子:
(4) 用电子式表示离子化合物的形成过程
电子式
3
原子
电子式
离子
电子式
用电子式表示氯化钠的形成过程
用电子式表示溴化镁(MgBr2)的形成过程
注意:
1、相同的原子可以合并写,相同的离子要单个写;
2、不能把“→”写成“==”;
3、用箭头标明电子转移方向。
电子式
3
〖课堂反馈〗
用电子式表示下列离子化合物的形成过程:
BaCl2:_________________________________;
NaF:_____________________;
MgS:_______________________;
K2O:__________________________。
延时符
谢 谢 聆 听 !
延时符
第四章 物质结构 元素周期律
第3节 化学键(1)离子键
学习目标
01
离子键
02
离子化合物
03
电子式
千千万万种物质
一百多种元素
微粒间通过什么作用形成如此丰富的物质?
崇德精业 追求卓越
氯化钠的形成过程
如何从微观的角度来解析为什么金属钠和氯气能发生反应呢?(提示:从电子得失的角度分析)
【问题探究】
Na+
e-
11
1.在氯化钠中Na+和Cl-
间存在哪些作用力?
崇德精业 追求卓越
Cl-
氯化钠的形成过程
思考
2.阴、阳离子结合在一起,彼此的电荷是否会中和呢?
不稳定
较稳定
更稳定
氯化钠
的形成
离子键
1
使阴、阳离子结合成化合物的静电作用
阴、阳离子
静电作用(静电引力和静电排斥力)
阴、阳离子接近到某一定距离时,
吸引力和排斥力达到平衡
就形成了离子键
离子键
1
成键微粒
成键本质
成键过程
定义
所有金属和非金属化合都能形成离子键吗?
所有非金属化合都不能形成离子键吗?
离子键
1
思考
延时符
含有离子键的物质有:
如:KCl、Na2O、 Na2O2、 Na2S、MgCl2等
(2)金属阳离子和某些带负电的原子团形成的强碱和盐
(1)活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间形成的化合物
如:NaOH、K2SO4、Na2CO3、Mg(NO3)2 等
如:NH4Cl 、(NH4)2SO4 、(NH4)2S等
(3)铵盐:
延时符
典型例题
例2、下列物质中含有离子键的是 ( )
a.H2O b.CaCl2 c.NaOH d.H2SO4
e.Na2O f.CO2 g.Na2O2 h.NH4Cl
例1、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是 ( )
A.10与19 B.6与16 C.11与17 D.14与8
bcegh
C
离子化合物
2
离子化合物
2
(1)定义:含有离子键的化合物称为离子化合物
注意:
①离子化合物不一定含金属元素
如:铵盐 NH4Cl
如: AlCl3
②含金属元素的化合物不一定是离子化合物
强碱: NaOH、 Ba(OH)2
活泼金属氧化物:MgO、Na2O
(2)类别
大多数盐:NaCl、 MgSO4、NH4Cl
两个“不一定”
例3、正误判断:
(1)含有离子键的化合物一定是离子化合物。
(2)离子化合物中一定含有阴离子和阳离子。
(3)含有金属元素的化合物一定是离子化合物。
(4)阴、阳离子通过静电引力所形成的化学键叫做离子键.
例4、下列物质中不属于离子化合物的是 ( )
A.NH4NO3 B. NaOH C.MgCl2 D.H2SO4
×
D
√
√
×
典型例题
从上可以看出原子成键是和其最外层电子有关,
那么如何形象地表示原子的最外层电子呢?
电子式
请同学们
阅读课本107页
资料卡片
电子式
3
电子式
3
在元素符号周围用小黑点 ·(或×)
来表示原子的最外层电子的式子
( 1 ) 原子的电子式:
( 2 ) 离子的电子式:
① 简单阳离子的电子式
一般用 表示
R
n-
② 简单阴离子的电子式
即离子符号
定义
1
书写
2
(3)离子化合物的电子式:
由阳离子、阴离子的电子式组合而成.
AB型
AB2型
A2B型
【注意】相同的离子不能写在一起
Mg
2
Br
2
Mg
2
Br
Br
电子式
3
请你试一试
练习:写出 KF、Na2S、氧化钙、硫化钾 的电子式
电子式
3
原理
阳离子:离子符号、
R
n-
阴离子:
(4) 用电子式表示离子化合物的形成过程
电子式
3
原子
电子式
离子
电子式
用电子式表示氯化钠的形成过程
用电子式表示溴化镁(MgBr2)的形成过程
注意:
1、相同的原子可以合并写,相同的离子要单个写;
2、不能把“→”写成“==”;
3、用箭头标明电子转移方向。
电子式
3
〖课堂反馈〗
用电子式表示下列离子化合物的形成过程:
BaCl2:_________________________________;
NaF:_____________________;
MgS:_______________________;
K2O:__________________________。
延时符
谢 谢 聆 听 !
