2.3气体摩尔体积2022-2023学年高一上学期化学人教版(2019)必修第一册(19张)
文档属性
| 名称 | 2.3气体摩尔体积2022-2023学年高一上学期化学人教版(2019)必修第一册(19张) |  | |
| 格式 | pptx | ||
| 文件大小 | 1018.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-25 09:15:42 | ||
图片预览






文档简介
(共19张PPT)
第三节 物质的量
气体摩尔体积
提出问题
1
1mol气体的体积相同
1mol液体的体积不相同
1mol固体的体积不相同
有规律
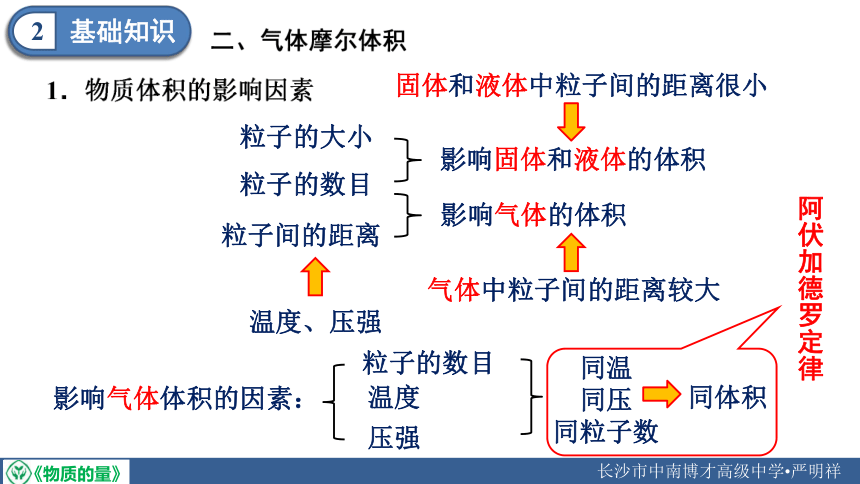
基础知识
2
粒子的大小
粒子的数目
粒子间的距离
影响固体和液体的体积
固体和液体中粒子间的距离很小
影响气体的体积
气体中粒子间的距离较大
温度、压强
影响气体体积的因素:
粒子的数目
温度
压强
同温
同压
同粒子数
同体积
阿伏加德罗定律
温度
压强
物质的量
大
小
22.4 L/mol
0℃、101kPa
25℃、101kPa
1、求标准状况下,16gO2的体积。
随堂练习
4
解:
M(O2)=32g/mol
n(O2)=
16g
32g/mol
=0.5mol
V(O2)=
答:
0.5mol×22.4L/mol
=11.2L
标准状况下,16gO2为11.2L。
2、标准状况下,5.6LO2中有多少O2分子?
解:
n(O2)=
5.6L
22.4L/mol
=0.25mol
N(O2)=
0.25mol×6.02×1023/mol
=1.505×1023
答:
标准状况下,5.6gO2中有1.505×1023 个O2分子。
效果验收
5
2.0 mol
44.8 L
1.204×1024
4.816×1024
知识扩展
6
阿伏加德罗定律及推论
吹气球
阿伏加德罗定律及推论
轮胎充气
A
巩固练习
7
A
B
B
47.6
1.5
11.2
56
课后作业
8
听课手册 P72~76
气体摩尔体积
第三节 物质的量
气体摩尔体积
提出问题
1
1mol气体的体积相同
1mol液体的体积不相同
1mol固体的体积不相同
有规律
基础知识
2
粒子的大小
粒子的数目
粒子间的距离
影响固体和液体的体积
固体和液体中粒子间的距离很小
影响气体的体积
气体中粒子间的距离较大
温度、压强
影响气体体积的因素:
粒子的数目
温度
压强
同温
同压
同粒子数
同体积
阿伏加德罗定律
温度
压强
物质的量
大
小
22.4 L/mol
0℃、101kPa
25℃、101kPa
1、求标准状况下,16gO2的体积。
随堂练习
4
解:
M(O2)=32g/mol
n(O2)=
16g
32g/mol
=0.5mol
V(O2)=
答:
0.5mol×22.4L/mol
=11.2L
标准状况下,16gO2为11.2L。
2、标准状况下,5.6LO2中有多少O2分子?
解:
n(O2)=
5.6L
22.4L/mol
=0.25mol
N(O2)=
0.25mol×6.02×1023/mol
=1.505×1023
答:
标准状况下,5.6gO2中有1.505×1023 个O2分子。
效果验收
5
2.0 mol
44.8 L
1.204×1024
4.816×1024
知识扩展
6
阿伏加德罗定律及推论
吹气球
阿伏加德罗定律及推论
轮胎充气
A
巩固练习
7
A
B
B
47.6
1.5
11.2
56
课后作业
8
听课手册 P72~76
气体摩尔体积
