4.4化学式与化合价(第2课时 )课件--2022-2023学年九年级化学人教版上册(共34张PPT)
文档属性
| 名称 | 4.4化学式与化合价(第2课时 )课件--2022-2023学年九年级化学人教版上册(共34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-24 23:11:50 | ||
图片预览





文档简介
(共34张PPT)
第四单元 自然界的水
课题4 化学式与化合价
第2课时
H
H
O
H
H
O
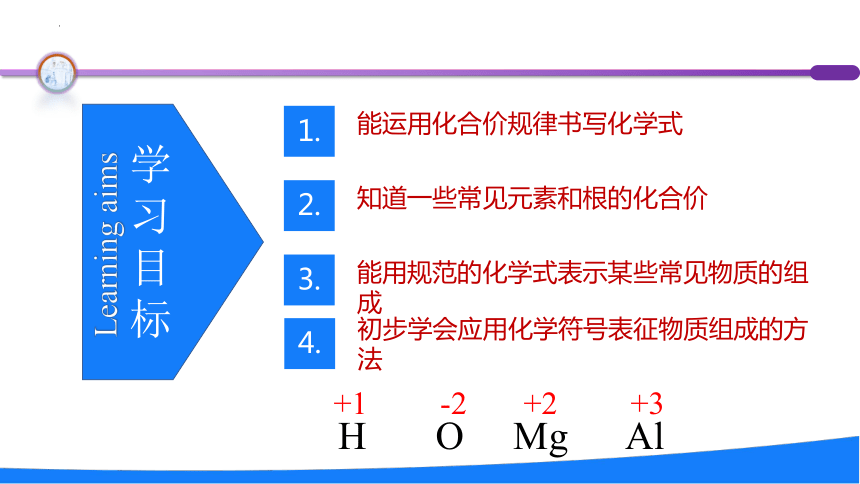
学
习
目
标
Learning aims
1.
能运用化合价规律书写化学式
2.
知道一些常见元素和根的化合价
3.
能用规范的化学式表示某些常见物质的组成
H O Mg Al
+1 -2 +2 +3
4.
初步学会应用化学符号表征物质组成的方法
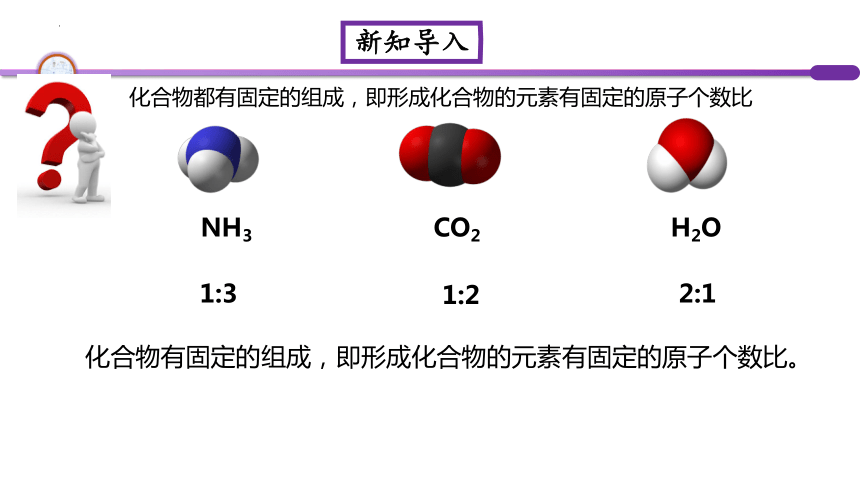
NH3
CO2
H2O
1:3
1:2
2:1
化合物都有固定的组成,即形成化合物的元素有固定的原子个数比
新知导入
化合物有固定的组成,即形成化合物的元素有固定的原子个数比。
【思考】化学式中的各原子个数比为何都是固定且唯一的?
在形成化合物时,各原子为了使其结构达到稳定,即最外层电子数达到8,不同原子的个数比是电子数目不同造成的。
思考交流
我们如何知道不同元素是以什么样的原子个数比相互结合呢?
+17
8
2
8
Cl-
+11
2
8
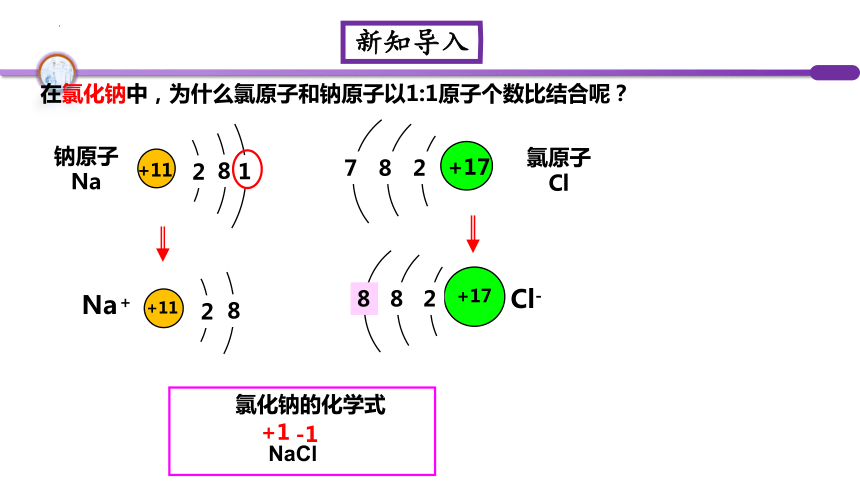
钠原子
Na
+17
8
2
7
氯原子
Cl
+11
2
8
Na+
1
+1
-1
在氯化钠中,为什么氯原子和钠原子以1:1原子个数比结合呢?
氯化钠的化学式
NaCl
新知导入
2
7
8
+17
Cl
2
7
8
+17
Cl
2
2
8
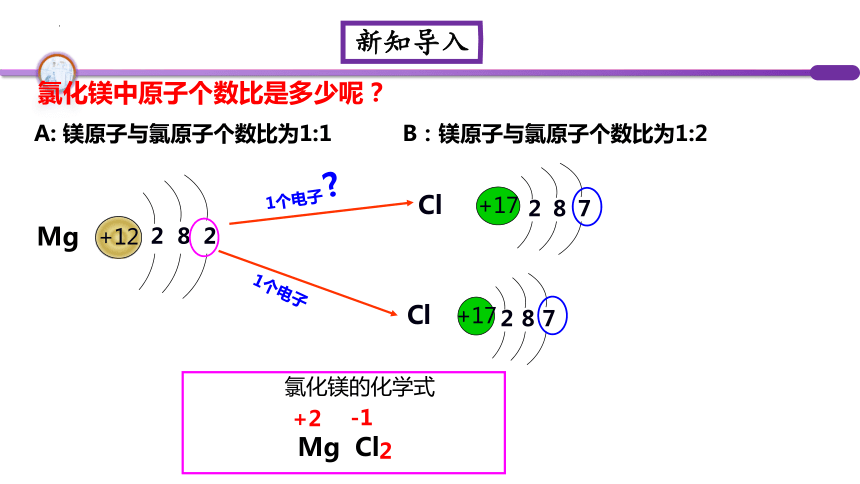
+12
Mg
?
1个电子
1个电子
+2
-1
氯化镁中原子个数比是多少呢?
A: 镁原子与氯原子个数比为1:1 B:镁原子与氯原子个数比为1:2
氯化镁的化学式
Mg Cl
2
新知导入
化学上用“化合价”来确定化合物中原子或离子之间相互结合的数量关系。元素的化合价是元素的原子在形成化合物时表现出来的一种性质。
但是化合价≠原子个数比
化合价有正、有负
新知导入
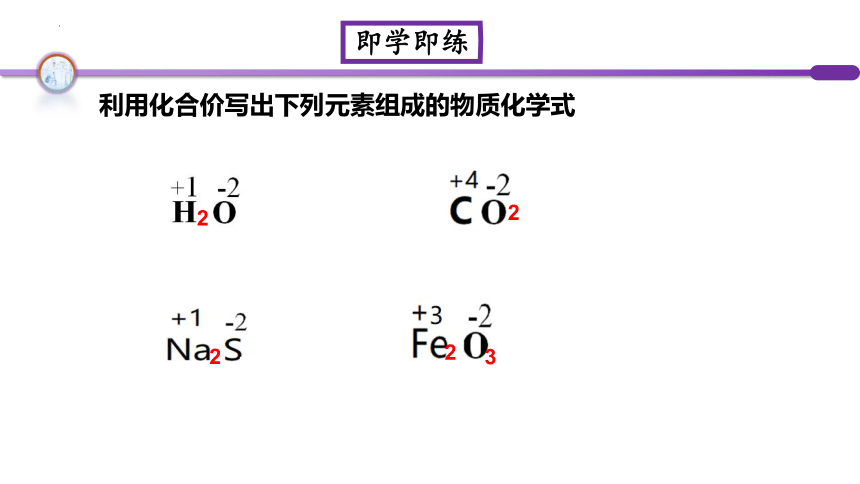
利用化合价写出下列元素组成的物质化学式
2
2
2
2
3
即学即练
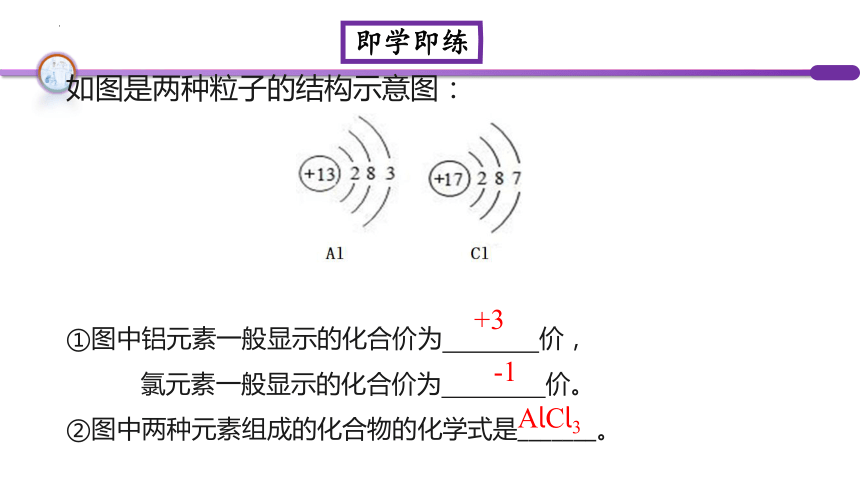
①图中铝元素一般显示的化合价为 价,
氯元素一般显示的化合价为 价。
②图中两种元素组成的化合物的化学式是_______。
+3
AlCl3
如图是两种粒子的结构示意图:
-1
即学即练
化合价的表示方法
1. 写在元素符号的正上方。
2. “+”、“-”符号在前,数值在后。
3. “1”不能省略。
例如:NaCl H2O
+1
-1
+1
-2
新知探究
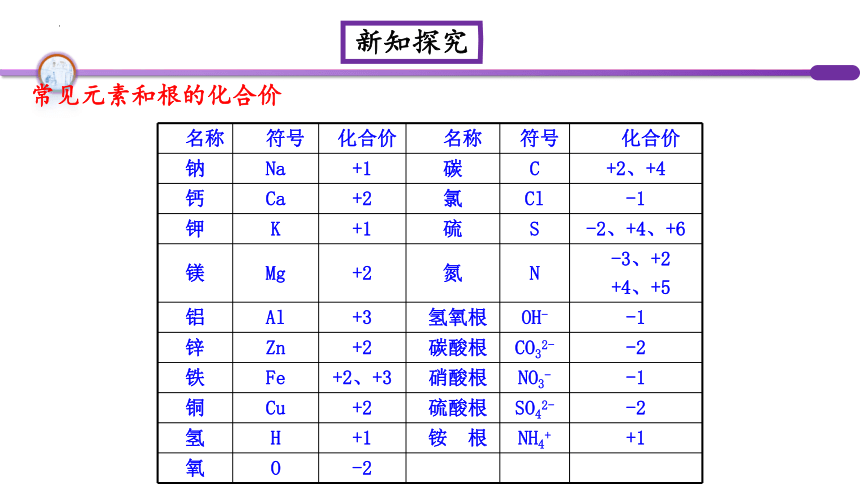
名称 符号 化合价 名称 符号 化合价
钠 Na +1 碳 C +2、+4
钙 Ca +2 氯 Cl -1
钾 K +1 硫 S -2、+4、+6
镁 Mg +2 氮 N -3、+2
+4、+5
铝 Al +3 氢氧根 OH- -1
锌 Zn +2 碳酸根 CO32- -2
铁 Fe +2、+3 硝酸根 NO3- -1
铜 Cu +2 硫酸根 SO42- -2
氢 H +1 铵 根 NH4+ +1
氧 O -2
常见元素和根的化合价
新知探究
常见元素化合价的记忆口诀:
钾 钠 银 氢 正一价, 钙 镁 钡 锌 正二价,
氟 氯 溴 碘 负一价, 通常 氧 是 负二价
铜正 二 铁二 三 , 三铝 四硅 五价磷
单质元素价为零
负一 硝酸 氢氧根,
负二 碳酸 硫酸根,
正一价的是铵根。
新知探究
(1)化合价有正价和负价。(氢+1氧-2,金正非负)
MgCl2 KClO3
+2 -1
+5
(2)在化合物里,正负化合价的代数和为0。
+1 -2
H2 O
正价数(+1×2) + 负价数(-2×1)=0
新知探究
化合价的一般规律:
(3)同种元素在不同的物质里可显不同的化合价。
(4)在单质里,元素的化合价为0。
+3
+2
+7
+6
0 0 0 0
O2 N2 H2 Fe
Fe2O3 FeO KMnO4 K2MnO4
新知探究
化合价的一般规律:
5.金属元素和非金属元素化合时,金属元素显正价,非金属元素显负价。
6.在化合物里,氧元素通常显-2价,氢元素通常显+1价。
NaCl CaCl2 AlCl3 KCl MgCl2
+1
-1
+1
-1
-1
-1
-1
+2
+2
+3
HCl H2S H2O
+1
+1
-1
-2
+1
-2
新知探究
化合价与离子符号的区别与联系
新知探究
原子最外层电子数 离子符号 化合价 相同之处
Mg 2
Al 3 Cl 7 O 6 Mg2+
Mg
+2
Al3+
Al
+3
Cl-
Cl
-1
O2-
O
-2
数值相等
正负相同
新知探究
化合价与离子符号的联系
①在化学反应中容易失去电子的是_____(填序号);因此在化学反应中该元素一般显示的化合价为______,其形成的离子符号为________。
②图中两种元素组成的化合物的化学式是_______。
A
+3
Al3+
AlCl3
1.如图是两种粒子的结构示意图:
即学即练
SO42-
2个硫酸根
一个硫酸根带两个单位的负电荷
1个硫酸根含有4个氧原子
2
-2
硫酸根显负二价
原子团:整体可看作一个离子,又叫根。
知识拓展
名称 符号 化合价 化合物 读法
氢氧根 OH- -1 NaOH
硝酸根 NO3- -1 KNO3
硫酸根 SO42- -2 CuSO4 碳酸根 CO32- -2 CaCO3 铵根 NH4+ +1 NH4Cl
氢氧化*
*酸*
物质分类技巧:*化*、*酸*都属于化合物(纯净物)。
氯化铵
知识拓展
(1)两个碳酸根__________;
(2)四个氢氧根__________;
(3)三个硫酸根__________;
(4)四个铵根____________;
2CO32-
2OH-
3SO42-
4NH4+
(5)氨气____________。
NH3
1.按照要求用化学用语填空。
即学即练
①正前负后,标价态:P O
(1)十字交叉法
约简:把原子个数约成最简比。如:C2O4 CO2
1.根据元素化合价写化学式
原则:化合物里,正负化合价的代数和为零。
化合价的应用
+5 -2
②交叉约简:P O
+5 -2
2
5
P2O5
例外:H2O2不用约简
+4 -2
约简
新知探究
1.教材P89:5;6
5:BaO
SO2
CO
N2O5
MgO
CaO
6:KCl
FeCl2
AlCl3
即学即练
1.地中含量最的金属元素所形成的氧化物的化学式为 。
2.地壳中含量居前两位的元素所形成化合物的化学式为 。
Al2O3
SiO2
中考链接
1.含有原子团的化合物的化学式的书写
碳酸钙: _________ 碳酸钠:___________
硫酸铝:__________ 硫酸铵:___________
硫酸铁:__________ 硫酸亚铁:_________
硝酸钠:__________ 硝酸钡:___________
氢氧化钠:________ 氢氧化钙:_________
CaCO3
Na2CO3
Al2(SO4)3
(NH4)2SO4
NaOH
Ca(OH)2
Fe2(SO4)3
FeSO4
NaNO3
Ba(NO3)2
当堂检测
2.根据化学式求化合价(氢+1氧-2为标准)
【练习】1.标出画线元素的化合价
Fe2O3(氧化铁) FeO(氧化亚铁)
Fe2+(亚铁离子) Fe3+(铁离子)
KMnO4(高锰酸钾) K2MnO4(锰酸钾)
NH4NO3(硝酸铵) SO42- H2O2
+3
+2
+7
+6
-3
+5
-1
+6
+2
+3
当堂检测
1.教材P89:2(4)、3、4
2(4):B
3:+4
+1
+2
+1
+6
4:+2
+4
+5
-3
即学即练
1.化合价标注在元素符号的_________。
2.在化合物中,H通常显_____价,O通常显_____价。金属元素通常显_____价,非金属元素通常显_____价。
3.单质中元素的化合价为_____。
4.一种元素在不同的化合物中可显不同价态。
如:Fe2O3读作__________;FeO读作__________。
5.一种元素在同一种化合物中可显不同价态。如:NH4NO3
6.根据化合价书写化学式所依据的原则为:在化合物里,元素正负化合价代数和为 。
7.化合价与离子符号的相同点: 相等, 相同。
正上方
+1
-2
正
负
0
氧化铁
氧化亚铁
-3
+5
0
数值
正负
课堂小结
1.如图是两种原子的原子结构示意图:
(1)A形成的离子符号为 ;B形成的离子符号为 ;(2)写出A和B能形成化合物的化学式 。
A
B
Mg2+
MgCl2
Cl2+
当堂检测
2.请用化学用语填空:
(1)氦气 ;
(2)3个亚铁离子 ;
(3)2个铁离子 ;
(4)MgO中Mg的化合价为 ;
(5)氯酸钾中氯元素显+5价 ;
(6)标出五氧化二磷中磷元素的化合价 。
He
3Fe2+
2Fe3+
KClO3
+5
P2O2
+5
+2
当堂检测
1.“嫦蛾四号”探测到月娱中含橄榄石(主要成分Mg2SiO4),Mg2SiO4中硅元素中的化合价是 。
+4
2.2020年我国在抗击新冠中取得了重大成果。为防控疫情在公共场所使用84消毒液(主要成分是NaC1O)进行消毒。NaClO中氯元素的化合价是( )
A.-1 B.0 C.+1 D.+5
C
中考链接
3.笑气(N2O)是一种违禁品,长期吸入会危害身体健康。N2O中氮元素的化合价为( )
A.+2 B.+1 C.-2 D.-1
B
4.C3N4是一种新型材料,其中碳元素的化合价为+4价,则氨元素的化合价为( )
A.-4 B.+3 C.+4 D.-3
D
中考链接
5.成语“饮鸩止渴”中“鸩”是指放了砒霜的酒。砒霜是砷(As)的氧化物,有剧毒。砒霜中砷的化合价是+3价,则砒霜的化学式为( )
A.As2O B.AsO C.As2O3 D.AsO2
C
6.稀土元素铕(Eu)是激光及原子能应用的重要的材料。已知氯化铕的化学式为EuC13,则氧化铕的化学式为( )A.EuO B.Eu2O3 C.Eu3O2 D.EuO3
B
中考链接
第四单元 自然界的水
课题4 化学式与化合价
第2课时
H
H
O
H
H
O
学
习
目
标
Learning aims
1.
能运用化合价规律书写化学式
2.
知道一些常见元素和根的化合价
3.
能用规范的化学式表示某些常见物质的组成
H O Mg Al
+1 -2 +2 +3
4.
初步学会应用化学符号表征物质组成的方法
NH3
CO2
H2O
1:3
1:2
2:1
化合物都有固定的组成,即形成化合物的元素有固定的原子个数比
新知导入
化合物有固定的组成,即形成化合物的元素有固定的原子个数比。
【思考】化学式中的各原子个数比为何都是固定且唯一的?
在形成化合物时,各原子为了使其结构达到稳定,即最外层电子数达到8,不同原子的个数比是电子数目不同造成的。
思考交流
我们如何知道不同元素是以什么样的原子个数比相互结合呢?
+17
8
2
8
Cl-
+11
2
8
钠原子
Na
+17
8
2
7
氯原子
Cl
+11
2
8
Na+
1
+1
-1
在氯化钠中,为什么氯原子和钠原子以1:1原子个数比结合呢?
氯化钠的化学式
NaCl
新知导入
2
7
8
+17
Cl
2
7
8
+17
Cl
2
2
8
+12
Mg
?
1个电子
1个电子
+2
-1
氯化镁中原子个数比是多少呢?
A: 镁原子与氯原子个数比为1:1 B:镁原子与氯原子个数比为1:2
氯化镁的化学式
Mg Cl
2
新知导入
化学上用“化合价”来确定化合物中原子或离子之间相互结合的数量关系。元素的化合价是元素的原子在形成化合物时表现出来的一种性质。
但是化合价≠原子个数比
化合价有正、有负
新知导入
利用化合价写出下列元素组成的物质化学式
2
2
2
2
3
即学即练
①图中铝元素一般显示的化合价为 价,
氯元素一般显示的化合价为 价。
②图中两种元素组成的化合物的化学式是_______。
+3
AlCl3
如图是两种粒子的结构示意图:
-1
即学即练
化合价的表示方法
1. 写在元素符号的正上方。
2. “+”、“-”符号在前,数值在后。
3. “1”不能省略。
例如:NaCl H2O
+1
-1
+1
-2
新知探究
名称 符号 化合价 名称 符号 化合价
钠 Na +1 碳 C +2、+4
钙 Ca +2 氯 Cl -1
钾 K +1 硫 S -2、+4、+6
镁 Mg +2 氮 N -3、+2
+4、+5
铝 Al +3 氢氧根 OH- -1
锌 Zn +2 碳酸根 CO32- -2
铁 Fe +2、+3 硝酸根 NO3- -1
铜 Cu +2 硫酸根 SO42- -2
氢 H +1 铵 根 NH4+ +1
氧 O -2
常见元素和根的化合价
新知探究
常见元素化合价的记忆口诀:
钾 钠 银 氢 正一价, 钙 镁 钡 锌 正二价,
氟 氯 溴 碘 负一价, 通常 氧 是 负二价
铜正 二 铁二 三 , 三铝 四硅 五价磷
单质元素价为零
负一 硝酸 氢氧根,
负二 碳酸 硫酸根,
正一价的是铵根。
新知探究
(1)化合价有正价和负价。(氢+1氧-2,金正非负)
MgCl2 KClO3
+2 -1
+5
(2)在化合物里,正负化合价的代数和为0。
+1 -2
H2 O
正价数(+1×2) + 负价数(-2×1)=0
新知探究
化合价的一般规律:
(3)同种元素在不同的物质里可显不同的化合价。
(4)在单质里,元素的化合价为0。
+3
+2
+7
+6
0 0 0 0
O2 N2 H2 Fe
Fe2O3 FeO KMnO4 K2MnO4
新知探究
化合价的一般规律:
5.金属元素和非金属元素化合时,金属元素显正价,非金属元素显负价。
6.在化合物里,氧元素通常显-2价,氢元素通常显+1价。
NaCl CaCl2 AlCl3 KCl MgCl2
+1
-1
+1
-1
-1
-1
-1
+2
+2
+3
HCl H2S H2O
+1
+1
-1
-2
+1
-2
新知探究
化合价与离子符号的区别与联系
新知探究
原子最外层电子数 离子符号 化合价 相同之处
Mg 2
Al 3 Cl 7 O 6 Mg2+
Mg
+2
Al3+
Al
+3
Cl-
Cl
-1
O2-
O
-2
数值相等
正负相同
新知探究
化合价与离子符号的联系
①在化学反应中容易失去电子的是_____(填序号);因此在化学反应中该元素一般显示的化合价为______,其形成的离子符号为________。
②图中两种元素组成的化合物的化学式是_______。
A
+3
Al3+
AlCl3
1.如图是两种粒子的结构示意图:
即学即练
SO42-
2个硫酸根
一个硫酸根带两个单位的负电荷
1个硫酸根含有4个氧原子
2
-2
硫酸根显负二价
原子团:整体可看作一个离子,又叫根。
知识拓展
名称 符号 化合价 化合物 读法
氢氧根 OH- -1 NaOH
硝酸根 NO3- -1 KNO3
硫酸根 SO42- -2 CuSO4 碳酸根 CO32- -2 CaCO3 铵根 NH4+ +1 NH4Cl
氢氧化*
*酸*
物质分类技巧:*化*、*酸*都属于化合物(纯净物)。
氯化铵
知识拓展
(1)两个碳酸根__________;
(2)四个氢氧根__________;
(3)三个硫酸根__________;
(4)四个铵根____________;
2CO32-
2OH-
3SO42-
4NH4+
(5)氨气____________。
NH3
1.按照要求用化学用语填空。
即学即练
①正前负后,标价态:P O
(1)十字交叉法
约简:把原子个数约成最简比。如:C2O4 CO2
1.根据元素化合价写化学式
原则:化合物里,正负化合价的代数和为零。
化合价的应用
+5 -2
②交叉约简:P O
+5 -2
2
5
P2O5
例外:H2O2不用约简
+4 -2
约简
新知探究
1.教材P89:5;6
5:BaO
SO2
CO
N2O5
MgO
CaO
6:KCl
FeCl2
AlCl3
即学即练
1.地中含量最的金属元素所形成的氧化物的化学式为 。
2.地壳中含量居前两位的元素所形成化合物的化学式为 。
Al2O3
SiO2
中考链接
1.含有原子团的化合物的化学式的书写
碳酸钙: _________ 碳酸钠:___________
硫酸铝:__________ 硫酸铵:___________
硫酸铁:__________ 硫酸亚铁:_________
硝酸钠:__________ 硝酸钡:___________
氢氧化钠:________ 氢氧化钙:_________
CaCO3
Na2CO3
Al2(SO4)3
(NH4)2SO4
NaOH
Ca(OH)2
Fe2(SO4)3
FeSO4
NaNO3
Ba(NO3)2
当堂检测
2.根据化学式求化合价(氢+1氧-2为标准)
【练习】1.标出画线元素的化合价
Fe2O3(氧化铁) FeO(氧化亚铁)
Fe2+(亚铁离子) Fe3+(铁离子)
KMnO4(高锰酸钾) K2MnO4(锰酸钾)
NH4NO3(硝酸铵) SO42- H2O2
+3
+2
+7
+6
-3
+5
-1
+6
+2
+3
当堂检测
1.教材P89:2(4)、3、4
2(4):B
3:+4
+1
+2
+1
+6
4:+2
+4
+5
-3
即学即练
1.化合价标注在元素符号的_________。
2.在化合物中,H通常显_____价,O通常显_____价。金属元素通常显_____价,非金属元素通常显_____价。
3.单质中元素的化合价为_____。
4.一种元素在不同的化合物中可显不同价态。
如:Fe2O3读作__________;FeO读作__________。
5.一种元素在同一种化合物中可显不同价态。如:NH4NO3
6.根据化合价书写化学式所依据的原则为:在化合物里,元素正负化合价代数和为 。
7.化合价与离子符号的相同点: 相等, 相同。
正上方
+1
-2
正
负
0
氧化铁
氧化亚铁
-3
+5
0
数值
正负
课堂小结
1.如图是两种原子的原子结构示意图:
(1)A形成的离子符号为 ;B形成的离子符号为 ;(2)写出A和B能形成化合物的化学式 。
A
B
Mg2+
MgCl2
Cl2+
当堂检测
2.请用化学用语填空:
(1)氦气 ;
(2)3个亚铁离子 ;
(3)2个铁离子 ;
(4)MgO中Mg的化合价为 ;
(5)氯酸钾中氯元素显+5价 ;
(6)标出五氧化二磷中磷元素的化合价 。
He
3Fe2+
2Fe3+
KClO3
+5
P2O2
+5
+2
当堂检测
1.“嫦蛾四号”探测到月娱中含橄榄石(主要成分Mg2SiO4),Mg2SiO4中硅元素中的化合价是 。
+4
2.2020年我国在抗击新冠中取得了重大成果。为防控疫情在公共场所使用84消毒液(主要成分是NaC1O)进行消毒。NaClO中氯元素的化合价是( )
A.-1 B.0 C.+1 D.+5
C
中考链接
3.笑气(N2O)是一种违禁品,长期吸入会危害身体健康。N2O中氮元素的化合价为( )
A.+2 B.+1 C.-2 D.-1
B
4.C3N4是一种新型材料,其中碳元素的化合价为+4价,则氨元素的化合价为( )
A.-4 B.+3 C.+4 D.-3
D
中考链接
5.成语“饮鸩止渴”中“鸩”是指放了砒霜的酒。砒霜是砷(As)的氧化物,有剧毒。砒霜中砷的化合价是+3价,则砒霜的化学式为( )
A.As2O B.AsO C.As2O3 D.AsO2
C
6.稀土元素铕(Eu)是激光及原子能应用的重要的材料。已知氯化铕的化学式为EuC13,则氧化铕的化学式为( )A.EuO B.Eu2O3 C.Eu3O2 D.EuO3
B
中考链接
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
