高中化学人教版(2019)选择性必修1 2.1.2 化学反应速率 活化能(共39张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修1 2.1.2 化学反应速率 活化能(共39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-25 22:10:32 | ||
图片预览








文档简介
(共39张PPT)
第二章 化学反应速率与化学平衡
第一节 化学反应速率
02
影响化学反应
速率的因素
1.化学反应速率的决定因素是
复习
内因
外因
2.化学反应速率的影响因素之——
(1)温度:体系温度越高,速率越大
(2)浓度:反应物浓度越大,速率越大
(3)催化剂:能大大改变速率
(4)固体表面积:块装固体反应速率小于粉末状固体反应速率。
(5)溶剂的性质、光、超声波、磁场等
(6)压强:有气体参与的反应压强越大,速率越大
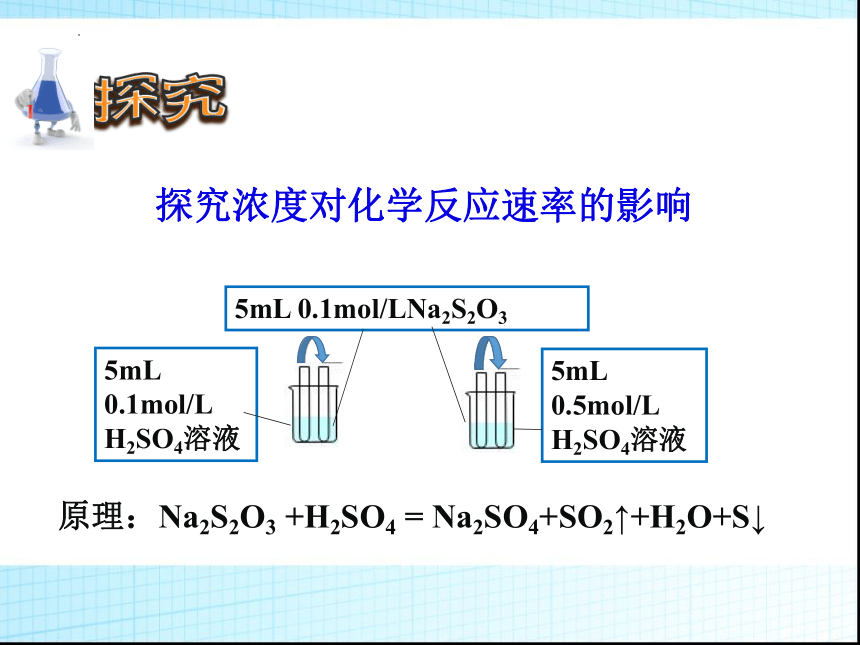
探究浓度对化学反应速率的影响
5mL 0.1mol/LNa2S2O3
5mL 0.1mol/L H2SO4溶液
5mL
0.5mol/L
H2SO4溶液
原理:Na2S2O3 +H2SO4 = Na2SO4+SO2↑+H2O+S↓
探究
1、浓度对化学反应速率的影响
实验目的 试剂种类及用量 实验现象
探究浓度对反应速率的影响 0.1mol/L Na2S2O3溶液5mL 0.1mol/L H2SO4溶液5mL
0.1mol/L Na2S2O3溶液5mL 0.5mol/L H2SO4溶液5mL
变浑浊慢
变浑浊快
结论:当其他条件相同时,增大反应物浓度,化学反应速率增大;降低反应物浓度,化学反应速率减小
外界条件对化学反应速率影响的深度理解
1.浓度对化学反应速率影响的注意事项
(1)固体和纯液体的浓度可视为常数,改变其物质的量,对反应速率无影响。
(2)若某物质的浓度变化改变了其性质,反应实质可能发生改变,要具体分析反应速率的变化(如铁与稀硫酸反应,在一定浓度范围内反应速率与浓度有关,但常温下铁遇浓硫酸钝化)。
(3)固体物质的反应速率与其表面积有关,颗粒越小,表面积越大,反应速率就越快,故块状固体可通过研磨来增大表面积,从而加快反应速率。
(4)对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引起化学反应速率的改变。
名师点拨
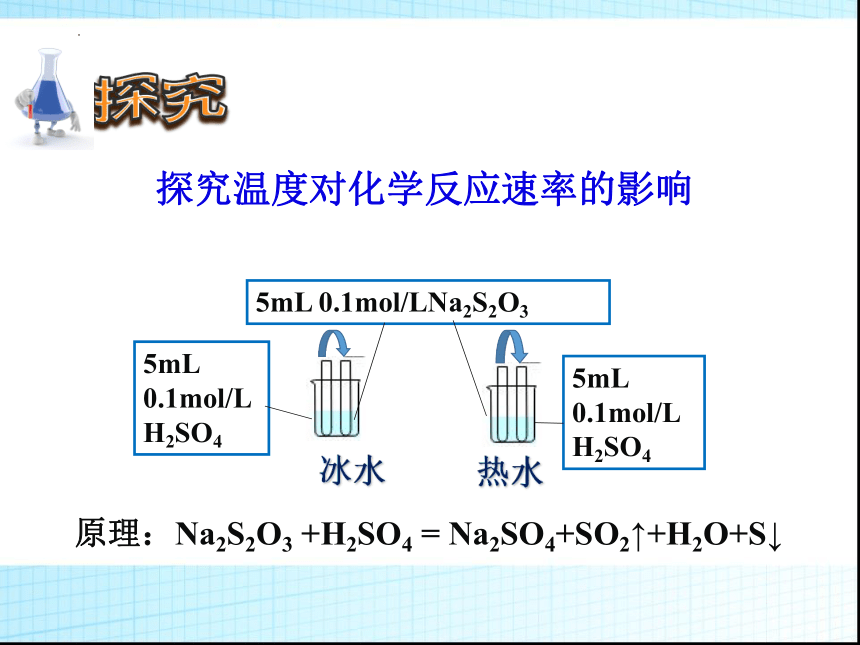
探究温度对化学反应速率的影响
冰水
5mL 0.1mol/LNa2S2O3
5mL 0.1mol/L H2SO4
5mL
0.1mol/L
H2SO4
热水
原理:Na2S2O3 +H2SO4 = Na2SO4+SO2↑+H2O+S↓
探究
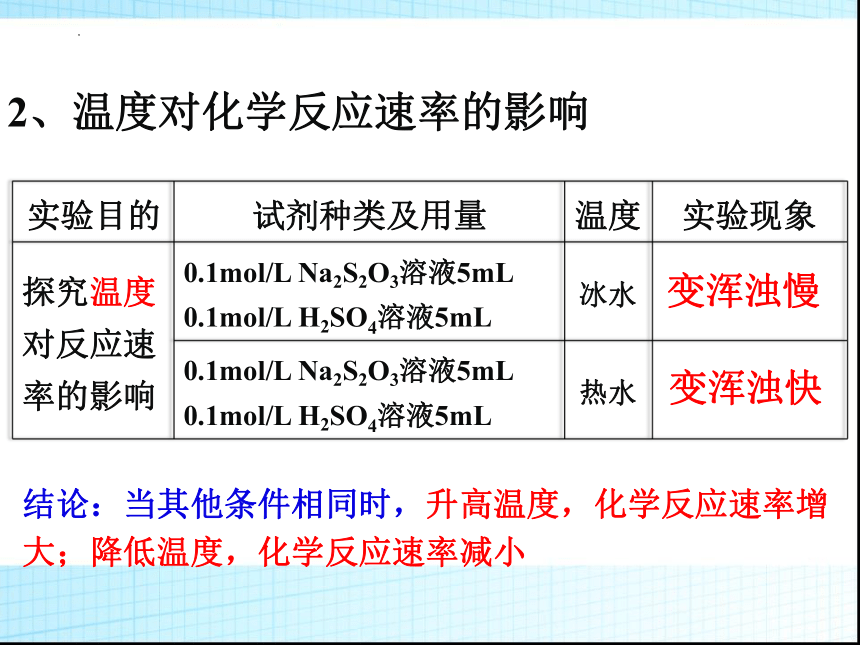
2、温度对化学反应速率的影响
实验目的 试剂种类及用量 温度 实验现象
探究温度对反应速率的影响 0.1mol/L Na2S2O3溶液5mL 0.1mol/L H2SO4溶液5mL 冰水
0.1mol/L Na2S2O3溶液5mL 0.1mol/L H2SO4溶液5mL 热水
变浑浊慢
变浑浊快
结论:当其他条件相同时,升高温度,化学反应速率增大;降低温度,化学反应速率减小
2.温度对化学反应速率影响的注意事项
(1)温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。
(2)对于可逆反应,升高温度,正、逆反应速率都增大,但吸热反应方向的反应速率增大的程度更大;降低温度,正、逆反应速率都减小,但吸热反应方向的反应速率减小的程度更大。
(3)大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍,利用这一规律可以对一些化学反应速率进行粗略估算。
名师点拨
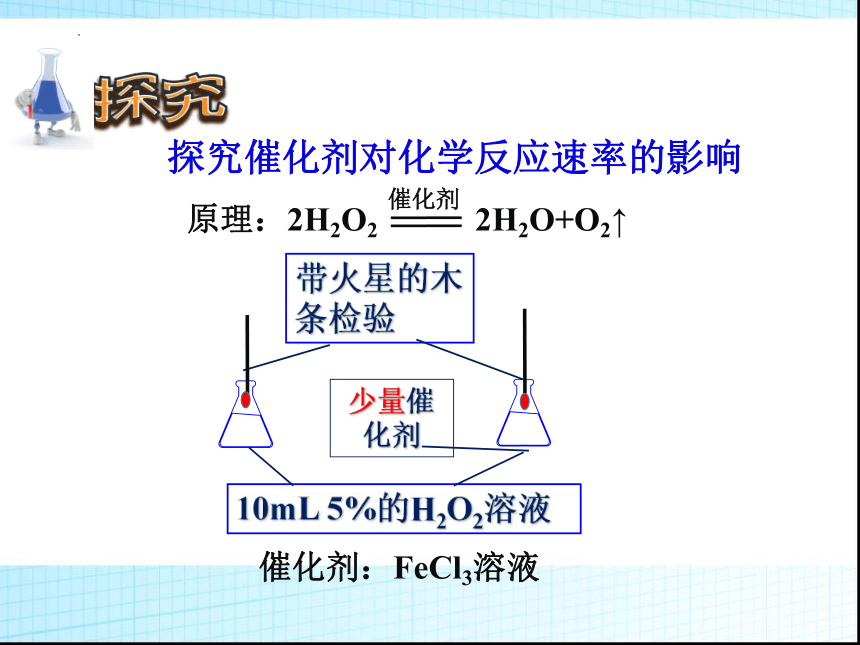
探究催化剂对化学反应速率的影响
原理:2H2O2 2H2O+O2↑
催化剂
10mL 5%的H2O2溶液
少量催化剂
带火星的木条检验
催化剂:FeCl3溶液
探究
实验目的 试剂种类及用量 实验现象
探究催化剂对反应速率的影响 10mL 5%的H2O2溶液
10mL 5%的H2O2溶液 +1mol/L FeCl3溶液
结论:其他条件相同时,加催化剂能增大反应速率。
无明显变化
产生大量气体
3、催化剂对化学反应速率的影响
注意:正催化剂加快化学反应速率,负催化剂减慢化学反应速率(不说明指正催化剂)
3.催化剂对化学反应速率影响的注意事项
(1)催化剂只能改变化学反应速率,不能改变反应方向,也不能改变反应热的大小。
(2)同一催化剂能同等程度地改变化学反应的正、逆反应速率。
(3)同一反应,用不同催化剂,反应速率不相同。正催化剂加快化学反应速率,负催化剂减慢化学反应速率(不说明指正催化剂)
(4)规律:①选用合适的催化剂,能使反应速率增大。
②反应物之间同时发生多个反应时,催化剂有选择性,可以提高目标产物的比率。
名师点拨
1.实验所用的仪器和药品:
锥形瓶
分液漏斗
玻璃导管
乳胶管
注射器(50ml)
铁架台
量筒(50ml)
胶头滴管
秒表
锌粒、1mol/L硫酸、 4 mol/L硫酸
探究压强对化学反应速率的影响
探究
注意事项:
①锌粒的颗粒(即表面积)大小基本相同
②40mL的硫酸溶液要迅速加入
③装置气密性要好,且计时要迅速准确
实验结论
4mol/L的硫酸与锌反应比1mol/L的硫酸与锌反应快。
想一想:压强与化学反应速率有什么关系
4、压强对化学反应速率的影响
针对有气体参加的压强的变化仅由反应容器的容积变化引起的反应,增大压强(减小容器体积)→反应物浓度______→反应速率_____,反之,反应速率_____;对只有固体或纯液体参加的反应,压强变化几乎不影响反应速率。
增大
加快
减慢
4、对有气体参加的反应,压强对化学反应速率的影响可简化理解如下
名师点拨
1、设NO+CO2 CO+NO2(正反应吸热)反应速率为v1;N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、v1减少,v2增大 D、v1增大,v2减小
A
课堂专练
下列调控反应速率的措施或实验中,分别利用或体现了哪些影响反应速率的因素?
(1)向炉膛内鼓风或用煤粉代替煤块可以使炉火更旺。
(2)把食物放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。
(3)做化学实验时,为加速反应的进行,通常将块状或颗粒状的固体药品,研细并混匀或者将固体试剂溶于水配成溶液后再进行实验。
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。
思考讨论
03
活化能
基元反应:一个化学反应往往经过 步骤才能实现,每一步反应都称为基元反应。
反应历程:与 的一组基元反应反映了该反应的反应历程,反应历程又称反应机理。
的反应历程为:
自由基:像上述反应历程中的I 一样,带有单电子的原子或原子团叫自由基,如O 自由基。
多个反应
某化学反应有关
基元反应
1、基元反应与反应历程
例如:
活化能
(1)碰撞特点:碰撞次数非常巨大;不是每次碰撞都能发生化学反应。
(2)有效碰撞
概念:能够发生化学反应的碰撞。
条件:反应分子必须具有一定的能量;有合适的碰撞取向。
实质:有效碰撞能使化学键 , 可以重新组合形成新的化学键,从而发生化学反应。
断裂
自由基
活化能
2、有效碰撞
2、有效碰撞
反应物分子间的碰撞
能够发生化学反应的碰撞
不能够发生化学反应的碰撞
无效碰撞
有效碰撞
a.碰撞时的能量不足
b.碰撞时的取向不合适
c.有效碰撞
活化能
活化能
(1)活化分子:发生有效碰撞的分子必须具有足够的能量,这种能够发生有效碰撞的分子叫做活化分子。
(2)活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
3、活化分子和活化能
活化能越小,普通分子就越 变成活化分子。
容易
4、活化能与反应热:
如上图所示:
E1表示反应的 ;
E2表示活化分子变成生成物分子 ;
E1-E2表示 。
活化能
放出的能量
反应热(即ΔH)
活化能
5、解释化学反应过程
活化能
在一定条件下,活化分子所占的百分数是固定不变的,活化分子的百分数越大,单位体积内 越多,单位时间内 的次数越多,化学反应速率就越快。
活化分子数
有效碰撞
6、活化能与反应速率的关系
活化能
7、运用有效碰撞理论解释外界条件对化学反应速率的影响
(1)运用有效碰撞理论解释浓度对化学反应速率的影响:
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
增大浓度
增加
增加
增加
加快
活化能
①规律:当其他条件不变时,增大反应物的浓度,反应速率加快;反之,反应速率减慢。
②理论解释:
(2)运用有效碰撞理论解释温度对化学反应速率的影响:
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
升高温度
不变
增加
增加
加快
活化能
本质原因:升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。
名师点拨
活化能
(3)运用有效碰撞理论解释催化剂对化学反应速率的影响:
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
使用催化剂
不变
增加
增加
加快
①规律:当其他条件不变时,使用适当的催化剂,较大程度地增大化学反应速率。
②理论解释:
活化能
(4)运用有效碰撞理论解释压强对化学反应速率的影响:
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
增大压强
不变
不变
增加
加快
①规律:当其他条件不变时,对于有气体参加的反应,增大压强(减少容器的容积)相当于增大反应浓度,反应速率加快;减小压强(增大容器的容积)相当于减小反应浓度,反应速率减慢。
②理论解释:
活化能
对于反应N2+3H2 2NH3,不同条件下,压强对化学反应速率的影响
(1)恒温恒容密闭容器
①充入N2,压强 ,c(N2) ,化学反应速率 。
②充入He(注He与反应无关),压强 ,但c(N2)、c(H2)、c(NH3)都 ,化学反应速率 。
(2)恒温恒压密闭容器
充入He,体积 ,c(N2)、c(H2)、c(NH3)都 ,化学反应速率 。
增大
增大
加快
增大
不变
不变
增大
减小
减小
活化能
③、恒温,体积不变(恒温恒容)条件下,充入反应气体
充入反应气
恒温恒容冲反应气
体积不变
浓度c变↑
反应速率v↑
反应物物质的量变大
普通分子
活化分子
④、恒温,体积不变(恒温恒容)条件下,充入惰性气体
充入惰气
恒温恒容冲入惰气
体积不变
浓度c不变
反应物物质的量不变
反应速率v不变
惰性气体
普通分子
活化分子
①增大反应
物的浓度
单位体积内分子总数
活化分子百分数
单位体积内活化分子总数
单位体积内有效碰撞次数增加
增多
不变
②增大压强
③升高温度
单位体积内分子总数
活化分子百分数
不变
增大
增加
④加催化剂
反应速率加快
注意:
①活化分子数变,反应速率不一定变;但活化分子百分数变,则反应速率一定变。
②对于可逆反应,升温、加压,加入催化剂既加快正反应速率又加快逆反应速率。
归纳小结
增大反应物的浓度:
单位体积内分子总数
活化分子百分数
单位体积内活化分子总数
单位体积内有效碰撞次数增加
增多
增大压强(压缩体积):
增加
不变
2.简单碰撞理论解释化学反应速率的影响因素
反应速率加快
活化分子百分数 =
×100%
活化分子数
反应物分子总数
单位体积内分子总数
活化分子百分数
单位体积内活化分子总数增加
单位体积内有效碰撞次数增加
不变
增大
加催化剂:
升高温度:
反应速率加快
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
影响化学反应速率的外因
①增大固体表面积;②金属与酸反应生成H2时,构成原电池;③光照、电磁波、超声波、放射性辐射、高速研磨等向反应体系输入能量,都有可能改变反应速率
各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)。
各种影响都有其局限性,要针对具体反应具体分析。
5、其它因素
第二章 化学反应速率与化学平衡
第一节 化学反应速率
02
影响化学反应
速率的因素
1.化学反应速率的决定因素是
复习
内因
外因
2.化学反应速率的影响因素之——
(1)温度:体系温度越高,速率越大
(2)浓度:反应物浓度越大,速率越大
(3)催化剂:能大大改变速率
(4)固体表面积:块装固体反应速率小于粉末状固体反应速率。
(5)溶剂的性质、光、超声波、磁场等
(6)压强:有气体参与的反应压强越大,速率越大
探究浓度对化学反应速率的影响
5mL 0.1mol/LNa2S2O3
5mL 0.1mol/L H2SO4溶液
5mL
0.5mol/L
H2SO4溶液
原理:Na2S2O3 +H2SO4 = Na2SO4+SO2↑+H2O+S↓
探究
1、浓度对化学反应速率的影响
实验目的 试剂种类及用量 实验现象
探究浓度对反应速率的影响 0.1mol/L Na2S2O3溶液5mL 0.1mol/L H2SO4溶液5mL
0.1mol/L Na2S2O3溶液5mL 0.5mol/L H2SO4溶液5mL
变浑浊慢
变浑浊快
结论:当其他条件相同时,增大反应物浓度,化学反应速率增大;降低反应物浓度,化学反应速率减小
外界条件对化学反应速率影响的深度理解
1.浓度对化学反应速率影响的注意事项
(1)固体和纯液体的浓度可视为常数,改变其物质的量,对反应速率无影响。
(2)若某物质的浓度变化改变了其性质,反应实质可能发生改变,要具体分析反应速率的变化(如铁与稀硫酸反应,在一定浓度范围内反应速率与浓度有关,但常温下铁遇浓硫酸钝化)。
(3)固体物质的反应速率与其表面积有关,颗粒越小,表面积越大,反应速率就越快,故块状固体可通过研磨来增大表面积,从而加快反应速率。
(4)对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引起化学反应速率的改变。
名师点拨
探究温度对化学反应速率的影响
冰水
5mL 0.1mol/LNa2S2O3
5mL 0.1mol/L H2SO4
5mL
0.1mol/L
H2SO4
热水
原理:Na2S2O3 +H2SO4 = Na2SO4+SO2↑+H2O+S↓
探究
2、温度对化学反应速率的影响
实验目的 试剂种类及用量 温度 实验现象
探究温度对反应速率的影响 0.1mol/L Na2S2O3溶液5mL 0.1mol/L H2SO4溶液5mL 冰水
0.1mol/L Na2S2O3溶液5mL 0.1mol/L H2SO4溶液5mL 热水
变浑浊慢
变浑浊快
结论:当其他条件相同时,升高温度,化学反应速率增大;降低温度,化学反应速率减小
2.温度对化学反应速率影响的注意事项
(1)温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。
(2)对于可逆反应,升高温度,正、逆反应速率都增大,但吸热反应方向的反应速率增大的程度更大;降低温度,正、逆反应速率都减小,但吸热反应方向的反应速率减小的程度更大。
(3)大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍,利用这一规律可以对一些化学反应速率进行粗略估算。
名师点拨
探究催化剂对化学反应速率的影响
原理:2H2O2 2H2O+O2↑
催化剂
10mL 5%的H2O2溶液
少量催化剂
带火星的木条检验
催化剂:FeCl3溶液
探究
实验目的 试剂种类及用量 实验现象
探究催化剂对反应速率的影响 10mL 5%的H2O2溶液
10mL 5%的H2O2溶液 +1mol/L FeCl3溶液
结论:其他条件相同时,加催化剂能增大反应速率。
无明显变化
产生大量气体
3、催化剂对化学反应速率的影响
注意:正催化剂加快化学反应速率,负催化剂减慢化学反应速率(不说明指正催化剂)
3.催化剂对化学反应速率影响的注意事项
(1)催化剂只能改变化学反应速率,不能改变反应方向,也不能改变反应热的大小。
(2)同一催化剂能同等程度地改变化学反应的正、逆反应速率。
(3)同一反应,用不同催化剂,反应速率不相同。正催化剂加快化学反应速率,负催化剂减慢化学反应速率(不说明指正催化剂)
(4)规律:①选用合适的催化剂,能使反应速率增大。
②反应物之间同时发生多个反应时,催化剂有选择性,可以提高目标产物的比率。
名师点拨
1.实验所用的仪器和药品:
锥形瓶
分液漏斗
玻璃导管
乳胶管
注射器(50ml)
铁架台
量筒(50ml)
胶头滴管
秒表
锌粒、1mol/L硫酸、 4 mol/L硫酸
探究压强对化学反应速率的影响
探究
注意事项:
①锌粒的颗粒(即表面积)大小基本相同
②40mL的硫酸溶液要迅速加入
③装置气密性要好,且计时要迅速准确
实验结论
4mol/L的硫酸与锌反应比1mol/L的硫酸与锌反应快。
想一想:压强与化学反应速率有什么关系
4、压强对化学反应速率的影响
针对有气体参加的压强的变化仅由反应容器的容积变化引起的反应,增大压强(减小容器体积)→反应物浓度______→反应速率_____,反之,反应速率_____;对只有固体或纯液体参加的反应,压强变化几乎不影响反应速率。
增大
加快
减慢
4、对有气体参加的反应,压强对化学反应速率的影响可简化理解如下
名师点拨
1、设NO+CO2 CO+NO2(正反应吸热)反应速率为v1;N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、v1减少,v2增大 D、v1增大,v2减小
A
课堂专练
下列调控反应速率的措施或实验中,分别利用或体现了哪些影响反应速率的因素?
(1)向炉膛内鼓风或用煤粉代替煤块可以使炉火更旺。
(2)把食物放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。
(3)做化学实验时,为加速反应的进行,通常将块状或颗粒状的固体药品,研细并混匀或者将固体试剂溶于水配成溶液后再进行实验。
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。
思考讨论
03
活化能
基元反应:一个化学反应往往经过 步骤才能实现,每一步反应都称为基元反应。
反应历程:与 的一组基元反应反映了该反应的反应历程,反应历程又称反应机理。
的反应历程为:
自由基:像上述反应历程中的I 一样,带有单电子的原子或原子团叫自由基,如O 自由基。
多个反应
某化学反应有关
基元反应
1、基元反应与反应历程
例如:
活化能
(1)碰撞特点:碰撞次数非常巨大;不是每次碰撞都能发生化学反应。
(2)有效碰撞
概念:能够发生化学反应的碰撞。
条件:反应分子必须具有一定的能量;有合适的碰撞取向。
实质:有效碰撞能使化学键 , 可以重新组合形成新的化学键,从而发生化学反应。
断裂
自由基
活化能
2、有效碰撞
2、有效碰撞
反应物分子间的碰撞
能够发生化学反应的碰撞
不能够发生化学反应的碰撞
无效碰撞
有效碰撞
a.碰撞时的能量不足
b.碰撞时的取向不合适
c.有效碰撞
活化能
活化能
(1)活化分子:发生有效碰撞的分子必须具有足够的能量,这种能够发生有效碰撞的分子叫做活化分子。
(2)活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
3、活化分子和活化能
活化能越小,普通分子就越 变成活化分子。
容易
4、活化能与反应热:
如上图所示:
E1表示反应的 ;
E2表示活化分子变成生成物分子 ;
E1-E2表示 。
活化能
放出的能量
反应热(即ΔH)
活化能
5、解释化学反应过程
活化能
在一定条件下,活化分子所占的百分数是固定不变的,活化分子的百分数越大,单位体积内 越多,单位时间内 的次数越多,化学反应速率就越快。
活化分子数
有效碰撞
6、活化能与反应速率的关系
活化能
7、运用有效碰撞理论解释外界条件对化学反应速率的影响
(1)运用有效碰撞理论解释浓度对化学反应速率的影响:
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
增大浓度
增加
增加
增加
加快
活化能
①规律:当其他条件不变时,增大反应物的浓度,反应速率加快;反之,反应速率减慢。
②理论解释:
(2)运用有效碰撞理论解释温度对化学反应速率的影响:
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
升高温度
不变
增加
增加
加快
活化能
本质原因:升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。
名师点拨
活化能
(3)运用有效碰撞理论解释催化剂对化学反应速率的影响:
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
使用催化剂
不变
增加
增加
加快
①规律:当其他条件不变时,使用适当的催化剂,较大程度地增大化学反应速率。
②理论解释:
活化能
(4)运用有效碰撞理论解释压强对化学反应速率的影响:
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
增大压强
不变
不变
增加
加快
①规律:当其他条件不变时,对于有气体参加的反应,增大压强(减少容器的容积)相当于增大反应浓度,反应速率加快;减小压强(增大容器的容积)相当于减小反应浓度,反应速率减慢。
②理论解释:
活化能
对于反应N2+3H2 2NH3,不同条件下,压强对化学反应速率的影响
(1)恒温恒容密闭容器
①充入N2,压强 ,c(N2) ,化学反应速率 。
②充入He(注He与反应无关),压强 ,但c(N2)、c(H2)、c(NH3)都 ,化学反应速率 。
(2)恒温恒压密闭容器
充入He,体积 ,c(N2)、c(H2)、c(NH3)都 ,化学反应速率 。
增大
增大
加快
增大
不变
不变
增大
减小
减小
活化能
③、恒温,体积不变(恒温恒容)条件下,充入反应气体
充入反应气
恒温恒容冲反应气
体积不变
浓度c变↑
反应速率v↑
反应物物质的量变大
普通分子
活化分子
④、恒温,体积不变(恒温恒容)条件下,充入惰性气体
充入惰气
恒温恒容冲入惰气
体积不变
浓度c不变
反应物物质的量不变
反应速率v不变
惰性气体
普通分子
活化分子
①增大反应
物的浓度
单位体积内分子总数
活化分子百分数
单位体积内活化分子总数
单位体积内有效碰撞次数增加
增多
不变
②增大压强
③升高温度
单位体积内分子总数
活化分子百分数
不变
增大
增加
④加催化剂
反应速率加快
注意:
①活化分子数变,反应速率不一定变;但活化分子百分数变,则反应速率一定变。
②对于可逆反应,升温、加压,加入催化剂既加快正反应速率又加快逆反应速率。
归纳小结
增大反应物的浓度:
单位体积内分子总数
活化分子百分数
单位体积内活化分子总数
单位体积内有效碰撞次数增加
增多
增大压强(压缩体积):
增加
不变
2.简单碰撞理论解释化学反应速率的影响因素
反应速率加快
活化分子百分数 =
×100%
活化分子数
反应物分子总数
单位体积内分子总数
活化分子百分数
单位体积内活化分子总数增加
单位体积内有效碰撞次数增加
不变
增大
加催化剂:
升高温度:
反应速率加快
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
影响化学反应速率的外因
①增大固体表面积;②金属与酸反应生成H2时,构成原电池;③光照、电磁波、超声波、放射性辐射、高速研磨等向反应体系输入能量,都有可能改变反应速率
各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)。
各种影响都有其局限性,要针对具体反应具体分析。
5、其它因素
