【考点精练】人教版化学九年级上册 5.1质量守恒定律 同步练习
文档属性
| 名称 | 【考点精练】人教版化学九年级上册 5.1质量守恒定律 同步练习 |  | |
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-26 11:25:21 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第五单元课题1 质量守恒定律
一、单项选择题(共12小题)
1.载人航天器中处理CO2的一种方法为2Li2O2+2CO2═2X+O2,X的化学式为( )
A.Li B.Li2O C.Li2CO3 D.LiOH
2.化学反应前后不一定发生改变的是( )
A.元素的种类 B.原子的质量
C.元素的化合价 D.原子的数目
3.在探究某物质的组成时,某实验小组的同学将该物质放在氧气中充分燃烧后,测得生成物有二氧化碳和水,你认为该物质的组成中( )
A.一定含有碳、氢、氧三种元素
B.一定含有碳、氢元素,可能含有氧元素
C.一定含有碳、氧元素,可能含有氢元素
D.无法确定
4.根据化学方程式能获得下列信息中的( )
①反应所需要的条件 ②化学反应的快慢 ③该反应中的反应物和生成物
④参加反应的各微粒的相对数量比 ⑤反应中各物质的质量比
A.①②③④⑤ B.①③④⑤ C.①②③ D.②③⑤
5.下列关于C+O2CO2的说法中,不合理的是( )
A.表示碳与氧气在点燃条件下反应生成二氧化碳
B.参加反应的氧气与生成的二氧化碳的分子个数比为1:1
C.参加反应的碳和氧气的质量比为1:1
D.反应前后碳元素和氧元素的质量均不变
6.下列对质量守恒定律的理解和应用中,正确的是( )
A.化学反应前后原子的种类、数目和质量不变,所以化学反应遵循质量守恒定律
B.10g冰加热融化变成10g水,遵循质量守恒定律
C.氢气燃烧时,参加反应的氢气和氧气的体积,一定等于生成水的体积
D.蜡烛燃烧后质量减少了,该反应不遵循质量守恒定律
7.下列变化中能用来验证质量守恒定律的实验是( )
A.碳酸钠与稀盐酸的反应
B.铁与硫酸铜溶液的反应
C.镁带燃烧
D.胆矾的研碎
8.为了防止燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),一旦燃气泄漏即可闻到气味。乙硫醇在充足的氧气中燃烧时会生成一种空气污染物,该气体可能为( )
A.CO B.CO2 C.SO2 D.NO2
9.在密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,在不同时刻测得各物质的质量(单位为g)如表所示。下列说法正确的是( )
甲 乙 丙 丁
t1 8 10 2 21
t2 4 a b 18
t3 0 10 c d
A.乙一定是该反应的催化剂
B.c=14
C.丙一定是化合物
D.t2时刻,参加反应的甲、丁质量之比为2:9
10.1.6g某可燃物在空气中燃烧,只产生4.4g二氧化碳和3.6g水,关于该可燃物的组成的推论正确的是( )
A.只含有C、O元素 B.只含有C、H元素
C.一定含有C、H、O元素 D.一定含有C、H元素,可能含有O元素
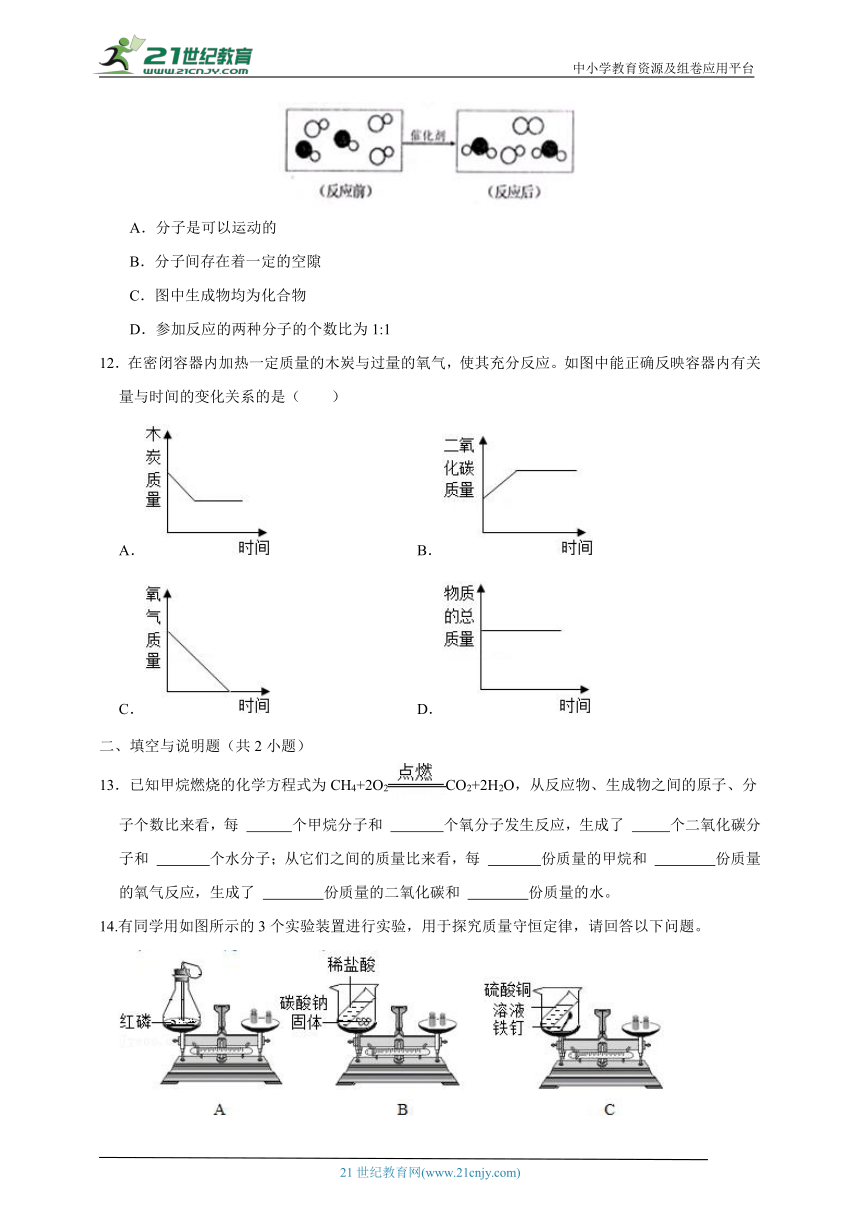
11.“尾气催化转化器”可以将汽车尾气中有毒气体转变为无毒气体,下面是其中一个化学反应的微观示意图,其中不同的圆球代表不同的原子。从图中获得信息不正确的是( )
A.分子是可以运动的
B.分子间存在着一定的空隙
C.图中生成物均为化合物
D.参加反应的两种分子的个数比为1:1
12.在密闭容器内加热一定质量的木炭与过量的氧气,使其充分反应。如图中能正确反映容器内有关量与时间的变化关系的是( )
A. B.
C. D.
二、填空与说明题(共2小题)
13.已知甲烷燃烧的化学方程式为CH4+2O2CO2+2H2O,从反应物、生成物之间的原子、分子个数比来看,每 个甲烷分子和 个氧分子发生反应,生成了 个二氧化碳分子和 个水分子;从它们之间的质量比来看,每 份质量的甲烷和 份质量的氧气反应,生成了 份质量的二氧化碳和 份质量的水。
14.有同学用如图所示的3个实验装置进行实验,用于探究质量守恒定律,请回答以下问题。
(1)A中气球的作用是 ,请写出A中发生的化学反应方程式: 。
(2)已知:碳酸钠与稀盐酸反应能生成CO2气体,上述3个实验中遵守质量守恒定律的有 (填序号,下同),能验证质量守恒定律的有 。
(3)由质量守恒定律可知,化学反应前后一定不变的是 。(填序号)
①物质种类②元素种类③分子种类④分子数目⑤原子种类⑥原子数目
参考答案
1.【答案】C
【解析】解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前锂、氧、碳原子个数分别为4、8、2,反应后的生成物中锂、氧、碳原子个数分别为0、2、0,根据反应前后原子种类、数目不变,则2X分子中含有4个锂原子、2个碳原子和6个氧原子,则每个X分子由2个锂原子、1个碳原子和3个氧原子构成,则物质X的化学式为Li2CO3。故选:C。
2.【答案】C
【解析】A、化学变化的实质是分子分成原子,原子再重新组合成新分子,原子的种类不变,则元素的种类不变,故选项错误。B、化学变化的实质是分子分成原子,原子再重新组合成新分子,原子的质量不变,故选项错误。C、化学反应前后元素的化合价可能会发生改变,也可能不变,如有单质参加或生成的反应,元素的化合价会发生改变,复分解反应中元素的化合价不变,故选项正确。D、化学变化的实质是分子分成原子,原子再重新组合成新分子,原子的数目不变,故选项错误。故选:C。
3.【答案】B
【解析】将物质放在氧气中充分燃烧后,测得生成物有二氧化碳和水,说明反应前物质的元素有碳、氢、氧,因氧气中含有氧元素,所以该物质中一定含有碳、氢元素,可能含有氧元素;故选:B。
4.【答案】B
【解析】化学方程式不仅表明了反应物、生成物和反应条件,还可以表示各物质之间的质量关系,即各物质之间的质量比,同时,能将反应中的反应物、生成物及各种粒子的相对数量关系清除的表示出来,所以①③④⑤说法正确,化学方程式不能体现化学反应的快慢,故②说法错误。故选:B。
5.【答案】C
【解析】化学方程式可表示:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等。但要注意读化学方程式时,“+”应读作“和”,“═”应读作“生成”。A、该化学方程式可表示碳与氧气在点燃条件下反应生成二氧化碳,故选项说法正确。B、从微观上,点燃条件下,每1个碳原子和1个氧分子反应生成1个二氧化碳分子,参加反应的氧气与生成的二氧化碳的分子个数比为1:1,故选项说法正确。C、参加反应的碳和氧气的质量比为12:32=3:8,故选项说法错误。D、化学反应遵守质量守恒定律,反应前后碳元素和氧元素的质量均不变,故选项说法正确。故选:C。
6.【答案】A
【解析】A、化学反应前后原子种类不变,数目没有增减,所以化学反应一定遵循质量守恒定律正确;故正确;B、质量守恒定律只适用于对化学变化现象的解释,而水变水蒸气是物理变化,不能用质量守恒定律来解释,故错误;C、质量守恒定律描述的是质量守恒,不是体积守恒,故错误;D、蜡烛燃烧后质量减少了,是因为生成的气体逸散到空气中,此反应仍遵循质量守恒定律,故错误。故选:A。
7.【答案】B
【解析】验证质量守恒定律的实验时,选用药品和装置应考虑:①只有质量没有变化的化学变化才能直接用于验证质量守恒;②如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置。A、碳酸钠与稀盐酸反应生成二氧化碳气体,反应后二氧化碳气体逸出,不能用于验证质量守恒定律,故选项错误。B、铁与硫酸铜溶液的反应生成硫酸亚铁溶液和铜,没有气体物质逸出,反应前后容器中物质的总质量不变,能用于验证质量守恒定律,故选项正确。C、镁条在空气中燃烧生成氧化镁,由于有空气中的气体参加反应,不能用于验证质量守恒定律,故选项错误。D、胆矾的研碎,只是形状发生改变,没有新物质生成,属于物理变化,不能用于验证质量守恒定律,故选项错误。故选:B。
8.【答案】C
【解析】A、乙硫醇在氧气中充分燃烧生成二氧化碳气体,不会生成一氧化碳,故选项错误。B、二氧化碳不属于空气的污染气体,故选项错误。C、乙硫醇(C2H5SH)在充足的氧气中燃烧时会生成一种空气污染物,乙硫醇、氧气中两种物质中含有碳、氢、硫、氧四种元素,根据质量守恒定律,反应前后,元素种类不变,则该气体可能为SO2,故选项正确。D、反应物中不含氮元素,不可能生成二氧化氮,故选项错误。故选:C。
9.【答案】C
【解析】由表中数据可知:t1~t3共反应了8g﹣0g=8g的甲,t1~t2共反应了8g﹣4g=4g的甲,说明t2时反应进行,其他反应物和生成物也是进行。丁在t1~t2反应了21g﹣18g=3g,则一共反应了6g,最终剩余21g﹣6g=15g,由质量守恒定律可知,8g+10g+2g+21g=0g+10g+cg+15g,得出c=16,那么丙共生成了16g﹣2g=14g,t2时生成了14g×=7g,则bg=2g+7g=9g,b=9,由于乙反应前后质量不变,乙可能是催化剂也可能是不参与反应的杂质,则a=10,得知:a=10,b=9,c=16,d=15。A、乙不一定是催化剂还有可能是不参与反应的杂质,该选项不正确。B、c=16,该选项不正确。C、该反应的表达式为甲+丁→丙,丙一定是化合物,该选项正确。D、t2时,参加反应的甲、乙质量比为(8g﹣4g):(21g﹣18g)=4:3,该选项不正确。故选:C。
10.【答案】B
【解析】4.4g二氧化碳中碳元素的质量为:4.4g××100%=1.2g;3.6g水中氢元素的质量为:3.6g××100%=0.4g;根据质量守恒定律可知,二氧化碳中的碳元素和水中的氢元素来自于该可燃物,该物质中氧元素的质量为:1.6g﹣1.2g﹣0.4g=0g;因此该物质一定含有碳、氢两种元素,不含氧元素;故选:B。
11.【答案】C
【解析】A.分子是可以运动的,通过运动相互接触而发生反应;B.由图可知分子间存在着一定的空隙;C.由同种分子构成的物质是纯净物,由原子直接构成物质时,一种原子构成一种物质,由不同元素组成的纯净物叫化合物。图中生成物为化合物和单质;D.由图中信息可知参加反应的两种分子的个数比为1:1。故选C。
12.【答案】D
【解析】A、根据题目信息可知,容器中的氧气是充分的,因此木炭会充分燃烧,固体质量逐渐减少,最终为零,错误;B、反应前容器内的气体为氧气,因此开始时二氧化碳的质量应为零,错误;C、氧气的质量是过量的,随着反应的进行,氧气质量逐渐减少,最终有部分氧气剩余,质量不为零,错误;D、化学反应遵循质量守恒定律,上述实验是在密闭容器中进行,因此化学反应前后物质的总质量不变,正确;故选:D。
13.【答案】1;2;1;2;16;64;44;36。
【解析】在CH4+2O2CO2+2H2O反应中,从反应物、生成物之间的原子、分子个数比来看,每1个甲烷分子和2个氧分子发生反应,生成了1个二氧化碳分子和2个水分子;从它们之间的质量比来看,每16份质量的甲烷和64份质量的氧气反应,生成了44份质量的二氧化碳和36份质量的水。
14.【答案】(1)缓冲气压,防止气体冲开橡皮塞;4P+5O22P2O5;(2)ABC;AC
(3)②⑤⑥
【解析】(1)红磷燃烧放出热量,使锥形瓶内的气体受热膨胀,A中气球的作用是缓冲气压,防止气体冲开橡皮塞,反应的方程式为4P+5O22P2O5;
(2)质量守恒定律适用于化学反应,因此ABC都遵循质量守恒定律,但是碳酸钠和稀盐酸反应生成的二氧化碳逸散,因此不能用于验证质量守恒定律;
(3)由质量守恒定律可知,化学反应前后一定不变的是②元素种类⑤原子种类⑥原子数目。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
第五单元课题1 质量守恒定律
一、单项选择题(共12小题)
1.载人航天器中处理CO2的一种方法为2Li2O2+2CO2═2X+O2,X的化学式为( )
A.Li B.Li2O C.Li2CO3 D.LiOH
2.化学反应前后不一定发生改变的是( )
A.元素的种类 B.原子的质量
C.元素的化合价 D.原子的数目
3.在探究某物质的组成时,某实验小组的同学将该物质放在氧气中充分燃烧后,测得生成物有二氧化碳和水,你认为该物质的组成中( )
A.一定含有碳、氢、氧三种元素
B.一定含有碳、氢元素,可能含有氧元素
C.一定含有碳、氧元素,可能含有氢元素
D.无法确定
4.根据化学方程式能获得下列信息中的( )
①反应所需要的条件 ②化学反应的快慢 ③该反应中的反应物和生成物
④参加反应的各微粒的相对数量比 ⑤反应中各物质的质量比
A.①②③④⑤ B.①③④⑤ C.①②③ D.②③⑤
5.下列关于C+O2CO2的说法中,不合理的是( )
A.表示碳与氧气在点燃条件下反应生成二氧化碳
B.参加反应的氧气与生成的二氧化碳的分子个数比为1:1
C.参加反应的碳和氧气的质量比为1:1
D.反应前后碳元素和氧元素的质量均不变
6.下列对质量守恒定律的理解和应用中,正确的是( )
A.化学反应前后原子的种类、数目和质量不变,所以化学反应遵循质量守恒定律
B.10g冰加热融化变成10g水,遵循质量守恒定律
C.氢气燃烧时,参加反应的氢气和氧气的体积,一定等于生成水的体积
D.蜡烛燃烧后质量减少了,该反应不遵循质量守恒定律
7.下列变化中能用来验证质量守恒定律的实验是( )
A.碳酸钠与稀盐酸的反应
B.铁与硫酸铜溶液的反应
C.镁带燃烧
D.胆矾的研碎
8.为了防止燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),一旦燃气泄漏即可闻到气味。乙硫醇在充足的氧气中燃烧时会生成一种空气污染物,该气体可能为( )
A.CO B.CO2 C.SO2 D.NO2
9.在密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,在不同时刻测得各物质的质量(单位为g)如表所示。下列说法正确的是( )
甲 乙 丙 丁
t1 8 10 2 21
t2 4 a b 18
t3 0 10 c d
A.乙一定是该反应的催化剂
B.c=14
C.丙一定是化合物
D.t2时刻,参加反应的甲、丁质量之比为2:9
10.1.6g某可燃物在空气中燃烧,只产生4.4g二氧化碳和3.6g水,关于该可燃物的组成的推论正确的是( )
A.只含有C、O元素 B.只含有C、H元素
C.一定含有C、H、O元素 D.一定含有C、H元素,可能含有O元素
11.“尾气催化转化器”可以将汽车尾气中有毒气体转变为无毒气体,下面是其中一个化学反应的微观示意图,其中不同的圆球代表不同的原子。从图中获得信息不正确的是( )
A.分子是可以运动的
B.分子间存在着一定的空隙
C.图中生成物均为化合物
D.参加反应的两种分子的个数比为1:1
12.在密闭容器内加热一定质量的木炭与过量的氧气,使其充分反应。如图中能正确反映容器内有关量与时间的变化关系的是( )
A. B.
C. D.
二、填空与说明题(共2小题)
13.已知甲烷燃烧的化学方程式为CH4+2O2CO2+2H2O,从反应物、生成物之间的原子、分子个数比来看,每 个甲烷分子和 个氧分子发生反应,生成了 个二氧化碳分子和 个水分子;从它们之间的质量比来看,每 份质量的甲烷和 份质量的氧气反应,生成了 份质量的二氧化碳和 份质量的水。
14.有同学用如图所示的3个实验装置进行实验,用于探究质量守恒定律,请回答以下问题。
(1)A中气球的作用是 ,请写出A中发生的化学反应方程式: 。
(2)已知:碳酸钠与稀盐酸反应能生成CO2气体,上述3个实验中遵守质量守恒定律的有 (填序号,下同),能验证质量守恒定律的有 。
(3)由质量守恒定律可知,化学反应前后一定不变的是 。(填序号)
①物质种类②元素种类③分子种类④分子数目⑤原子种类⑥原子数目
参考答案
1.【答案】C
【解析】解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前锂、氧、碳原子个数分别为4、8、2,反应后的生成物中锂、氧、碳原子个数分别为0、2、0,根据反应前后原子种类、数目不变,则2X分子中含有4个锂原子、2个碳原子和6个氧原子,则每个X分子由2个锂原子、1个碳原子和3个氧原子构成,则物质X的化学式为Li2CO3。故选:C。
2.【答案】C
【解析】A、化学变化的实质是分子分成原子,原子再重新组合成新分子,原子的种类不变,则元素的种类不变,故选项错误。B、化学变化的实质是分子分成原子,原子再重新组合成新分子,原子的质量不变,故选项错误。C、化学反应前后元素的化合价可能会发生改变,也可能不变,如有单质参加或生成的反应,元素的化合价会发生改变,复分解反应中元素的化合价不变,故选项正确。D、化学变化的实质是分子分成原子,原子再重新组合成新分子,原子的数目不变,故选项错误。故选:C。
3.【答案】B
【解析】将物质放在氧气中充分燃烧后,测得生成物有二氧化碳和水,说明反应前物质的元素有碳、氢、氧,因氧气中含有氧元素,所以该物质中一定含有碳、氢元素,可能含有氧元素;故选:B。
4.【答案】B
【解析】化学方程式不仅表明了反应物、生成物和反应条件,还可以表示各物质之间的质量关系,即各物质之间的质量比,同时,能将反应中的反应物、生成物及各种粒子的相对数量关系清除的表示出来,所以①③④⑤说法正确,化学方程式不能体现化学反应的快慢,故②说法错误。故选:B。
5.【答案】C
【解析】化学方程式可表示:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等。但要注意读化学方程式时,“+”应读作“和”,“═”应读作“生成”。A、该化学方程式可表示碳与氧气在点燃条件下反应生成二氧化碳,故选项说法正确。B、从微观上,点燃条件下,每1个碳原子和1个氧分子反应生成1个二氧化碳分子,参加反应的氧气与生成的二氧化碳的分子个数比为1:1,故选项说法正确。C、参加反应的碳和氧气的质量比为12:32=3:8,故选项说法错误。D、化学反应遵守质量守恒定律,反应前后碳元素和氧元素的质量均不变,故选项说法正确。故选:C。
6.【答案】A
【解析】A、化学反应前后原子种类不变,数目没有增减,所以化学反应一定遵循质量守恒定律正确;故正确;B、质量守恒定律只适用于对化学变化现象的解释,而水变水蒸气是物理变化,不能用质量守恒定律来解释,故错误;C、质量守恒定律描述的是质量守恒,不是体积守恒,故错误;D、蜡烛燃烧后质量减少了,是因为生成的气体逸散到空气中,此反应仍遵循质量守恒定律,故错误。故选:A。
7.【答案】B
【解析】验证质量守恒定律的实验时,选用药品和装置应考虑:①只有质量没有变化的化学变化才能直接用于验证质量守恒;②如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置。A、碳酸钠与稀盐酸反应生成二氧化碳气体,反应后二氧化碳气体逸出,不能用于验证质量守恒定律,故选项错误。B、铁与硫酸铜溶液的反应生成硫酸亚铁溶液和铜,没有气体物质逸出,反应前后容器中物质的总质量不变,能用于验证质量守恒定律,故选项正确。C、镁条在空气中燃烧生成氧化镁,由于有空气中的气体参加反应,不能用于验证质量守恒定律,故选项错误。D、胆矾的研碎,只是形状发生改变,没有新物质生成,属于物理变化,不能用于验证质量守恒定律,故选项错误。故选:B。
8.【答案】C
【解析】A、乙硫醇在氧气中充分燃烧生成二氧化碳气体,不会生成一氧化碳,故选项错误。B、二氧化碳不属于空气的污染气体,故选项错误。C、乙硫醇(C2H5SH)在充足的氧气中燃烧时会生成一种空气污染物,乙硫醇、氧气中两种物质中含有碳、氢、硫、氧四种元素,根据质量守恒定律,反应前后,元素种类不变,则该气体可能为SO2,故选项正确。D、反应物中不含氮元素,不可能生成二氧化氮,故选项错误。故选:C。
9.【答案】C
【解析】由表中数据可知:t1~t3共反应了8g﹣0g=8g的甲,t1~t2共反应了8g﹣4g=4g的甲,说明t2时反应进行,其他反应物和生成物也是进行。丁在t1~t2反应了21g﹣18g=3g,则一共反应了6g,最终剩余21g﹣6g=15g,由质量守恒定律可知,8g+10g+2g+21g=0g+10g+cg+15g,得出c=16,那么丙共生成了16g﹣2g=14g,t2时生成了14g×=7g,则bg=2g+7g=9g,b=9,由于乙反应前后质量不变,乙可能是催化剂也可能是不参与反应的杂质,则a=10,得知:a=10,b=9,c=16,d=15。A、乙不一定是催化剂还有可能是不参与反应的杂质,该选项不正确。B、c=16,该选项不正确。C、该反应的表达式为甲+丁→丙,丙一定是化合物,该选项正确。D、t2时,参加反应的甲、乙质量比为(8g﹣4g):(21g﹣18g)=4:3,该选项不正确。故选:C。
10.【答案】B
【解析】4.4g二氧化碳中碳元素的质量为:4.4g××100%=1.2g;3.6g水中氢元素的质量为:3.6g××100%=0.4g;根据质量守恒定律可知,二氧化碳中的碳元素和水中的氢元素来自于该可燃物,该物质中氧元素的质量为:1.6g﹣1.2g﹣0.4g=0g;因此该物质一定含有碳、氢两种元素,不含氧元素;故选:B。
11.【答案】C
【解析】A.分子是可以运动的,通过运动相互接触而发生反应;B.由图可知分子间存在着一定的空隙;C.由同种分子构成的物质是纯净物,由原子直接构成物质时,一种原子构成一种物质,由不同元素组成的纯净物叫化合物。图中生成物为化合物和单质;D.由图中信息可知参加反应的两种分子的个数比为1:1。故选C。
12.【答案】D
【解析】A、根据题目信息可知,容器中的氧气是充分的,因此木炭会充分燃烧,固体质量逐渐减少,最终为零,错误;B、反应前容器内的气体为氧气,因此开始时二氧化碳的质量应为零,错误;C、氧气的质量是过量的,随着反应的进行,氧气质量逐渐减少,最终有部分氧气剩余,质量不为零,错误;D、化学反应遵循质量守恒定律,上述实验是在密闭容器中进行,因此化学反应前后物质的总质量不变,正确;故选:D。
13.【答案】1;2;1;2;16;64;44;36。
【解析】在CH4+2O2CO2+2H2O反应中,从反应物、生成物之间的原子、分子个数比来看,每1个甲烷分子和2个氧分子发生反应,生成了1个二氧化碳分子和2个水分子;从它们之间的质量比来看,每16份质量的甲烷和64份质量的氧气反应,生成了44份质量的二氧化碳和36份质量的水。
14.【答案】(1)缓冲气压,防止气体冲开橡皮塞;4P+5O22P2O5;(2)ABC;AC
(3)②⑤⑥
【解析】(1)红磷燃烧放出热量,使锥形瓶内的气体受热膨胀,A中气球的作用是缓冲气压,防止气体冲开橡皮塞,反应的方程式为4P+5O22P2O5;
(2)质量守恒定律适用于化学反应,因此ABC都遵循质量守恒定律,但是碳酸钠和稀盐酸反应生成的二氧化碳逸散,因此不能用于验证质量守恒定律;
(3)由质量守恒定律可知,化学反应前后一定不变的是②元素种类⑤原子种类⑥原子数目。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
