第二章第一节第一课时 活泼的金属单质—钠课件2022-2023学年上学期高一化学人教版(2019)必修第一册(21张ppt)
文档属性
| 名称 | 第二章第一节第一课时 活泼的金属单质—钠课件2022-2023学年上学期高一化学人教版(2019)必修第一册(21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-26 17:32:00 | ||
图片预览








文档简介
(共21张PPT)
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第一课时 活泼的金属单质—钠
地球表面总面积约5.1亿平方千米,其中陆地面积1.49亿平方千米,海洋面积3.61亿平方千米,海洋占大部分。海洋占地球表面积的71%,陆地占地球表面积的29%.
一、活泼的金属单质—钠
1. 钠的原子结构
钠原子的结构示意图为 ,在化学反应中很容易 1个电子。因此,钠的化学性质非常活泼,表现出很强的 性。
失去
还原
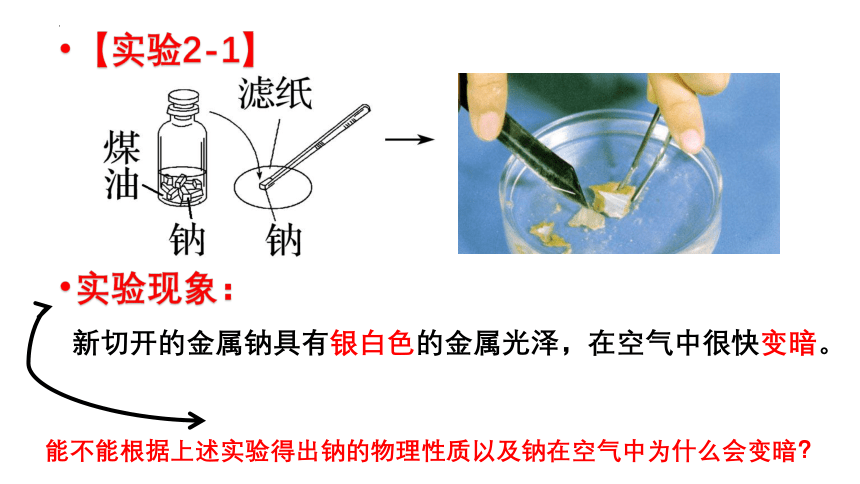
【实验2-1】
实验现象:
新切开的金属钠具有银白色的金属光泽,在空气中很快变暗。
能不能根据上述实验得出钠的物理性质以及钠在空气中为什么会变暗?
2. 钠的物理性质
颜色:
状态:
硬度:
密度:
熔点:
银白色,具有金属光泽
固体
硬度小,质软,可用小刀切割
小于水,大于煤油
熔点低
注意:剩余的钠要放入原试剂瓶中,不能乱扔。
3. 钠的化学性质
白色固体
新切开的钠与空气中的氧气反应,在钠的表面生成了一薄层氧化物,这种氧化物是氧化钠(Na2O)。
为什么新切开的钠在空气中会变暗?
【思考】钠该如何保存?为什么?
保存方法:
在实验室中,要把钠保存在煤油或石蜡油中以隔绝空气。
因为钠在常温下能与氧气反应。
钠与空气在常温下反应生成氧化钠,如果加热,钠和氧气是否还是生成氧化钠?
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大小的钠,迅速投到热坩埚中,继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
实验现象:
钠除了能与O2反应外,还能与Cl2等非金属单质直接化合。
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体
过氧化钠(Na2O2)
(2)钠和氧气加热下反应
金属钠与氧气反应,生成物是氧化钠还是过氧化钠,取决于什么?
4Na + O2 === 2Na2O
钠与 O2 反应时,条件不同(是否加热/点燃),现象不同,产物也不同,跟氧气的量、纯度等无关。
练习 下列关于钠的叙述中,不正确的是( )
A、钠燃烧时生成氧化钠
B、钠燃烧时发出黄色的火焰
C、钠有很强的还原性
D、钠原子的最外层上只有1个电子
A
钠在空气中燃烧,剧烈反应,那么思考一个问题:
实验室遇到钠着火怎么灭火,能用水吗?
进行【探究实验】 (3)钠与水的反应
课本第21页
实验现象
分析及结论
钠浮在水面上
钠的密度比水小
熔成光亮的小球
且钠的熔点低且反应放热
四处游动
有气体生成,推动小球迅速游动
发出嘶嘶声响,钠球逐渐变小,最后完全消失。
反应剧烈
溶液由无色变成红色
生成碱性物质
简记:“浮溶游响红”
根据探究实验,完成下列表格
【结论】钠与水反应的生成物是 。与你的猜测是否一致?
钠与水反应的化学方程式:
离子方程式:
NaOH、H2
这就是实验室不能用水灭钠着火的原因,应该用干燥的沙土灭火。
2Na + 2H2O = 2NaOH + H2↑
练习:向一小烧杯中加入等体积的水和煤油,片刻后再向该烧杯中轻缓的加入一绿豆大小的金属钠,可能观察到的现象是( )
A
(4)钠与酸溶液反应
(1)与强酸反应的离子方程式:_________________________________。
(2)钠与酸反应时,先与酸反应,如果钠过量,钠把酸反应完之后,再与水反应。
先与酸反应:2Na+2HCl=2NaCl+H2↑
再与水反应:2Na+2H2O==2NaOH+H2↑
2Na + 2H+ === 2Na+ + H2↑
(5)钠与碱溶液反应
钠与碱溶液的反应,实质就是钠与水的反应。
2Na+2H2O==2NaOH+H2↑
(6)钠与盐溶液反应
钠与盐溶液反应时,钠首先与水反应生成NaOH和H2,然后生成的NaOH和盐发生复分解反应(若NaOH不与该盐反应,则只有钠与水的反应)。
如Na与K2SO4溶液反应:
生成的NaOH与K2SO4不发生复分解反应,只发生Na与H2O的反应。
所以,Na与K2SO4溶液反应的方程式为:
又如Na与FeCl3溶液反应,
生成的NaOH与FeCl3能发生复分解反应:
所以,Na与FeCl3溶液反应的化学方程式为:
①
②
2Na + 2H2O = 2NaOH + H2↑
3NaOH+FeCl3 = Fe(OH)3↓+3NaCl
练习: 将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )
注意对比分析钠与水反应和钠与酸、碱、盐溶液反应现象的相似和差异。
A.盐酸
B.饱和氢氧化钠溶液
C.FeCl3溶液
D.CuSO4溶液
A
4.钠的用途
(1)作还原剂来制取活泼金属;
(2)制作高压钠灯;
(3)制钠钾合金,用于原子反应堆导热剂。
钠在高温下能将TiCl4中的Ti置换出来
TiCl4 + 4Na 4NaCl + Ti
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第一课时 活泼的金属单质—钠
地球表面总面积约5.1亿平方千米,其中陆地面积1.49亿平方千米,海洋面积3.61亿平方千米,海洋占大部分。海洋占地球表面积的71%,陆地占地球表面积的29%.
一、活泼的金属单质—钠
1. 钠的原子结构
钠原子的结构示意图为 ,在化学反应中很容易 1个电子。因此,钠的化学性质非常活泼,表现出很强的 性。
失去
还原
【实验2-1】
实验现象:
新切开的金属钠具有银白色的金属光泽,在空气中很快变暗。
能不能根据上述实验得出钠的物理性质以及钠在空气中为什么会变暗?
2. 钠的物理性质
颜色:
状态:
硬度:
密度:
熔点:
银白色,具有金属光泽
固体
硬度小,质软,可用小刀切割
小于水,大于煤油
熔点低
注意:剩余的钠要放入原试剂瓶中,不能乱扔。
3. 钠的化学性质
白色固体
新切开的钠与空气中的氧气反应,在钠的表面生成了一薄层氧化物,这种氧化物是氧化钠(Na2O)。
为什么新切开的钠在空气中会变暗?
【思考】钠该如何保存?为什么?
保存方法:
在实验室中,要把钠保存在煤油或石蜡油中以隔绝空气。
因为钠在常温下能与氧气反应。
钠与空气在常温下反应生成氧化钠,如果加热,钠和氧气是否还是生成氧化钠?
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大小的钠,迅速投到热坩埚中,继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
实验现象:
钠除了能与O2反应外,还能与Cl2等非金属单质直接化合。
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体
过氧化钠(Na2O2)
(2)钠和氧气加热下反应
金属钠与氧气反应,生成物是氧化钠还是过氧化钠,取决于什么?
4Na + O2 === 2Na2O
钠与 O2 反应时,条件不同(是否加热/点燃),现象不同,产物也不同,跟氧气的量、纯度等无关。
练习 下列关于钠的叙述中,不正确的是( )
A、钠燃烧时生成氧化钠
B、钠燃烧时发出黄色的火焰
C、钠有很强的还原性
D、钠原子的最外层上只有1个电子
A
钠在空气中燃烧,剧烈反应,那么思考一个问题:
实验室遇到钠着火怎么灭火,能用水吗?
进行【探究实验】 (3)钠与水的反应
课本第21页
实验现象
分析及结论
钠浮在水面上
钠的密度比水小
熔成光亮的小球
且钠的熔点低且反应放热
四处游动
有气体生成,推动小球迅速游动
发出嘶嘶声响,钠球逐渐变小,最后完全消失。
反应剧烈
溶液由无色变成红色
生成碱性物质
简记:“浮溶游响红”
根据探究实验,完成下列表格
【结论】钠与水反应的生成物是 。与你的猜测是否一致?
钠与水反应的化学方程式:
离子方程式:
NaOH、H2
这就是实验室不能用水灭钠着火的原因,应该用干燥的沙土灭火。
2Na + 2H2O = 2NaOH + H2↑
练习:向一小烧杯中加入等体积的水和煤油,片刻后再向该烧杯中轻缓的加入一绿豆大小的金属钠,可能观察到的现象是( )
A
(4)钠与酸溶液反应
(1)与强酸反应的离子方程式:_________________________________。
(2)钠与酸反应时,先与酸反应,如果钠过量,钠把酸反应完之后,再与水反应。
先与酸反应:2Na+2HCl=2NaCl+H2↑
再与水反应:2Na+2H2O==2NaOH+H2↑
2Na + 2H+ === 2Na+ + H2↑
(5)钠与碱溶液反应
钠与碱溶液的反应,实质就是钠与水的反应。
2Na+2H2O==2NaOH+H2↑
(6)钠与盐溶液反应
钠与盐溶液反应时,钠首先与水反应生成NaOH和H2,然后生成的NaOH和盐发生复分解反应(若NaOH不与该盐反应,则只有钠与水的反应)。
如Na与K2SO4溶液反应:
生成的NaOH与K2SO4不发生复分解反应,只发生Na与H2O的反应。
所以,Na与K2SO4溶液反应的方程式为:
又如Na与FeCl3溶液反应,
生成的NaOH与FeCl3能发生复分解反应:
所以,Na与FeCl3溶液反应的化学方程式为:
①
②
2Na + 2H2O = 2NaOH + H2↑
3NaOH+FeCl3 = Fe(OH)3↓+3NaCl
练习: 将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )
注意对比分析钠与水反应和钠与酸、碱、盐溶液反应现象的相似和差异。
A.盐酸
B.饱和氢氧化钠溶液
C.FeCl3溶液
D.CuSO4溶液
A
4.钠的用途
(1)作还原剂来制取活泼金属;
(2)制作高压钠灯;
(3)制钠钾合金,用于原子反应堆导热剂。
钠在高温下能将TiCl4中的Ti置换出来
TiCl4 + 4Na 4NaCl + Ti
