2022—2023学年化学人教九年级上册第2单元 我们周围的空气 分层选练题(含答案)
文档属性
| 名称 | 2022—2023学年化学人教九年级上册第2单元 我们周围的空气 分层选练题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 809.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-26 10:32:44 | ||
图片预览



文档简介
2022—2023学年化学人教九年级上册第2单元 我们周围的空气 分层选练题含答案
*人教九年级上册第2单元 我们周围的空气*
一、选择题。
1、如图为空气成分示意图(按体积分数计算),其中“X”代表的是( )
A.氧气 B.二氧化碳 C.氮气 D.稀有气体
2、空气中含量较多且能用于食品包装的气体是( )
A.氮气 B.氧气 C.稀有气体 D.二氧化碳
3、有关空气中各成分的相关说法不正确的是( )。
A. 空气中N2的体积分数为78%
B. O2的化学性质比较活泼,具有可燃性
C. CO2是绿色植物进行光合作用的原料之一
D. 稀有气体化学性质稳定,可用作保护气
4、下列变化过程中,无氧气产生的是( )
A.在过氧化氢溶液中加二氧化锰 B.植物的光合作用
C.加热氯酸钾和二氧化锰的混合物 D.石蜡燃烧
5、下列关于氧气的叙述错误的是( )
A.通常情况下,空气是无色无味的气体,空气中的氧气也是无色无味的气体
B.液态氧是淡蓝色的,固态氧是蓝色的
C.氧气在通常状况下,不易溶于水,密度比空气略大
D.在高山上出现高山反应是因为高山上没有氧气
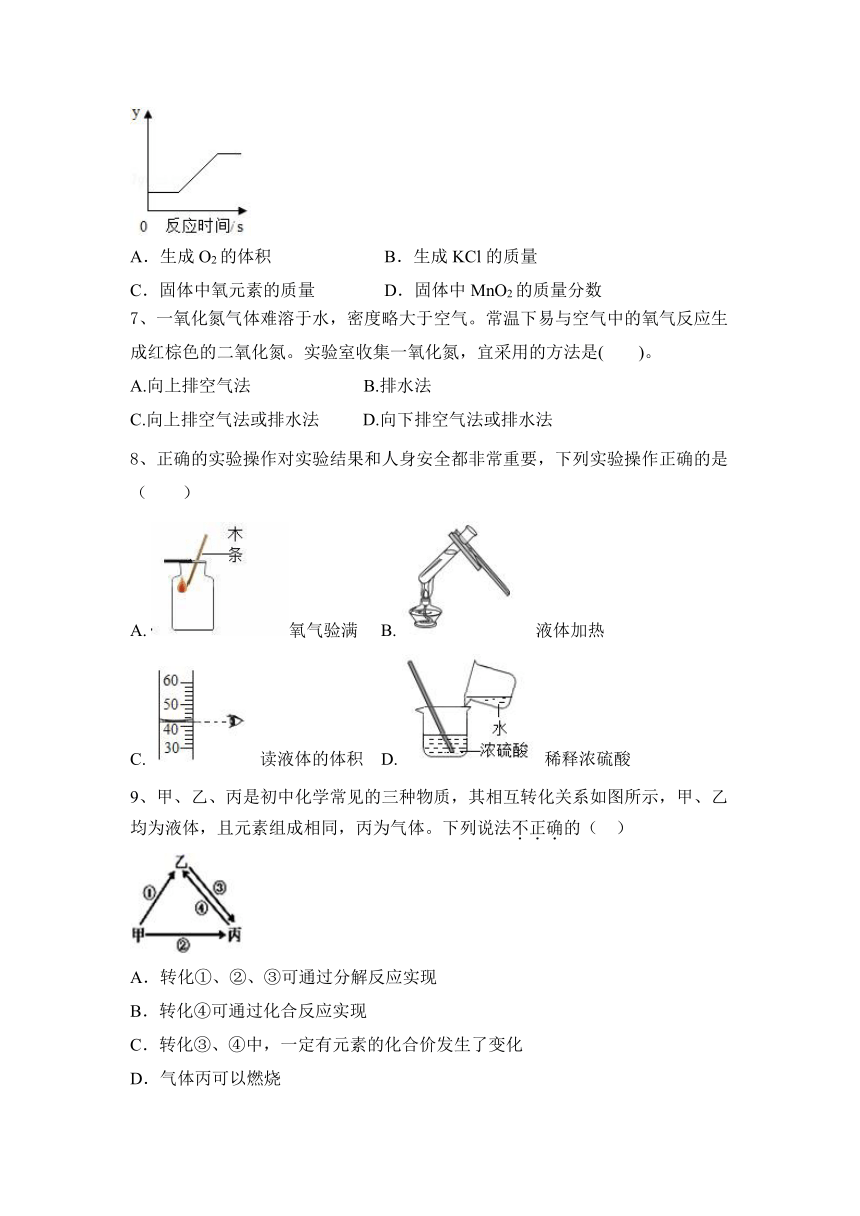
6、实验室用氯酸钾制备氧气,发生的反应为:氯酸钾 氯化钾+氧气。现取一定量的氯酸钾和二氧化锰进行加热,某变量y随时间的变化趋势如图所示。则y表示的是( )
A.生成O2的体积 B.生成KCl的质量
C.固体中氧元素的质量 D.固体中MnO2的质量分数
7、一氧化氮气体难溶于水,密度略大于空气。常温下易与空气中的氧气反应生成红棕色的二氧化氮。实验室收集一氧化氮,宜采用的方法是( )。
A.向上排空气法 B.排水法
C.向上排空气法或排水法 D.向下排空气法或排水法
8、正确的实验操作对实验结果和人身安全都非常重要,下列实验操作正确的是( )
A. 氧气验满 B. 液体加热
C. 读液体的体积 D. 稀释浓硫酸
9、甲、乙、丙是初中化学常见的三种物质,其相互转化关系如图所示,甲、乙均为液体,且元素组成相同,丙为气体。下列说法不正确的( )
A.转化①、②、③可通过分解反应实现
B.转化④可通过化合反应实现
C.转化③、④中,一定有元素的化合价发生了变化
D.气体丙可以燃烧
10、将过氧化氢溶液与二氧化锰混合可得到一种气体,关于这种气体性质的叙述正确的是( )
A.它是人类生存不可缺少的物质
B.它是具有轻微刺激性气味的气体
C.它可以燃烧
D.它易溶于水
11、如图为空气成分示意图(按体积分数计算),其中“a”代表的是 ( )
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
*12、下列关于空气的说法中正确的是 ( )
A.空气中氮气的质量分数为78%
B.通常情况下,空气中氧气体积与总体积之比约为1∶5
C.空气中二氧化碳的体积只占约0.04%,因此它的作用很小
D.空气中含量最少的是稀有气体
13、在实验室中,区别氧气和空气可以使用的方法是 ( )
A.闻气味
B.将空气和氧气分别液化
C.将空气和氧气分别溶于水
D.将带火星的木条分别伸入盛有空气和氧气的集气瓶中
14、实验室用100g溶质质量分数20%的双氧水与一定质量的二氧化锰混合制取氧气,为使反应慢点进行而又不影响生成氧气的质量,则下列操作不能达到目的是( )
A. 逐滴加入双氧水 B. 加水稀
C. 减少双氧水的用量 D. 降低温度
15、实验室用加热高锰酸钾制氧气,并用排水法收集的主要操作步骤如下:①点燃酒精灯,先使试管均匀受热,然后对准药品部位加热;
②将药品装入试管,用带导管的单孔橡皮塞塞紧试管;
③收集完毕,将导管从水槽中取出;
④检查装置的气密性;
⑤用排水法收集氧气;
⑥将试管固定在铁架台上;
⑦熄灭酒精灯。其中正确的操作顺序是( )
A.④②⑥①⑤③⑦ B.②④⑥①⑤③⑦
C.④②⑥①⑤⑦③ D.②④⑥①⑤⑦③
二、填空题。
16、空气是由多种气体组成的混合物,是一种宝贵的自然资源。
( 1 )空气中稀有气体的体积分数大约为 ______ 。
( 2 )鱼虾能在水中生存是因为氧气易溶于水,这种说法 ______ (填 “正确”或“不正确”)。
( 3 )因为氮气具有 ______ 的性质,所以充入食品包装袋内用于防腐。
( 4 )菜农定期会向蔬菜大棚中补充二氧化碳,这样做有利于植物进行 ______ 作用。
17、现有①木炭②硫磺③红磷④细铁丝四种物质分别在氧气中燃烧,用序号回答问题:
(1)发出明亮蓝紫色火焰的是________
(2)产生大量白烟的是________
(3)产生的气体能使澄清石灰水变浑浊的是________
(4)剧烈燃烧,火星四射的是________.
18、将一种无色无味的液体A装入试管,用带火星的木条伸入试管,无现象,而向其中加入少量黑色粉末B后,迅速产生气泡,生成了使带火星的木条复燃的气体C,使金属E红热并伸入盛有气体C且瓶底有少量液体D的集气瓶中,金属E剧烈燃烧,火星四射,生成黑色固体F。
(1)写出它们的名称:
A. B. C. D. E. F. 。
(2)黑色粉末B在A的分解反应中起 作用,是这个反应的 。
19、某市九年级学生进行了化学实验操作考试,考到了“木炭在氧气中燃烧”这一实验,如图1所示,请回答:
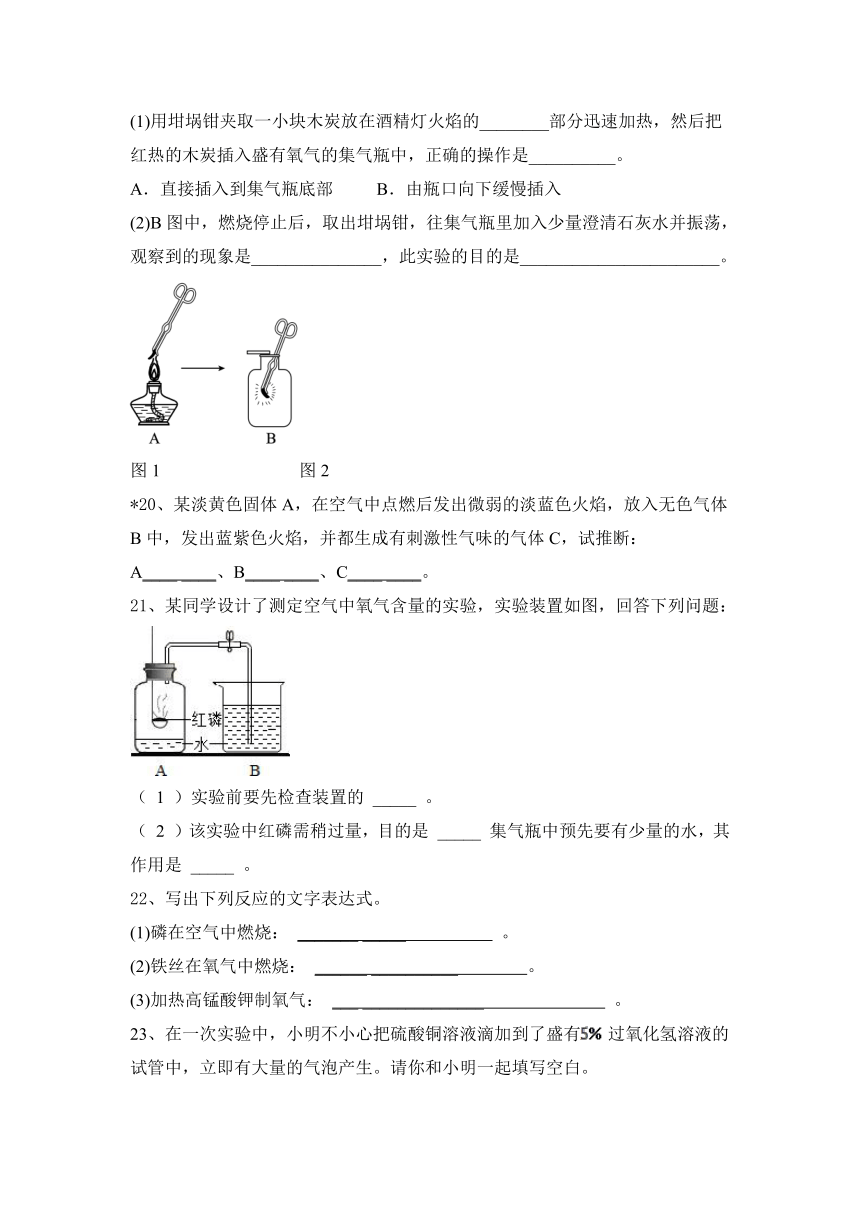
(1)用坩埚钳夹取一小块木炭放在酒精灯火焰的________部分迅速加热,然后把红热的木炭插入盛有氧气的集气瓶中,正确的操作是__________。
A.直接插入到集气瓶底部 B.由瓶口向下缓慢插入
(2)B图中,燃烧停止后,取出坩埚钳,往集气瓶里加入少量澄清石灰水并振荡,观察到的现象是_______________,此实验的目的是_______________________。
图1 图2
*20、某淡黄色固体A,在空气中点燃后发出微弱的淡蓝色火焰,放入无色气体B中,发出蓝紫色火焰,并都生成有刺激性气味的气体C,试推断:
A____ ____、B____ ____、C____ ____。
21、某同学设计了测定空气中氧气含量的实验,实验装置如图,回答下列问题:
( 1 )实验前要先检查装置的 _____ 。
( 2 )该实验中红磷需稍过量,目的是 _____ 集气瓶中预先要有少量的水,其作用是 _____ 。
22、写出下列反应的文字表达式。
(1)磷在空气中燃烧: _______ _____ 。
(2)铁丝在氧气中燃烧: ______ __________ 。
(3)加热高锰酸钾制氧气: ___ ______________ 。
23、在一次实验中,小明不小心把硫酸铜溶液滴加到了盛有过氧化氢溶液的试管中,立即有大量的气泡产生。请你和小明一起填写空白。
(1)检验试管中产生的气体为氧气的方法是_____________;
(2)小明根据实验现象推测硫酸铜溶液可能是此反应的________________;写出该反应的符号表达式________。
(3)小明如果要进一步确定他的猜想,还须设计实验并通过实验确认它在化学反应前后_____和_______都没有发生变化。
三、实验题。
24、同学们在学习完氧气的性质后,知道了“氧气能使带火星的木条复燃”,在此基础上,同学们提出了以下问题,并逐一进行了探究。
(1)【问题一】带火星的木条复燃能否证明氧气是纯氧?
【进行实验】同学们用数字化实验探测仪进行实验(如图),并获得了一系列数据。
集气瓶编号 ① ② ③ ④ ⑤
氧气浓度(体积分数) 25% 35% 45% … 65%
带火星木条情况 微亮 亮 很亮 复燃 复燃
【收集证据】④号集气瓶内的氧气浓度可能是 。
【实验结论】 。
【反思与评价】分析以上数据可知欲收集瓶较为纯净的氧气最好的收集方法是 。
(2)【问题二】铁丝在氧气中的燃烧与氧气浓度和铁丝粗细有关系吗?
实验编号 ① ② ③ ④ ⑤
氧气浓度(体积分数) 34% 47% 60% 73% 86%
直径0.2mm的细铁丝 不燃烧 稍有燃烧 剧烈燃烧 剧烈燃烧 剧烈燃烧
直径0.5mm的粗铁丝 不燃烧 不燃烧 不燃烧 稍有燃烧 剧烈燃烧
【收集证据】⑤号实验中细铁丝燃烧的完整实验现象是 。
【实验解释】有关反应的文字表达式是 ,实验操作中,在集气瓶底部放少量水的目的是 。
【实验结论】Ⅰ.氧气浓度越大,铁丝燃烧越 。
Ⅱ 。
【表达与交流】在完成铁丝燃烧的实验时,为保证实验成功需注意的一项实验操作是 。
25、在老师的指导下,小华和小明利用如图 1 所示装置对氯酸钾制氧气进行了深入的探究学习。
资料:
①氯酸钾的熔点约为 356℃,二氧化锰的分解温度约为 535℃.用酒精灯给物质加热,受热物质的温度一般约为 400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图 2)及不同配比时氧气浓度随温度的变化示意图(图 3)如下:
请回答问题:
(1)二氧化锰在 535℃以上分解生成四氧化三锰和氧气,其文字表达式为:
。
3MnO2
Mn3O4+O2↑(2)分析图 2,氧气的浓度随温度升高逐渐减小,在 380℃突然增大的原因是
温度升高,气体膨胀,氧气的浓度变小氯酸钾分解温度高于 (填“高于”、“等于”或“低于”)其熔点。
(3)分析图 3,氯酸钾分解温度随物质配比变化的规律是质量比越小,分解温度越低或质量比越大,分解温度越高 。
步骤 实验操作 实验现象
I 检查气密性
II 分别在“Y”形管两侧支管中加入少量的二氧化锰和氯酸钾塞紧橡皮塞
III 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导气管口。 加热左侧支管,可观察到带火星的木条不复燃,加热右侧支管,可观察到氯酸钾融化为液态,带火星木条复燃。
IV 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 加热时间短于步骤 III,木条很快复燃。
(4)为证实二氧化锰的催化作用,小华利用如图 4 装置进行如表所示的实验:请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到 带火星的木条不复燃,加热左侧试管的目的是证明在酒精灯加热的条件下二氧化锰不分解 。加热右侧支管,可观察到氯酸钾融化为液态,带火星木条复燃 。
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是将Y形管向右倾斜 。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的质量 和
化学性质 不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的文字表达式为2KClO3 2KCl+3O2↑。
2022—2023学年化学人教九年级上册第2单元 我们周围的空气 分层选练题含答案
*人教九年级上册第2单元 我们周围的空气*
一、选择题。
1、如图为空气成分示意图(按体积分数计算),其中“X”代表的是( )
A.氧气 B.二氧化碳 C.氮气 D.稀有气体
【答案】C
2、空气中含量较多且能用于食品包装的气体是( )
A.氮气 B.氧气 C.稀有气体 D.二氧化碳
【答案】A
3、有关空气中各成分的相关说法不正确的是( )。
A. 空气中N2的体积分数为78%
B. O2的化学性质比较活泼,具有可燃性
C. CO2是绿色植物进行光合作用的原料之一
D. 稀有气体化学性质稳定,可用作保护气
【答案】C
4、下列变化过程中,无氧气产生的是( )
A.在过氧化氢溶液中加二氧化锰 B.植物的光合作用
C.加热氯酸钾和二氧化锰的混合物 D.石蜡燃烧
【答案】D
5、下列关于氧气的叙述错误的是( )
A.通常情况下,空气是无色无味的气体,空气中的氧气也是无色无味的气体
B.液态氧是淡蓝色的,固态氧是蓝色的
C.氧气在通常状况下,不易溶于水,密度比空气略大
D.在高山上出现高山反应是因为高山上没有氧气
【答案】D
6、实验室用氯酸钾制备氧气,发生的反应为:氯酸钾 氯化钾+氧气。现取一定量的氯酸钾和二氧化锰进行加热,某变量y随时间的变化趋势如图所示。则y表示的是( )
A.生成O2的体积 B.生成KCl的质量
C.固体中氧元素的质量 D.固体中MnO2的质量分数
【答案】D
7、一氧化氮气体难溶于水,密度略大于空气。常温下易与空气中的氧气反应生成红棕色的二氧化氮。实验室收集一氧化氮,宜采用的方法是( )。
A.向上排空气法 B.排水法
C.向上排空气法或排水法 D.向下排空气法或排水法
【答案】B
8、正确的实验操作对实验结果和人身安全都非常重要,下列实验操作正确的是( )
A. 氧气验满 B. 液体加热
C. 读液体的体积 D. 稀释浓硫酸
【答案】C
9、甲、乙、丙是初中化学常见的三种物质,其相互转化关系如图所示,甲、乙均为液体,且元素组成相同,丙为气体。下列说法不正确的( )
A.转化①、②、③可通过分解反应实现
B.转化④可通过化合反应实现
C.转化③、④中,一定有元素的化合价发生了变化
D.气体丙可以燃烧
【答案】D
10、将过氧化氢溶液与二氧化锰混合可得到一种气体,关于这种气体性质的叙述正确的是( )
A.它是人类生存不可缺少的物质
B.它是具有轻微刺激性气味的气体
C.它可以燃烧
D.它易溶于水
【答案】A
11、如图为空气成分示意图(按体积分数计算),其中“a”代表的是 ( )
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
【答案】B
*12、下列关于空气的说法中正确的是 ( )
A.空气中氮气的质量分数为78%
B.通常情况下,空气中氧气体积与总体积之比约为1∶5
C.空气中二氧化碳的体积只占约0.04%,因此它的作用很小
D.空气中含量最少的是稀有气体
【答案】B
13、在实验室中,区别氧气和空气可以使用的方法是 ( )
A.闻气味
B.将空气和氧气分别液化
C.将空气和氧气分别溶于水
D.将带火星的木条分别伸入盛有空气和氧气的集气瓶中
【答案】D
14、实验室用100g溶质质量分数20%的双氧水与一定质量的二氧化锰混合制取氧气,为使反应慢点进行而又不影响生成氧气的质量,则下列操作不能达到目的是( )
A. 逐滴加入双氧水 B. 加水稀
C. 减少双氧水的用量 D. 降低温度
【答案】C
15、实验室用加热高锰酸钾制氧气,并用排水法收集的主要操作步骤如下:①点燃酒精灯,先使试管均匀受热,然后对准药品部位加热;
②将药品装入试管,用带导管的单孔橡皮塞塞紧试管;
③收集完毕,将导管从水槽中取出;
④检查装置的气密性;
⑤用排水法收集氧气;
⑥将试管固定在铁架台上;
⑦熄灭酒精灯。其中正确的操作顺序是( )
A.④②⑥①⑤③⑦ B.②④⑥①⑤③⑦
C.④②⑥①⑤⑦③ D.②④⑥①⑤⑦③
【答案】A
二、填空题。
16、空气是由多种气体组成的混合物,是一种宝贵的自然资源。
( 1 )空气中稀有气体的体积分数大约为 ______ 。
( 2 )鱼虾能在水中生存是因为氧气易溶于水,这种说法 ______ (填 “正确”或“不正确”)。
( 3 )因为氮气具有 ______ 的性质,所以充入食品包装袋内用于防腐。
( 4 )菜农定期会向蔬菜大棚中补充二氧化碳,这样做有利于植物进行 ______ 作用。
【答案】0.94% 不正确 稳定 光合
17、现有①木炭②硫磺③红磷④细铁丝四种物质分别在氧气中燃烧,用序号回答问题:
(1)发出明亮蓝紫色火焰的是________
(2)产生大量白烟的是________
(3)产生的气体能使澄清石灰水变浑浊的是________
(4)剧烈燃烧,火星四射的是________.
【答案】 (1). ②; (2). ③; (3). ①; (4). ④.
18、将一种无色无味的液体A装入试管,用带火星的木条伸入试管,无现象,而向其中加入少量黑色粉末B后,迅速产生气泡,生成了使带火星的木条复燃的气体C,使金属E红热并伸入盛有气体C且瓶底有少量液体D的集气瓶中,金属E剧烈燃烧,火星四射,生成黑色固体F。
(3)写出它们的名称:
A. B. C. D. E. F. 。
(4)黑色粉末B在A的分解反应中起 作用,是这个反应的 。
【答案】(1)过氧化氢;二氧化锰;氧气;水;铁;四氧化三铁
(2)催化;催化
19、某市九年级学生进行了化学实验操作考试,考到了“木炭在氧气中燃烧”这一实验,如图1所示,请回答:
(1)用坩埚钳夹取一小块木炭放在酒精灯火焰的________部分迅速加热,然后把红热的木炭插入盛有氧气的集气瓶中,正确的操作是__________。
A.直接插入到集气瓶底部 B.由瓶口向下缓慢插入
(2)B图中,燃烧停止后,取出坩埚钳,往集气瓶里加入少量澄清石灰水并振荡,观察到的现象是_______________,此实验的目的是_______________________。
图1 图2
【答案】(1)外焰 B
(2)澄清石灰水变浑浊 验证木炭与氧气反应生成了二氧化碳
*20、某淡黄色固体A,在空气中点燃后发出微弱的淡蓝色火焰,放入无色气体B中,发出蓝紫色火焰,并都生成有刺激性气味的气体C,试推断:
A____ ____、B____ ____、C____ ____。
【答案】硫 氧气 二氧化硫
21、某同学设计了测定空气中氧气含量的实验,实验装置如图,回答下列问题:
( 1 )实验前要先检查装置的 _____ 。
( 2 )该实验中红磷需稍过量,目的是 _____ 集气瓶中预先要有少量的水,其作用是 _____ 。
【答案】气密性 把集气瓶中的氧气耗尽 辅助降温、吸收五氧化二磷
22、写出下列反应的文字表达式。
(1)磷在空气中燃烧: _______ _____ 。
(2)铁丝在氧气中燃烧: ______ __________ 。
(3)加热高锰酸钾制氧气: ___ ______________ 。
【答案】(1)磷+氧气五氧化二磷
(2)铁+氧气四氧化三铁
(3)高锰酸钾锰酸钾+二氧化锰+氧气
23、在一次实验中,小明不小心把硫酸铜溶液滴加到了盛有过氧化氢溶液的试管中,立即有大量的气泡产生。请你和小明一起填写空白。
(1)检验试管中产生的气体为氧气的方法是_____________;
(2)小明根据实验现象推测硫酸铜溶液可能是此反应的________________;写出该反应的符号表达式________。
(3)小明如果要进一步确定他的猜想,还须设计实验并通过实验确认它在化学反应前后_____和_______都没有发生变化。
.【答案】(1)用带火星的木条伸入试管中,观察木条是否复燃
(2)催化剂; (3)质量;化学性质
三、实验题。
24、同学们在学习完氧气的性质后,知道了“氧气能使带火星的木条复燃”,在此基础上,同学们提出了以下问题,并逐一进行了探究。
(1)【问题一】带火星的木条复燃能否证明氧气是纯氧?
【进行实验】同学们用数字化实验探测仪进行实验(如图),并获得了一系列数据。
集气瓶编号 ① ② ③ ④ ⑤
氧气浓度(体积分数) 25% 35% 45% … 65%
带火星木条情况 微亮 亮 很亮 复燃 复燃
【收集证据】④号集气瓶内的氧气浓度可能是 。
【实验结论】 。
【反思与评价】分析以上数据可知欲收集瓶较为纯净的氧气最好的收集方法是 。
(2)【问题二】铁丝在氧气中的燃烧与氧气浓度和铁丝粗细有关系吗?
实验编号 ① ② ③ ④ ⑤
氧气浓度(体积分数) 34% 47% 60% 73% 86%
直径0.2mm的细铁丝 不燃烧 稍有燃烧 剧烈燃烧 剧烈燃烧 剧烈燃烧
直径0.5mm的粗铁丝 不燃烧 不燃烧 不燃烧 稍有燃烧 剧烈燃烧
【收集证据】⑤号实验中细铁丝燃烧的完整实验现象是 。
【实验解释】有关反应的文字表达式是 ,实验操作中,在集气瓶底部放少量水的目的是 。
【实验结论】Ⅰ.氧气浓度越大,铁丝燃烧越 。
Ⅱ 。
【表达与交流】在完成铁丝燃烧的实验时,为保证实验成功需注意的一项实验操作是 。
【答案】(1)【收集证据】55%;
【实验结论】带火星的木条复燃不能证明氧气是纯氧;
【反思与评价】排水法;
(2)【收集证据】铁丝剧烈燃烧,火星四射,生成黑色固体;防止灼热的生成物溅落,使集气瓶底部炸裂;铁+氧气四氧化三铁;
【实验结论】Ⅰ.剧烈;
Ⅱ.铁丝越细,燃烧越剧烈;
【表达与交流】实验前用砂纸除去铁丝表面的脏物或铁锈。
25、在老师的指导下,小华和小明利用如图 1 所示装置对氯酸钾制氧气进行了深入的探究学习。
资料:
①氯酸钾的熔点约为 356℃,二氧化锰的分解温度约为 535℃.用酒精灯给物质加热,受热物质的温度一般约为 400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图 2)及不同配比时氧气浓度随温度的变化示意图(图 3)如下:
请回答问题:
(1)二氧化锰在 535℃以上分解生成四氧化三锰和氧气,其反应方程式为:
。
3MnO2
Mn3O4+O2↑(2)分析图 2,氧气的浓度随温度升高逐渐减小,在 380℃突然增大的原因是
温度升高,气体膨胀,氧气的浓度变小氯酸钾分解温度高于 (填“高于”、“等于”或“低于”)其熔点。
(3)分析图 3,氯酸钾分解温度随物质配比变化的规律是质量比越小,分解温度越低或质量比越大,分解温度越高 。
步骤 实验操作 实验现象
I 检查气密性
II 分别在“Y”形管两侧支管中加入少量的二氧化锰和氯酸钾塞紧橡皮塞
III 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导气管口。 加热左侧支管,可观察到带火星的木条不复燃,加热右侧支管,可观察到氯酸钾融化为液态,带火星木条复燃。
IV 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 加热时间短于步骤 III,木条很快复燃。
(4)为证实二氧化锰的催化作用,小华利用如图 4 装置进行如表所示的实验:请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到 带火星的木条不复燃,加热左侧试管的目的是证明在酒精灯加热的条件下二氧化锰不分解 。加热右侧支管,可观察到氯酸钾融化为液态,带火星木条复燃 。
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是将Y形管向右倾斜 。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的质量 和
化学性质 不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的化学方程式为2KClO3 2KCl+3O2↑。
【答案】(1)二氧化锰四氧化三锰+氧气↑
(2)温度升高,气体膨胀,氧气的浓度变小;高于
(3)质量比越小,分解温度越低或质量比越大,分解温度越高
(4)①带火星的木条不复燃;证明在酒精灯加热的条件下二氧化锰不分解;氯酸钾融化为液态,带火星木条复燃;②将Y形管向右倾斜;③质量;化学性质;氯酸钾氯化钾+氧气
*人教九年级上册第2单元 我们周围的空气*
一、选择题。
1、如图为空气成分示意图(按体积分数计算),其中“X”代表的是( )
A.氧气 B.二氧化碳 C.氮气 D.稀有气体
2、空气中含量较多且能用于食品包装的气体是( )
A.氮气 B.氧气 C.稀有气体 D.二氧化碳
3、有关空气中各成分的相关说法不正确的是( )。
A. 空气中N2的体积分数为78%
B. O2的化学性质比较活泼,具有可燃性
C. CO2是绿色植物进行光合作用的原料之一
D. 稀有气体化学性质稳定,可用作保护气
4、下列变化过程中,无氧气产生的是( )
A.在过氧化氢溶液中加二氧化锰 B.植物的光合作用
C.加热氯酸钾和二氧化锰的混合物 D.石蜡燃烧
5、下列关于氧气的叙述错误的是( )
A.通常情况下,空气是无色无味的气体,空气中的氧气也是无色无味的气体
B.液态氧是淡蓝色的,固态氧是蓝色的
C.氧气在通常状况下,不易溶于水,密度比空气略大
D.在高山上出现高山反应是因为高山上没有氧气
6、实验室用氯酸钾制备氧气,发生的反应为:氯酸钾 氯化钾+氧气。现取一定量的氯酸钾和二氧化锰进行加热,某变量y随时间的变化趋势如图所示。则y表示的是( )
A.生成O2的体积 B.生成KCl的质量
C.固体中氧元素的质量 D.固体中MnO2的质量分数
7、一氧化氮气体难溶于水,密度略大于空气。常温下易与空气中的氧气反应生成红棕色的二氧化氮。实验室收集一氧化氮,宜采用的方法是( )。
A.向上排空气法 B.排水法
C.向上排空气法或排水法 D.向下排空气法或排水法
8、正确的实验操作对实验结果和人身安全都非常重要,下列实验操作正确的是( )
A. 氧气验满 B. 液体加热
C. 读液体的体积 D. 稀释浓硫酸
9、甲、乙、丙是初中化学常见的三种物质,其相互转化关系如图所示,甲、乙均为液体,且元素组成相同,丙为气体。下列说法不正确的( )
A.转化①、②、③可通过分解反应实现
B.转化④可通过化合反应实现
C.转化③、④中,一定有元素的化合价发生了变化
D.气体丙可以燃烧
10、将过氧化氢溶液与二氧化锰混合可得到一种气体,关于这种气体性质的叙述正确的是( )
A.它是人类生存不可缺少的物质
B.它是具有轻微刺激性气味的气体
C.它可以燃烧
D.它易溶于水
11、如图为空气成分示意图(按体积分数计算),其中“a”代表的是 ( )
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
*12、下列关于空气的说法中正确的是 ( )
A.空气中氮气的质量分数为78%
B.通常情况下,空气中氧气体积与总体积之比约为1∶5
C.空气中二氧化碳的体积只占约0.04%,因此它的作用很小
D.空气中含量最少的是稀有气体
13、在实验室中,区别氧气和空气可以使用的方法是 ( )
A.闻气味
B.将空气和氧气分别液化
C.将空气和氧气分别溶于水
D.将带火星的木条分别伸入盛有空气和氧气的集气瓶中
14、实验室用100g溶质质量分数20%的双氧水与一定质量的二氧化锰混合制取氧气,为使反应慢点进行而又不影响生成氧气的质量,则下列操作不能达到目的是( )
A. 逐滴加入双氧水 B. 加水稀
C. 减少双氧水的用量 D. 降低温度
15、实验室用加热高锰酸钾制氧气,并用排水法收集的主要操作步骤如下:①点燃酒精灯,先使试管均匀受热,然后对准药品部位加热;
②将药品装入试管,用带导管的单孔橡皮塞塞紧试管;
③收集完毕,将导管从水槽中取出;
④检查装置的气密性;
⑤用排水法收集氧气;
⑥将试管固定在铁架台上;
⑦熄灭酒精灯。其中正确的操作顺序是( )
A.④②⑥①⑤③⑦ B.②④⑥①⑤③⑦
C.④②⑥①⑤⑦③ D.②④⑥①⑤⑦③
二、填空题。
16、空气是由多种气体组成的混合物,是一种宝贵的自然资源。
( 1 )空气中稀有气体的体积分数大约为 ______ 。
( 2 )鱼虾能在水中生存是因为氧气易溶于水,这种说法 ______ (填 “正确”或“不正确”)。
( 3 )因为氮气具有 ______ 的性质,所以充入食品包装袋内用于防腐。
( 4 )菜农定期会向蔬菜大棚中补充二氧化碳,这样做有利于植物进行 ______ 作用。
17、现有①木炭②硫磺③红磷④细铁丝四种物质分别在氧气中燃烧,用序号回答问题:
(1)发出明亮蓝紫色火焰的是________
(2)产生大量白烟的是________
(3)产生的气体能使澄清石灰水变浑浊的是________
(4)剧烈燃烧,火星四射的是________.
18、将一种无色无味的液体A装入试管,用带火星的木条伸入试管,无现象,而向其中加入少量黑色粉末B后,迅速产生气泡,生成了使带火星的木条复燃的气体C,使金属E红热并伸入盛有气体C且瓶底有少量液体D的集气瓶中,金属E剧烈燃烧,火星四射,生成黑色固体F。
(1)写出它们的名称:
A. B. C. D. E. F. 。
(2)黑色粉末B在A的分解反应中起 作用,是这个反应的 。
19、某市九年级学生进行了化学实验操作考试,考到了“木炭在氧气中燃烧”这一实验,如图1所示,请回答:
(1)用坩埚钳夹取一小块木炭放在酒精灯火焰的________部分迅速加热,然后把红热的木炭插入盛有氧气的集气瓶中,正确的操作是__________。
A.直接插入到集气瓶底部 B.由瓶口向下缓慢插入
(2)B图中,燃烧停止后,取出坩埚钳,往集气瓶里加入少量澄清石灰水并振荡,观察到的现象是_______________,此实验的目的是_______________________。
图1 图2
*20、某淡黄色固体A,在空气中点燃后发出微弱的淡蓝色火焰,放入无色气体B中,发出蓝紫色火焰,并都生成有刺激性气味的气体C,试推断:
A____ ____、B____ ____、C____ ____。
21、某同学设计了测定空气中氧气含量的实验,实验装置如图,回答下列问题:
( 1 )实验前要先检查装置的 _____ 。
( 2 )该实验中红磷需稍过量,目的是 _____ 集气瓶中预先要有少量的水,其作用是 _____ 。
22、写出下列反应的文字表达式。
(1)磷在空气中燃烧: _______ _____ 。
(2)铁丝在氧气中燃烧: ______ __________ 。
(3)加热高锰酸钾制氧气: ___ ______________ 。
23、在一次实验中,小明不小心把硫酸铜溶液滴加到了盛有过氧化氢溶液的试管中,立即有大量的气泡产生。请你和小明一起填写空白。
(1)检验试管中产生的气体为氧气的方法是_____________;
(2)小明根据实验现象推测硫酸铜溶液可能是此反应的________________;写出该反应的符号表达式________。
(3)小明如果要进一步确定他的猜想,还须设计实验并通过实验确认它在化学反应前后_____和_______都没有发生变化。
三、实验题。
24、同学们在学习完氧气的性质后,知道了“氧气能使带火星的木条复燃”,在此基础上,同学们提出了以下问题,并逐一进行了探究。
(1)【问题一】带火星的木条复燃能否证明氧气是纯氧?
【进行实验】同学们用数字化实验探测仪进行实验(如图),并获得了一系列数据。
集气瓶编号 ① ② ③ ④ ⑤
氧气浓度(体积分数) 25% 35% 45% … 65%
带火星木条情况 微亮 亮 很亮 复燃 复燃
【收集证据】④号集气瓶内的氧气浓度可能是 。
【实验结论】 。
【反思与评价】分析以上数据可知欲收集瓶较为纯净的氧气最好的收集方法是 。
(2)【问题二】铁丝在氧气中的燃烧与氧气浓度和铁丝粗细有关系吗?
实验编号 ① ② ③ ④ ⑤
氧气浓度(体积分数) 34% 47% 60% 73% 86%
直径0.2mm的细铁丝 不燃烧 稍有燃烧 剧烈燃烧 剧烈燃烧 剧烈燃烧
直径0.5mm的粗铁丝 不燃烧 不燃烧 不燃烧 稍有燃烧 剧烈燃烧
【收集证据】⑤号实验中细铁丝燃烧的完整实验现象是 。
【实验解释】有关反应的文字表达式是 ,实验操作中,在集气瓶底部放少量水的目的是 。
【实验结论】Ⅰ.氧气浓度越大,铁丝燃烧越 。
Ⅱ 。
【表达与交流】在完成铁丝燃烧的实验时,为保证实验成功需注意的一项实验操作是 。
25、在老师的指导下,小华和小明利用如图 1 所示装置对氯酸钾制氧气进行了深入的探究学习。
资料:
①氯酸钾的熔点约为 356℃,二氧化锰的分解温度约为 535℃.用酒精灯给物质加热,受热物质的温度一般约为 400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图 2)及不同配比时氧气浓度随温度的变化示意图(图 3)如下:
请回答问题:
(1)二氧化锰在 535℃以上分解生成四氧化三锰和氧气,其文字表达式为:
。
3MnO2
Mn3O4+O2↑(2)分析图 2,氧气的浓度随温度升高逐渐减小,在 380℃突然增大的原因是
温度升高,气体膨胀,氧气的浓度变小氯酸钾分解温度高于 (填“高于”、“等于”或“低于”)其熔点。
(3)分析图 3,氯酸钾分解温度随物质配比变化的规律是质量比越小,分解温度越低或质量比越大,分解温度越高 。
步骤 实验操作 实验现象
I 检查气密性
II 分别在“Y”形管两侧支管中加入少量的二氧化锰和氯酸钾塞紧橡皮塞
III 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导气管口。 加热左侧支管,可观察到带火星的木条不复燃,加热右侧支管,可观察到氯酸钾融化为液态,带火星木条复燃。
IV 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 加热时间短于步骤 III,木条很快复燃。
(4)为证实二氧化锰的催化作用,小华利用如图 4 装置进行如表所示的实验:请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到 带火星的木条不复燃,加热左侧试管的目的是证明在酒精灯加热的条件下二氧化锰不分解 。加热右侧支管,可观察到氯酸钾融化为液态,带火星木条复燃 。
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是将Y形管向右倾斜 。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的质量 和
化学性质 不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的文字表达式为2KClO3 2KCl+3O2↑。
2022—2023学年化学人教九年级上册第2单元 我们周围的空气 分层选练题含答案
*人教九年级上册第2单元 我们周围的空气*
一、选择题。
1、如图为空气成分示意图(按体积分数计算),其中“X”代表的是( )
A.氧气 B.二氧化碳 C.氮气 D.稀有气体
【答案】C
2、空气中含量较多且能用于食品包装的气体是( )
A.氮气 B.氧气 C.稀有气体 D.二氧化碳
【答案】A
3、有关空气中各成分的相关说法不正确的是( )。
A. 空气中N2的体积分数为78%
B. O2的化学性质比较活泼,具有可燃性
C. CO2是绿色植物进行光合作用的原料之一
D. 稀有气体化学性质稳定,可用作保护气
【答案】C
4、下列变化过程中,无氧气产生的是( )
A.在过氧化氢溶液中加二氧化锰 B.植物的光合作用
C.加热氯酸钾和二氧化锰的混合物 D.石蜡燃烧
【答案】D
5、下列关于氧气的叙述错误的是( )
A.通常情况下,空气是无色无味的气体,空气中的氧气也是无色无味的气体
B.液态氧是淡蓝色的,固态氧是蓝色的
C.氧气在通常状况下,不易溶于水,密度比空气略大
D.在高山上出现高山反应是因为高山上没有氧气
【答案】D
6、实验室用氯酸钾制备氧气,发生的反应为:氯酸钾 氯化钾+氧气。现取一定量的氯酸钾和二氧化锰进行加热,某变量y随时间的变化趋势如图所示。则y表示的是( )
A.生成O2的体积 B.生成KCl的质量
C.固体中氧元素的质量 D.固体中MnO2的质量分数
【答案】D
7、一氧化氮气体难溶于水,密度略大于空气。常温下易与空气中的氧气反应生成红棕色的二氧化氮。实验室收集一氧化氮,宜采用的方法是( )。
A.向上排空气法 B.排水法
C.向上排空气法或排水法 D.向下排空气法或排水法
【答案】B
8、正确的实验操作对实验结果和人身安全都非常重要,下列实验操作正确的是( )
A. 氧气验满 B. 液体加热
C. 读液体的体积 D. 稀释浓硫酸
【答案】C
9、甲、乙、丙是初中化学常见的三种物质,其相互转化关系如图所示,甲、乙均为液体,且元素组成相同,丙为气体。下列说法不正确的( )
A.转化①、②、③可通过分解反应实现
B.转化④可通过化合反应实现
C.转化③、④中,一定有元素的化合价发生了变化
D.气体丙可以燃烧
【答案】D
10、将过氧化氢溶液与二氧化锰混合可得到一种气体,关于这种气体性质的叙述正确的是( )
A.它是人类生存不可缺少的物质
B.它是具有轻微刺激性气味的气体
C.它可以燃烧
D.它易溶于水
【答案】A
11、如图为空气成分示意图(按体积分数计算),其中“a”代表的是 ( )
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
【答案】B
*12、下列关于空气的说法中正确的是 ( )
A.空气中氮气的质量分数为78%
B.通常情况下,空气中氧气体积与总体积之比约为1∶5
C.空气中二氧化碳的体积只占约0.04%,因此它的作用很小
D.空气中含量最少的是稀有气体
【答案】B
13、在实验室中,区别氧气和空气可以使用的方法是 ( )
A.闻气味
B.将空气和氧气分别液化
C.将空气和氧气分别溶于水
D.将带火星的木条分别伸入盛有空气和氧气的集气瓶中
【答案】D
14、实验室用100g溶质质量分数20%的双氧水与一定质量的二氧化锰混合制取氧气,为使反应慢点进行而又不影响生成氧气的质量,则下列操作不能达到目的是( )
A. 逐滴加入双氧水 B. 加水稀
C. 减少双氧水的用量 D. 降低温度
【答案】C
15、实验室用加热高锰酸钾制氧气,并用排水法收集的主要操作步骤如下:①点燃酒精灯,先使试管均匀受热,然后对准药品部位加热;
②将药品装入试管,用带导管的单孔橡皮塞塞紧试管;
③收集完毕,将导管从水槽中取出;
④检查装置的气密性;
⑤用排水法收集氧气;
⑥将试管固定在铁架台上;
⑦熄灭酒精灯。其中正确的操作顺序是( )
A.④②⑥①⑤③⑦ B.②④⑥①⑤③⑦
C.④②⑥①⑤⑦③ D.②④⑥①⑤⑦③
【答案】A
二、填空题。
16、空气是由多种气体组成的混合物,是一种宝贵的自然资源。
( 1 )空气中稀有气体的体积分数大约为 ______ 。
( 2 )鱼虾能在水中生存是因为氧气易溶于水,这种说法 ______ (填 “正确”或“不正确”)。
( 3 )因为氮气具有 ______ 的性质,所以充入食品包装袋内用于防腐。
( 4 )菜农定期会向蔬菜大棚中补充二氧化碳,这样做有利于植物进行 ______ 作用。
【答案】0.94% 不正确 稳定 光合
17、现有①木炭②硫磺③红磷④细铁丝四种物质分别在氧气中燃烧,用序号回答问题:
(1)发出明亮蓝紫色火焰的是________
(2)产生大量白烟的是________
(3)产生的气体能使澄清石灰水变浑浊的是________
(4)剧烈燃烧,火星四射的是________.
【答案】 (1). ②; (2). ③; (3). ①; (4). ④.
18、将一种无色无味的液体A装入试管,用带火星的木条伸入试管,无现象,而向其中加入少量黑色粉末B后,迅速产生气泡,生成了使带火星的木条复燃的气体C,使金属E红热并伸入盛有气体C且瓶底有少量液体D的集气瓶中,金属E剧烈燃烧,火星四射,生成黑色固体F。
(3)写出它们的名称:
A. B. C. D. E. F. 。
(4)黑色粉末B在A的分解反应中起 作用,是这个反应的 。
【答案】(1)过氧化氢;二氧化锰;氧气;水;铁;四氧化三铁
(2)催化;催化
19、某市九年级学生进行了化学实验操作考试,考到了“木炭在氧气中燃烧”这一实验,如图1所示,请回答:
(1)用坩埚钳夹取一小块木炭放在酒精灯火焰的________部分迅速加热,然后把红热的木炭插入盛有氧气的集气瓶中,正确的操作是__________。
A.直接插入到集气瓶底部 B.由瓶口向下缓慢插入
(2)B图中,燃烧停止后,取出坩埚钳,往集气瓶里加入少量澄清石灰水并振荡,观察到的现象是_______________,此实验的目的是_______________________。
图1 图2
【答案】(1)外焰 B
(2)澄清石灰水变浑浊 验证木炭与氧气反应生成了二氧化碳
*20、某淡黄色固体A,在空气中点燃后发出微弱的淡蓝色火焰,放入无色气体B中,发出蓝紫色火焰,并都生成有刺激性气味的气体C,试推断:
A____ ____、B____ ____、C____ ____。
【答案】硫 氧气 二氧化硫
21、某同学设计了测定空气中氧气含量的实验,实验装置如图,回答下列问题:
( 1 )实验前要先检查装置的 _____ 。
( 2 )该实验中红磷需稍过量,目的是 _____ 集气瓶中预先要有少量的水,其作用是 _____ 。
【答案】气密性 把集气瓶中的氧气耗尽 辅助降温、吸收五氧化二磷
22、写出下列反应的文字表达式。
(1)磷在空气中燃烧: _______ _____ 。
(2)铁丝在氧气中燃烧: ______ __________ 。
(3)加热高锰酸钾制氧气: ___ ______________ 。
【答案】(1)磷+氧气五氧化二磷
(2)铁+氧气四氧化三铁
(3)高锰酸钾锰酸钾+二氧化锰+氧气
23、在一次实验中,小明不小心把硫酸铜溶液滴加到了盛有过氧化氢溶液的试管中,立即有大量的气泡产生。请你和小明一起填写空白。
(1)检验试管中产生的气体为氧气的方法是_____________;
(2)小明根据实验现象推测硫酸铜溶液可能是此反应的________________;写出该反应的符号表达式________。
(3)小明如果要进一步确定他的猜想,还须设计实验并通过实验确认它在化学反应前后_____和_______都没有发生变化。
.【答案】(1)用带火星的木条伸入试管中,观察木条是否复燃
(2)催化剂; (3)质量;化学性质
三、实验题。
24、同学们在学习完氧气的性质后,知道了“氧气能使带火星的木条复燃”,在此基础上,同学们提出了以下问题,并逐一进行了探究。
(1)【问题一】带火星的木条复燃能否证明氧气是纯氧?
【进行实验】同学们用数字化实验探测仪进行实验(如图),并获得了一系列数据。
集气瓶编号 ① ② ③ ④ ⑤
氧气浓度(体积分数) 25% 35% 45% … 65%
带火星木条情况 微亮 亮 很亮 复燃 复燃
【收集证据】④号集气瓶内的氧气浓度可能是 。
【实验结论】 。
【反思与评价】分析以上数据可知欲收集瓶较为纯净的氧气最好的收集方法是 。
(2)【问题二】铁丝在氧气中的燃烧与氧气浓度和铁丝粗细有关系吗?
实验编号 ① ② ③ ④ ⑤
氧气浓度(体积分数) 34% 47% 60% 73% 86%
直径0.2mm的细铁丝 不燃烧 稍有燃烧 剧烈燃烧 剧烈燃烧 剧烈燃烧
直径0.5mm的粗铁丝 不燃烧 不燃烧 不燃烧 稍有燃烧 剧烈燃烧
【收集证据】⑤号实验中细铁丝燃烧的完整实验现象是 。
【实验解释】有关反应的文字表达式是 ,实验操作中,在集气瓶底部放少量水的目的是 。
【实验结论】Ⅰ.氧气浓度越大,铁丝燃烧越 。
Ⅱ 。
【表达与交流】在完成铁丝燃烧的实验时,为保证实验成功需注意的一项实验操作是 。
【答案】(1)【收集证据】55%;
【实验结论】带火星的木条复燃不能证明氧气是纯氧;
【反思与评价】排水法;
(2)【收集证据】铁丝剧烈燃烧,火星四射,生成黑色固体;防止灼热的生成物溅落,使集气瓶底部炸裂;铁+氧气四氧化三铁;
【实验结论】Ⅰ.剧烈;
Ⅱ.铁丝越细,燃烧越剧烈;
【表达与交流】实验前用砂纸除去铁丝表面的脏物或铁锈。
25、在老师的指导下,小华和小明利用如图 1 所示装置对氯酸钾制氧气进行了深入的探究学习。
资料:
①氯酸钾的熔点约为 356℃,二氧化锰的分解温度约为 535℃.用酒精灯给物质加热,受热物质的温度一般约为 400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图 2)及不同配比时氧气浓度随温度的变化示意图(图 3)如下:
请回答问题:
(1)二氧化锰在 535℃以上分解生成四氧化三锰和氧气,其反应方程式为:
。
3MnO2
Mn3O4+O2↑(2)分析图 2,氧气的浓度随温度升高逐渐减小,在 380℃突然增大的原因是
温度升高,气体膨胀,氧气的浓度变小氯酸钾分解温度高于 (填“高于”、“等于”或“低于”)其熔点。
(3)分析图 3,氯酸钾分解温度随物质配比变化的规律是质量比越小,分解温度越低或质量比越大,分解温度越高 。
步骤 实验操作 实验现象
I 检查气密性
II 分别在“Y”形管两侧支管中加入少量的二氧化锰和氯酸钾塞紧橡皮塞
III 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导气管口。 加热左侧支管,可观察到带火星的木条不复燃,加热右侧支管,可观察到氯酸钾融化为液态,带火星木条复燃。
IV 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 加热时间短于步骤 III,木条很快复燃。
(4)为证实二氧化锰的催化作用,小华利用如图 4 装置进行如表所示的实验:请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到 带火星的木条不复燃,加热左侧试管的目的是证明在酒精灯加热的条件下二氧化锰不分解 。加热右侧支管,可观察到氯酸钾融化为液态,带火星木条复燃 。
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是将Y形管向右倾斜 。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的质量 和
化学性质 不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的化学方程式为2KClO3 2KCl+3O2↑。
【答案】(1)二氧化锰四氧化三锰+氧气↑
(2)温度升高,气体膨胀,氧气的浓度变小;高于
(3)质量比越小,分解温度越低或质量比越大,分解温度越高
(4)①带火星的木条不复燃;证明在酒精灯加热的条件下二氧化锰不分解;氯酸钾融化为液态,带火星木条复燃;②将Y形管向右倾斜;③质量;化学性质;氯酸钾氯化钾+氧气
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
