化学人教版(2019)选择性必修2 3.3金属晶体(共70张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3金属晶体(共70张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-26 22:34:13 | ||
图片预览










文档简介
(共70张PPT)
第三章
晶体结构与性质
第三节 金属晶体
19世纪中叶的一个冬天,驻守在彼得堡的俄军发棉衣时发现,成千上万套棉衣上的扣子都没有了。俄皇大发雷霆,要把负责监制军服的大臣问罪。但所有军服都是钉了扣子的,为什么都丢了呢?原来,这些扣子是用锡做成的,而锡一遇低温,就会变成粉末,这种现象叫“锡疫”。一般情况下,只要在13.2 ℃以下,锡就会变成粉末。当时是彼得堡的初冬,气温很低,锡当然都“化”了。
那么,锡为什么会发生“锡疫”?在发生“锡疫”前,锡原子之间是如何结合在一起的呢?
Ti
金属样品
一、金属键
金属阳离子和自由电子之间的强烈的
相互作用
金属阳离子和自由电子
1.概念:
2.成键粒子:
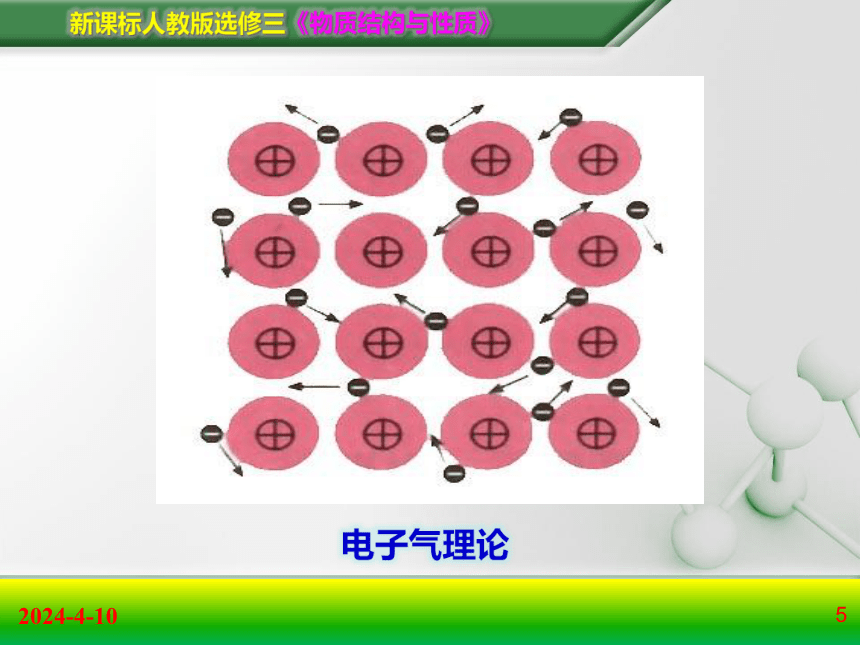
金属原子脱落来的价电子形成遍布整个晶体的“电子气”,被所有原子所共用,从而把所有的原子维系在一起。
4.金属键的本质--电子气理论:
3.金属键的存在:
存在于金属单质和合金中
电子气理论
4.金属键的特征
金属键没有饱和性和方向性
5.影响金属键强弱的因素:
阳离子所带电荷越多、
半径越小,
金属键越强
自由电子可以在整块金属中自由移动
二.金属晶体
1.概念:
金属原子之间通过金属键作用形成的晶体
2.构成粒子:
金属阳离子和自由电子
4.物理性质:
良好导电性、导热性
良好的延展性
金属光泽
共性:
特性:
熔、沸点,硬度变化幅度很大
3.粒子间相互作用:
金属键
5.熔化时破坏的作用力:金属键
一般来说,
金属阳离子所带电荷越多、
离子半径越小,
金属键越强,
熔、沸点就越高,
硬度越大。
资料
金属之最
熔点最低的金属是--------
汞 [-38.87℃]
熔点最高的金属是--------
钨 [3410℃]
密度最小的金属是--------
锂 [0.53g/cm3]
密度最大的金属是--------
锇 [22.57g/cm3]
硬度最小的金属是--------
铯 [0.2]
硬度最大的金属是--------
铬 [9.0]
最活泼的金属是----------
铯
最稳定的金属是----------
金
延性最好的金属是--------
铂[铂丝直径: mm]
展性最好的金属是--------
金[金箔厚: mm]
【思考1】已知碱金属元素的熔沸点随原子序数的增大而递减,试用金属键理论加以解释。
【思考2】试判断钠、镁、铝三种金属熔沸点和硬度的大小。
同周期元素,从左到右,价电子数依次增大,原子(离子)半径依次减弱,则单质中所形成金属键依次增强,故钠、镁、铝三种金属熔沸点和硬度的大小顺序是:钠<镁<铝。
同主族元素价电子数相同(阳离子所带电荷数相同),从上到下,原子(离子)半径依次增大,则单质中所形成金属键依次减弱,故碱金属元素的熔沸点随原子序数的增大而递减。
6、电子气理论对金属的物理性质的解释
在金属晶体中,充满着带负电的“电子 气”,这些电子气的运动是没有一定方向的。在外电场作用下电子气发生定向移动,形成电流,所以金属容易导电。
⑴金属导电性的解释
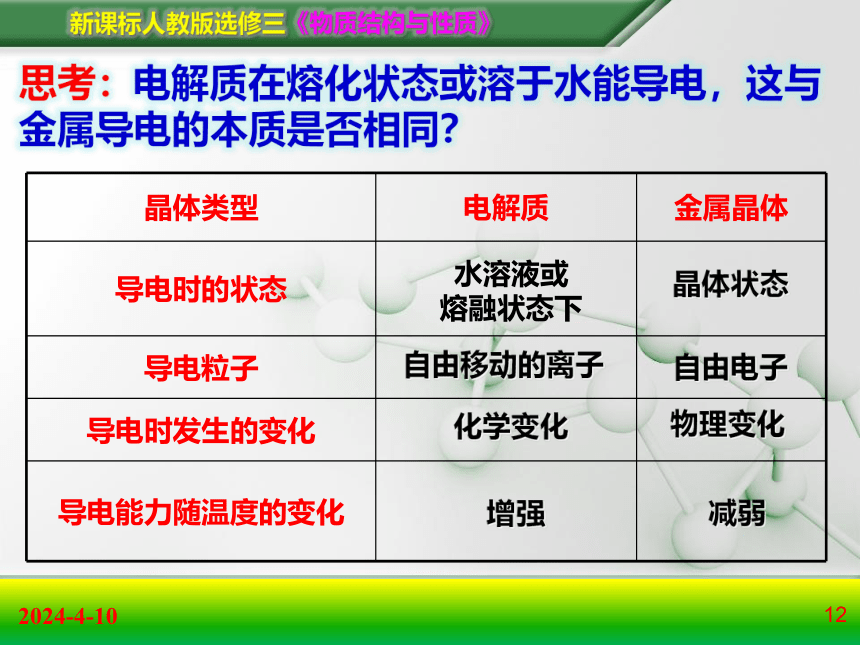
晶体类型 电解质 金属晶体
导电时的状态
导电粒子
导电时发生的变化
导电能力随温度的变化
水溶液或
熔融状态下
晶体状态
自由移动的离子
自由电子
思考:电解质在熔化状态或溶于水能导电,这与金属导电的本质是否相同?
化学变化
物理变化
增强
减弱
“电子气”(自由电子)在运动时经常与金属离子碰撞,引起两者能量的交换。当金属某部分受热时,那个区域里的“电子气”(自由电子)能量增加,运动速度加快,通过碰撞,把能量传给金属离子。电子气”中的自由电子,在热的作用下与金属阳离子频繁碰撞从而把能量从高温部分传递到低温部分,从而使整块金属达到相同的温度。
⑵金属导热性的解释
当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以在各原子层之间发生相对滑动以后,仍可保持这种相互作用,因而即使在外力作用下,发生形变金属键不易断裂。因此,金属都有良好的延展性。
⑶金属延展性的解释
自由电子
+
金属离子
金属原子
错位
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
(4)金属光泽和颜色的解释
由于自由电子可吸收所有频率的光,然后很快释放出各种频率的光,因此绝大多数金属具有银白色或钢灰色光泽。而某些金属(如铜、金、铯、铅等)由于较易吸收某些频率的光而呈现较为特殊的颜色。
当金属成粉末状时,金属晶体的晶面取向杂乱、晶格排列不规则,吸收可见光后辐射不出去,所以成黑色。
金属晶体的结构与性质的关系
导电性 导热性 延展性
金属离子和自由电子 自由电子在外加电场的作用下发生定向移动 自由电子与金属离子碰撞传递热量 晶体中各原子层相对滑动仍保持相互作用
知识回顾:三种晶体类型与性质的比较
晶体类型 原子晶体 分子晶体 金属晶体
概念
作用力
构成微粒
物 理 性 质 熔沸点
硬度
导电性
实例
共价键
范德华力
和氢键
金属键
原子
分子
金属阳离子
和自由电子
很高
很低
差别较大
很大
很小
差别较大
无(硅为半导体)
无
导体
相邻原子之间以共价键相结合而成具有空间网状结构的晶体
分子间以范德华力相结合而成的晶体
通过金属键形成的晶体
金刚石、二氧化硅、
晶体硅、碳化硅
Ar、S等
Au、Fe、Cu、钢铁等
金属晶体的形成是因为晶体中存在( )
A.金属离子间的相互作用
B.金属原子间的相互作用
C.金属离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
金属能导电的原因是( )
A.金属晶体中金属阳离子与自由电子间的 相互作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
课 堂 练 习
C
B
下列叙述正确的是( )
A.任何晶体中,若含有阳离子也一定含有阴离子
B.原子晶体中只含有共价键
C.离子晶体中只含有离子键,不含有共价键
D.分子晶体中只存在分子间作用力,不含有其他化学键
为什么碱金属单质的熔沸点从上到下逐渐降低,而卤素单质的熔沸点从上到下却升高?
B
课 堂 练 习
5.下列说法错误的是( )
A、镁的硬度大于铝
B、镁的熔沸点低于钙
C、镁的硬度大于钾
D、钙的熔沸点高于钾
AB
课 堂 练 习
6.下列四中有关性质的描述,可能是金属晶体的是
( )
A、有分子间作用力结合而成,熔点很低
B、固体或熔融态易导电,熔点较高
C、由共价键结合成网状晶体,熔点很高
D、固体不导电,熔融态也不导电,但溶于水后能导电
B
课 堂 练 习
由于金属键没有饱和性和方向性,每个金属原子中的电子分布基本是球型对称的,所以把金属晶体可以看成是由直径相等的圆球的三维空间堆积而成的。
理论基础:
二、金属晶体的原子堆积模型
紧密堆积:
微粒之间的作用力,使微粒间尽可能的相互接近,使它们占有最小的空间。
空间利用率:
晶体空间被粒子占据的百分数。
配位数:
晶体中每个粒子周围距离最近且相等的粒子的数目。
金属原子在一维(直线)方向上的排列方式
等径圆球密置列
金属原子在二维空间(平面)上有的排列方式
等径圆球非密置层
配位数=4
配位数=6
等径圆球密置层
金属晶体可以看成金属原子等径圆球在三维空间中堆积而成.那么,非密置层在三维空间里有几种堆积方式?不同方式堆积时金属晶体的配位数、空间利用率、晶胞类型是什么?
思考与交流
非密置层之间采取非密置堆积
1、简单立方堆积
[ Po ]
配位数:
空间占有率:
每个晶胞含原子数:
6
1
52%
代表金属:
金属原子半径r与正方体边长a的关系:
a
a
a
a
a = 2 r
非密置层之间采取密置堆积方式
配位数:
空间占有率:
每个晶胞含原子数:
8
68%
2
2、体心立方堆积-----钾型
代表金属:
K、Na、Fe
金属原子半径r与正方体边长a的关系:
a
a
a
a
2
a
b = 4 r
b =
3
a
a = 4 r
3
b
2
a
镁型
铜型
金属晶体的两种最密堆积方式
思考:密置层的堆积方式有哪些?
1
2
3
4
5
6
第二层可以将球对准1,3,5 位,
或对准 2,4,6 位。
1
2
3
4
5
6
A
B
,
关键是第三层,对第一、二层来说,第三层可以有两种最紧密的堆积方式。
第一种是将球对准第一层的球
1
2
3
4
5
6
每两层形成一个周期
AB AB 堆积方式
形成六方紧密堆积。
配位数 12 。 ( 同层 6,上下层各 3 ) ,空间利用率为74%
六方紧密堆积的前视图
A
B
A
B
A
1
2
3
4
5
6
1200
3.六方最密堆积--镁型
配位数:
每个晶胞含原子数:
空间利用率:
代表金属:
12
(同层 6,上、下层各 3)
2
Mg、Zn、Ti
74%
金属原子的半径r与六棱柱的边长a、高h
的关系:
a = 2 r
a
h
h =
a
6
3
2
第三层的另一种排列方式将球对准第一层的
2,4,6 位,不同于 AB 两层的位置,这是 C 层
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
面心立方最密堆积的前视图
A
B
C
A
A
B
C
第四层再排 A
ABC ABC 三层一个周期 面心立方最密堆积。
4.面心立方最密堆积-铜型
B
C
A
1
2
3
4
5
6
B
C
A
配位数:
空间占有率:
每个晶胞含原子数:
B
C
A
12
74%
4
代表金属:
Cu、Ag、Au
边长为 a
面对角线边长为 a=4r
金属原子半径 r与正方体边长a 的关系:
密堆积的八面体空隙和四面体空隙
堆积方式 晶胞类型 空间利用率 配位数 实例
面心立方最密堆积
堆积方式及性质小结
简单立方堆积
体心立方密堆积
六方最密堆积
面心立方
六方
体心立方
简单立方
74%
74%
68%
52%
12
12
8
6
Cu、Ag、Au
Mg、Zn、Ti
Na、K、Fe
Po
三、空间利用率的计算
空间利用率:指构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。
球体积
空间利用率= = 100%
晶胞体积
a
a
a
a
a = 2 r
1、简单立方晶胞
空间利用率=
4πr3/3
(2r)3
=
≈52%
π
6
a
a
a
a
2
a
b = 4 r
b =
3
a
a = 4 r
3
b
2
a
2、体心立方晶胞
a = 4 r /
3
空间利用率=
2×4πr3/3
( )3
=
≈68%
π
8
4 r /
3
3
边长为: a
面对角线边长为: b
a=4r
= a
a=4r/
空间利用率=
4×4πr3/3
( )3
=
≈74%
π
6
4 r /
3、面心立方晶胞
a = 2 r
a
h
h =
a
6
3
2
4、六方密堆积
平行四边形的面积:
2
2
3
60
sin
a
a
a
S
=
×
=
o
a = 2 r
a
h
h =
a
6
3
2
3
3
2
2
8
2
3
6
2
2
3
r
a
a
a
V
=
=
X
=
晶胞
空间利用率=
2×4πr3/3
8 r3
=
≈74%
π
6
石墨晶体结构模型
石墨是层状结构的混合型晶体
石墨晶体结构俯视图
1.下列有关金属元素特征的叙述中正确的是
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属单质的熔点总是高于分子晶体
能力训练
2.下列生活中的问题,不能用金属键知识解释的是 ( )
A.用铁制品做炊具
B.用金属铝制成导线
C.用铂金做首饰
D.铁易生锈
D
3.下列物质中含有金属键的是 ( )
A、金属铝 B、合金
C、NaOH D、NH4Cl
AB
4.金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强;与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是 ( )
A、Li Na K B、Na Mg Al
C、Li Be Mg D、Li Na Mg
B
5.下列有关金属晶体叙述正确的是( )
A、常温下金属单质都以金属晶体形式存在
B、金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C、钙的熔、沸点低于钾
D、温度越高,金属的导电性越好
B
6.下列有关金属元素特征的叙述中正确的是
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属单质的熔点总是高于分子晶体
√
7.某些金属晶体(Cu、Ag、Au)的原子按面心立方的形式紧密堆积,即在晶体结构中可以划出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个侧面上,试计算这类金属晶体中原子的空间利用率。
第三章
晶体结构与性质
第三节 金属晶体
19世纪中叶的一个冬天,驻守在彼得堡的俄军发棉衣时发现,成千上万套棉衣上的扣子都没有了。俄皇大发雷霆,要把负责监制军服的大臣问罪。但所有军服都是钉了扣子的,为什么都丢了呢?原来,这些扣子是用锡做成的,而锡一遇低温,就会变成粉末,这种现象叫“锡疫”。一般情况下,只要在13.2 ℃以下,锡就会变成粉末。当时是彼得堡的初冬,气温很低,锡当然都“化”了。
那么,锡为什么会发生“锡疫”?在发生“锡疫”前,锡原子之间是如何结合在一起的呢?
Ti
金属样品
一、金属键
金属阳离子和自由电子之间的强烈的
相互作用
金属阳离子和自由电子
1.概念:
2.成键粒子:
金属原子脱落来的价电子形成遍布整个晶体的“电子气”,被所有原子所共用,从而把所有的原子维系在一起。
4.金属键的本质--电子气理论:
3.金属键的存在:
存在于金属单质和合金中
电子气理论
4.金属键的特征
金属键没有饱和性和方向性
5.影响金属键强弱的因素:
阳离子所带电荷越多、
半径越小,
金属键越强
自由电子可以在整块金属中自由移动
二.金属晶体
1.概念:
金属原子之间通过金属键作用形成的晶体
2.构成粒子:
金属阳离子和自由电子
4.物理性质:
良好导电性、导热性
良好的延展性
金属光泽
共性:
特性:
熔、沸点,硬度变化幅度很大
3.粒子间相互作用:
金属键
5.熔化时破坏的作用力:金属键
一般来说,
金属阳离子所带电荷越多、
离子半径越小,
金属键越强,
熔、沸点就越高,
硬度越大。
资料
金属之最
熔点最低的金属是--------
汞 [-38.87℃]
熔点最高的金属是--------
钨 [3410℃]
密度最小的金属是--------
锂 [0.53g/cm3]
密度最大的金属是--------
锇 [22.57g/cm3]
硬度最小的金属是--------
铯 [0.2]
硬度最大的金属是--------
铬 [9.0]
最活泼的金属是----------
铯
最稳定的金属是----------
金
延性最好的金属是--------
铂[铂丝直径: mm]
展性最好的金属是--------
金[金箔厚: mm]
【思考1】已知碱金属元素的熔沸点随原子序数的增大而递减,试用金属键理论加以解释。
【思考2】试判断钠、镁、铝三种金属熔沸点和硬度的大小。
同周期元素,从左到右,价电子数依次增大,原子(离子)半径依次减弱,则单质中所形成金属键依次增强,故钠、镁、铝三种金属熔沸点和硬度的大小顺序是:钠<镁<铝。
同主族元素价电子数相同(阳离子所带电荷数相同),从上到下,原子(离子)半径依次增大,则单质中所形成金属键依次减弱,故碱金属元素的熔沸点随原子序数的增大而递减。
6、电子气理论对金属的物理性质的解释
在金属晶体中,充满着带负电的“电子 气”,这些电子气的运动是没有一定方向的。在外电场作用下电子气发生定向移动,形成电流,所以金属容易导电。
⑴金属导电性的解释
晶体类型 电解质 金属晶体
导电时的状态
导电粒子
导电时发生的变化
导电能力随温度的变化
水溶液或
熔融状态下
晶体状态
自由移动的离子
自由电子
思考:电解质在熔化状态或溶于水能导电,这与金属导电的本质是否相同?
化学变化
物理变化
增强
减弱
“电子气”(自由电子)在运动时经常与金属离子碰撞,引起两者能量的交换。当金属某部分受热时,那个区域里的“电子气”(自由电子)能量增加,运动速度加快,通过碰撞,把能量传给金属离子。电子气”中的自由电子,在热的作用下与金属阳离子频繁碰撞从而把能量从高温部分传递到低温部分,从而使整块金属达到相同的温度。
⑵金属导热性的解释
当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以在各原子层之间发生相对滑动以后,仍可保持这种相互作用,因而即使在外力作用下,发生形变金属键不易断裂。因此,金属都有良好的延展性。
⑶金属延展性的解释
自由电子
+
金属离子
金属原子
错位
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
(4)金属光泽和颜色的解释
由于自由电子可吸收所有频率的光,然后很快释放出各种频率的光,因此绝大多数金属具有银白色或钢灰色光泽。而某些金属(如铜、金、铯、铅等)由于较易吸收某些频率的光而呈现较为特殊的颜色。
当金属成粉末状时,金属晶体的晶面取向杂乱、晶格排列不规则,吸收可见光后辐射不出去,所以成黑色。
金属晶体的结构与性质的关系
导电性 导热性 延展性
金属离子和自由电子 自由电子在外加电场的作用下发生定向移动 自由电子与金属离子碰撞传递热量 晶体中各原子层相对滑动仍保持相互作用
知识回顾:三种晶体类型与性质的比较
晶体类型 原子晶体 分子晶体 金属晶体
概念
作用力
构成微粒
物 理 性 质 熔沸点
硬度
导电性
实例
共价键
范德华力
和氢键
金属键
原子
分子
金属阳离子
和自由电子
很高
很低
差别较大
很大
很小
差别较大
无(硅为半导体)
无
导体
相邻原子之间以共价键相结合而成具有空间网状结构的晶体
分子间以范德华力相结合而成的晶体
通过金属键形成的晶体
金刚石、二氧化硅、
晶体硅、碳化硅
Ar、S等
Au、Fe、Cu、钢铁等
金属晶体的形成是因为晶体中存在( )
A.金属离子间的相互作用
B.金属原子间的相互作用
C.金属离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
金属能导电的原因是( )
A.金属晶体中金属阳离子与自由电子间的 相互作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
课 堂 练 习
C
B
下列叙述正确的是( )
A.任何晶体中,若含有阳离子也一定含有阴离子
B.原子晶体中只含有共价键
C.离子晶体中只含有离子键,不含有共价键
D.分子晶体中只存在分子间作用力,不含有其他化学键
为什么碱金属单质的熔沸点从上到下逐渐降低,而卤素单质的熔沸点从上到下却升高?
B
课 堂 练 习
5.下列说法错误的是( )
A、镁的硬度大于铝
B、镁的熔沸点低于钙
C、镁的硬度大于钾
D、钙的熔沸点高于钾
AB
课 堂 练 习
6.下列四中有关性质的描述,可能是金属晶体的是
( )
A、有分子间作用力结合而成,熔点很低
B、固体或熔融态易导电,熔点较高
C、由共价键结合成网状晶体,熔点很高
D、固体不导电,熔融态也不导电,但溶于水后能导电
B
课 堂 练 习
由于金属键没有饱和性和方向性,每个金属原子中的电子分布基本是球型对称的,所以把金属晶体可以看成是由直径相等的圆球的三维空间堆积而成的。
理论基础:
二、金属晶体的原子堆积模型
紧密堆积:
微粒之间的作用力,使微粒间尽可能的相互接近,使它们占有最小的空间。
空间利用率:
晶体空间被粒子占据的百分数。
配位数:
晶体中每个粒子周围距离最近且相等的粒子的数目。
金属原子在一维(直线)方向上的排列方式
等径圆球密置列
金属原子在二维空间(平面)上有的排列方式
等径圆球非密置层
配位数=4
配位数=6
等径圆球密置层
金属晶体可以看成金属原子等径圆球在三维空间中堆积而成.那么,非密置层在三维空间里有几种堆积方式?不同方式堆积时金属晶体的配位数、空间利用率、晶胞类型是什么?
思考与交流
非密置层之间采取非密置堆积
1、简单立方堆积
[ Po ]
配位数:
空间占有率:
每个晶胞含原子数:
6
1
52%
代表金属:
金属原子半径r与正方体边长a的关系:
a
a
a
a
a = 2 r
非密置层之间采取密置堆积方式
配位数:
空间占有率:
每个晶胞含原子数:
8
68%
2
2、体心立方堆积-----钾型
代表金属:
K、Na、Fe
金属原子半径r与正方体边长a的关系:
a
a
a
a
2
a
b = 4 r
b =
3
a
a = 4 r
3
b
2
a
镁型
铜型
金属晶体的两种最密堆积方式
思考:密置层的堆积方式有哪些?
1
2
3
4
5
6
第二层可以将球对准1,3,5 位,
或对准 2,4,6 位。
1
2
3
4
5
6
A
B
,
关键是第三层,对第一、二层来说,第三层可以有两种最紧密的堆积方式。
第一种是将球对准第一层的球
1
2
3
4
5
6
每两层形成一个周期
AB AB 堆积方式
形成六方紧密堆积。
配位数 12 。 ( 同层 6,上下层各 3 ) ,空间利用率为74%
六方紧密堆积的前视图
A
B
A
B
A
1
2
3
4
5
6
1200
3.六方最密堆积--镁型
配位数:
每个晶胞含原子数:
空间利用率:
代表金属:
12
(同层 6,上、下层各 3)
2
Mg、Zn、Ti
74%
金属原子的半径r与六棱柱的边长a、高h
的关系:
a = 2 r
a
h
h =
a
6
3
2
第三层的另一种排列方式将球对准第一层的
2,4,6 位,不同于 AB 两层的位置,这是 C 层
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
面心立方最密堆积的前视图
A
B
C
A
A
B
C
第四层再排 A
ABC ABC 三层一个周期 面心立方最密堆积。
4.面心立方最密堆积-铜型
B
C
A
1
2
3
4
5
6
B
C
A
配位数:
空间占有率:
每个晶胞含原子数:
B
C
A
12
74%
4
代表金属:
Cu、Ag、Au
边长为 a
面对角线边长为 a=4r
金属原子半径 r与正方体边长a 的关系:
密堆积的八面体空隙和四面体空隙
堆积方式 晶胞类型 空间利用率 配位数 实例
面心立方最密堆积
堆积方式及性质小结
简单立方堆积
体心立方密堆积
六方最密堆积
面心立方
六方
体心立方
简单立方
74%
74%
68%
52%
12
12
8
6
Cu、Ag、Au
Mg、Zn、Ti
Na、K、Fe
Po
三、空间利用率的计算
空间利用率:指构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。
球体积
空间利用率= = 100%
晶胞体积
a
a
a
a
a = 2 r
1、简单立方晶胞
空间利用率=
4πr3/3
(2r)3
=
≈52%
π
6
a
a
a
a
2
a
b = 4 r
b =
3
a
a = 4 r
3
b
2
a
2、体心立方晶胞
a = 4 r /
3
空间利用率=
2×4πr3/3
( )3
=
≈68%
π
8
4 r /
3
3
边长为: a
面对角线边长为: b
a=4r
= a
a=4r/
空间利用率=
4×4πr3/3
( )3
=
≈74%
π
6
4 r /
3、面心立方晶胞
a = 2 r
a
h
h =
a
6
3
2
4、六方密堆积
平行四边形的面积:
2
2
3
60
sin
a
a
a
S
=
×
=
o
a = 2 r
a
h
h =
a
6
3
2
3
3
2
2
8
2
3
6
2
2
3
r
a
a
a
V
=
=
X
=
晶胞
空间利用率=
2×4πr3/3
8 r3
=
≈74%
π
6
石墨晶体结构模型
石墨是层状结构的混合型晶体
石墨晶体结构俯视图
1.下列有关金属元素特征的叙述中正确的是
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属单质的熔点总是高于分子晶体
能力训练
2.下列生活中的问题,不能用金属键知识解释的是 ( )
A.用铁制品做炊具
B.用金属铝制成导线
C.用铂金做首饰
D.铁易生锈
D
3.下列物质中含有金属键的是 ( )
A、金属铝 B、合金
C、NaOH D、NH4Cl
AB
4.金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强;与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是 ( )
A、Li Na K B、Na Mg Al
C、Li Be Mg D、Li Na Mg
B
5.下列有关金属晶体叙述正确的是( )
A、常温下金属单质都以金属晶体形式存在
B、金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C、钙的熔、沸点低于钾
D、温度越高,金属的导电性越好
B
6.下列有关金属元素特征的叙述中正确的是
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属单质的熔点总是高于分子晶体
√
7.某些金属晶体(Cu、Ag、Au)的原子按面心立方的形式紧密堆积,即在晶体结构中可以划出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个侧面上,试计算这类金属晶体中原子的空间利用率。
