人教版选择性必修二 2.3.1 共价键的极性 课件30张
文档属性
| 名称 | 人教版选择性必修二 2.3.1 共价键的极性 课件30张 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-27 10:00:34 | ||
图片预览










文档简介
(共30张PPT)
共价键的极性
人教版选择性必修2第二章第三节
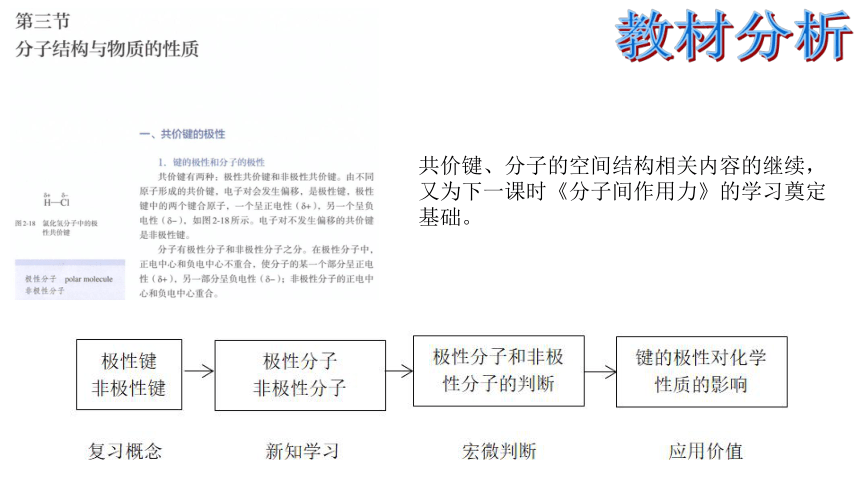
教材分析
共价键、分子的空间结构相关内容的继续,又为下一课时《分子间作用力》的学习奠定基础。
知道分子可以分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。
1) 学习目标
通过成键原子的电负性差异,认识到共价键的极性,学习共价键的分类。通过分子中共价键极性判断分子极性的实践活动,学习分子极性的判断方法和规则。以不同羧酸的pKa差异为例,认识有机分子中不同基团之间的相互影响。在宏微结合实践分析中,提升证据推理与模型认知素养,并在分子结构修饰中体验化学对生命健康与社会进步的价值。
2) 评价目标
通过从共价键极性与分子空间构型视角判断分子的极性,诊断学生对分子极性的理解,发展学生从极性键向量判断分子极性水平。
核心素养1 宏观辨识与微观探析
水平2 能从物质的微观结构说明同类物质的共性和不同类物质性质差异及其原因。
核心素养3 证据推理与模型认知
水平1 能识别化学中常见的物质模型;
水平2 能从宏观和微观结合上收集证据,能依据证据分析问题,推出合理的结论。
高中化学核心素养和质量标准
初步学习共价键和电负性的概念,会书写常见分子的电子式和结构式。
认识了酸的电离常数Ka
认知水平和能力
困难和问题
学习策略
极性分子和非极性分子的判断
已有的学科知识和生活经验出发,课上进行思考与讨论、总结归纳等,课下请教、做题练习、信息搜索等。
学情
教学目标
1.知道共价键可分为极性键和非极性键;能利用电负性判断共价键的极性。
3.能根据键的极性和分子的结构特点来判断分子的极性,并据此对分子的一些典型性质及其应用做出解释。
2.知道分子可分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。
教学重点
教学难点
极性分子和非极性分子的判断
教材分析
学情分析
1.教学模式
以学生为主体,引导进行讨论、分析和总结。教师指导,师生互动,学生实验、视频资源、PPT辅助等有机结合。
2.教学策略
开展总结概括、比较说明等活动,基于模型认知,运用实验事实、数据等证据素材。
3.教学手段及资源运用
结合生活中的例子,判断分子是否有极性的认知模型,借助常见分子的球棍模型宏观判断,实验教学,学生课外自主学习拓展新知。
共价键的极性
教学流程:
复习概念
新知学习
宏微判断
实验证实
应用价值
情境引入
极性分子、非极性分子
微波炉加热原理
极性键、非极性键
极性分子和非极性分子的判断
分子的极性实验
共价键的极性对化学性质的影响
教学过程
以物料吸收微波能,是物料中极性分子与微波电磁场相互作用的结果。在外加交变电磁场作用下,物料中极性分子随外加交变电磁场极性变更而交变取向,如此众多的极性分子因频繁相互间摩擦损耗,使电磁能转化为热能。
微波炉是利用其内部的磁控管,将电能转变成微波,当微波被食物吸收时,食物内极性分子快速振荡(每秒钟24亿5千万次),这种震荡的宏观表现就是食物被加热了。
你知道微波炉的加热原理吗?
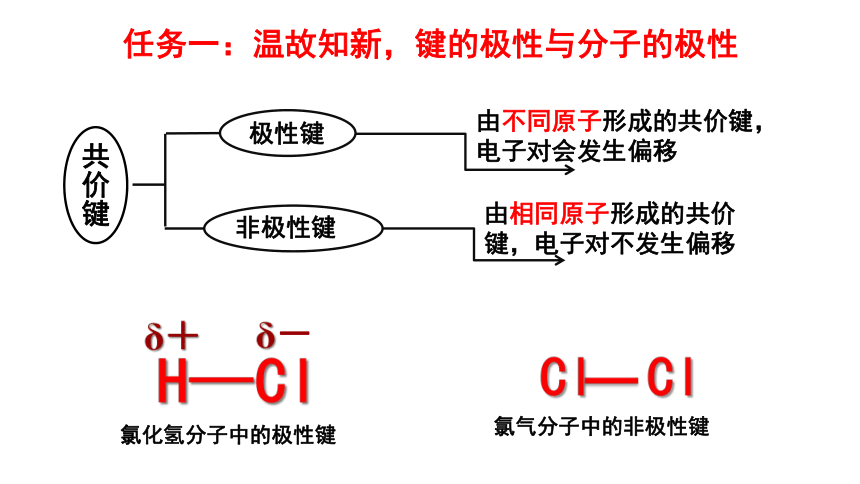
共价键
极性键
非极性键
由不同原子形成的共价键,
电子对会发生偏移
由相同原子形成的共价键,电子对不发生偏移
H—Cl
δ+
δ-
氯化氢分子中的极性键
任务一:温故知新,键的极性与分子的极性
Cl
Cl
氯气分子中的非极性键
分子的正电中心和负电中心不重合,使分子的某一部分呈正电性,另一部分呈负电性,这样的分子是极性分子。
分子的正电中心和负电中性重合,使分子没有带正电和带负电的两部分,这样的分子是非极性分子。
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子 完成下列表格。
H2 O2 Cl2 HCl
设计意图:从双原子分子入手,建立判断分子是否有极性的认知模型,初步学会判断分子极性的方法,即分子的正电中心和负电中心是否重合。
双原子分子 共价键的极性 正电中心和负电中心是否重合 分子极性 实例
不同种元素
同种元素
任务二:学以致用,分子极性的判断
根据上图,思考和回答下列问题:
(2)P4和C60是极性分子还是非极性分子
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
设计意图:结合实物球棍模型(或利用ChemBioDraw Ultra 12.0的插件CS Chem3D Model进行Ball&Stick投影展示),宏微结合,便于判断掌握。
正电中心和负电中心是否重合 分子极性 实例
不重合
重合
总结归纳:只含非极性键的分子一定是非极性分子;含有极性键的分子,如果分子空间结构不对称,则为极性分子,如果分子空间结构呈对称,则为非极性分子。
分 子
极性分子
非极性分子
正电中心与负电中心不重合
化学键的极性的向量和不等于零
正电中心与负电中心重合
化学键的极性的向量和等于零
只含非极性键的分子
含有极性键的分子
向量和不等于零
向量和等于零
一定是
根据化学键的极性的向量和,化学键的极性的向量和等于零是非极性分子,化学键的极性的向量和不等于零是极性分子。
学生实验:取两支酸式滴定管,分别装有H2O和CCl4,控制活塞使液体成细丝状流下。用丝绸摩擦过的玻璃棒靠近H2O柱和CCl4液柱,观察现象。
设计意图:构建宏微联系。通过实验激发兴趣,使“极性”这一抽象的概念直观形象化,促进对概念的理解和掌握,建立结构与性质之间的联系。
任务三:实践真知,分子的极性实验
小视频——《表面活性剂:使溶液体系发生变化的物质》
设计意图:贴近生活的教学内容,优化栏目功能,外显学科核心素养。
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
任务四:学以致用,键的极性对化学性质的影响
由于氯的电负性较大,极性:Cl3C— > Cl2CH— > ClCH2—导致三氯乙酸中的羧基的极性最大,更易电离出氢离子
结合下表中的pKa数据,引导分析
酸性:氯乙酸 < 二氯乙酸 < 三氯乙酸
学生活动:依次讨论分析,再给出解释说明。
酸性:三氯乙酸 < 三氟乙酸;丙酸<乙酸<甲酸。
氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
设计意图:利用数据定量证据推理微观结构与宏观性质的联系。
在充分讨论、比较和分析的基础上,归纳总结得出结论。
2Na+2H2O===2NaOH+H2↑
2Na+2CH3CH2OH 2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
强化运用
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈
学生总结,进行知识梳理。回忆本节课所学知识,教师点评并作补充,协助对所学内容进行归纳整理,补充完善。
课堂小结
作业设计:
板书设计:
教学反思
温故知新,结合生活中的例子,在学生已有知识水平的基础上进行新课教学,构建分子极性的认知模型,借助球棍模型宏观判断。及时总结概括。借助实验、视频等多种手段。
教学评价。时间安排可更合理些;关注面可更大些。学生没搞懂BF3与NH3是极性还是非极性分子,问学生,答错;声音低,语速快。知识点难度大,可讲细点。
改进点。《共价键的极性》为新课教学,1课时,另需习题教学。声音放大,借助小蜜蜂;放慢语速。在理解的基础上借助习题强化知识点掌握。
共价键的极性
人教版选择性必修2第二章第三节
教材分析
共价键、分子的空间结构相关内容的继续,又为下一课时《分子间作用力》的学习奠定基础。
知道分子可以分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。
1) 学习目标
通过成键原子的电负性差异,认识到共价键的极性,学习共价键的分类。通过分子中共价键极性判断分子极性的实践活动,学习分子极性的判断方法和规则。以不同羧酸的pKa差异为例,认识有机分子中不同基团之间的相互影响。在宏微结合实践分析中,提升证据推理与模型认知素养,并在分子结构修饰中体验化学对生命健康与社会进步的价值。
2) 评价目标
通过从共价键极性与分子空间构型视角判断分子的极性,诊断学生对分子极性的理解,发展学生从极性键向量判断分子极性水平。
核心素养1 宏观辨识与微观探析
水平2 能从物质的微观结构说明同类物质的共性和不同类物质性质差异及其原因。
核心素养3 证据推理与模型认知
水平1 能识别化学中常见的物质模型;
水平2 能从宏观和微观结合上收集证据,能依据证据分析问题,推出合理的结论。
高中化学核心素养和质量标准
初步学习共价键和电负性的概念,会书写常见分子的电子式和结构式。
认识了酸的电离常数Ka
认知水平和能力
困难和问题
学习策略
极性分子和非极性分子的判断
已有的学科知识和生活经验出发,课上进行思考与讨论、总结归纳等,课下请教、做题练习、信息搜索等。
学情
教学目标
1.知道共价键可分为极性键和非极性键;能利用电负性判断共价键的极性。
3.能根据键的极性和分子的结构特点来判断分子的极性,并据此对分子的一些典型性质及其应用做出解释。
2.知道分子可分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。
教学重点
教学难点
极性分子和非极性分子的判断
教材分析
学情分析
1.教学模式
以学生为主体,引导进行讨论、分析和总结。教师指导,师生互动,学生实验、视频资源、PPT辅助等有机结合。
2.教学策略
开展总结概括、比较说明等活动,基于模型认知,运用实验事实、数据等证据素材。
3.教学手段及资源运用
结合生活中的例子,判断分子是否有极性的认知模型,借助常见分子的球棍模型宏观判断,实验教学,学生课外自主学习拓展新知。
共价键的极性
教学流程:
复习概念
新知学习
宏微判断
实验证实
应用价值
情境引入
极性分子、非极性分子
微波炉加热原理
极性键、非极性键
极性分子和非极性分子的判断
分子的极性实验
共价键的极性对化学性质的影响
教学过程
以物料吸收微波能,是物料中极性分子与微波电磁场相互作用的结果。在外加交变电磁场作用下,物料中极性分子随外加交变电磁场极性变更而交变取向,如此众多的极性分子因频繁相互间摩擦损耗,使电磁能转化为热能。
微波炉是利用其内部的磁控管,将电能转变成微波,当微波被食物吸收时,食物内极性分子快速振荡(每秒钟24亿5千万次),这种震荡的宏观表现就是食物被加热了。
你知道微波炉的加热原理吗?
共价键
极性键
非极性键
由不同原子形成的共价键,
电子对会发生偏移
由相同原子形成的共价键,电子对不发生偏移
H—Cl
δ+
δ-
氯化氢分子中的极性键
任务一:温故知新,键的极性与分子的极性
Cl
Cl
氯气分子中的非极性键
分子的正电中心和负电中心不重合,使分子的某一部分呈正电性,另一部分呈负电性,这样的分子是极性分子。
分子的正电中心和负电中性重合,使分子没有带正电和带负电的两部分,这样的分子是非极性分子。
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子 完成下列表格。
H2 O2 Cl2 HCl
设计意图:从双原子分子入手,建立判断分子是否有极性的认知模型,初步学会判断分子极性的方法,即分子的正电中心和负电中心是否重合。
双原子分子 共价键的极性 正电中心和负电中心是否重合 分子极性 实例
不同种元素
同种元素
任务二:学以致用,分子极性的判断
根据上图,思考和回答下列问题:
(2)P4和C60是极性分子还是非极性分子
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
设计意图:结合实物球棍模型(或利用ChemBioDraw Ultra 12.0的插件CS Chem3D Model进行Ball&Stick投影展示),宏微结合,便于判断掌握。
正电中心和负电中心是否重合 分子极性 实例
不重合
重合
总结归纳:只含非极性键的分子一定是非极性分子;含有极性键的分子,如果分子空间结构不对称,则为极性分子,如果分子空间结构呈对称,则为非极性分子。
分 子
极性分子
非极性分子
正电中心与负电中心不重合
化学键的极性的向量和不等于零
正电中心与负电中心重合
化学键的极性的向量和等于零
只含非极性键的分子
含有极性键的分子
向量和不等于零
向量和等于零
一定是
根据化学键的极性的向量和,化学键的极性的向量和等于零是非极性分子,化学键的极性的向量和不等于零是极性分子。
学生实验:取两支酸式滴定管,分别装有H2O和CCl4,控制活塞使液体成细丝状流下。用丝绸摩擦过的玻璃棒靠近H2O柱和CCl4液柱,观察现象。
设计意图:构建宏微联系。通过实验激发兴趣,使“极性”这一抽象的概念直观形象化,促进对概念的理解和掌握,建立结构与性质之间的联系。
任务三:实践真知,分子的极性实验
小视频——《表面活性剂:使溶液体系发生变化的物质》
设计意图:贴近生活的教学内容,优化栏目功能,外显学科核心素养。
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
任务四:学以致用,键的极性对化学性质的影响
由于氯的电负性较大,极性:Cl3C— > Cl2CH— > ClCH2—导致三氯乙酸中的羧基的极性最大,更易电离出氢离子
结合下表中的pKa数据,引导分析
酸性:氯乙酸 < 二氯乙酸 < 三氯乙酸
学生活动:依次讨论分析,再给出解释说明。
酸性:三氯乙酸 < 三氟乙酸;丙酸<乙酸<甲酸。
氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
设计意图:利用数据定量证据推理微观结构与宏观性质的联系。
在充分讨论、比较和分析的基础上,归纳总结得出结论。
2Na+2H2O===2NaOH+H2↑
2Na+2CH3CH2OH 2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
强化运用
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈
学生总结,进行知识梳理。回忆本节课所学知识,教师点评并作补充,协助对所学内容进行归纳整理,补充完善。
课堂小结
作业设计:
板书设计:
教学反思
温故知新,结合生活中的例子,在学生已有知识水平的基础上进行新课教学,构建分子极性的认知模型,借助球棍模型宏观判断。及时总结概括。借助实验、视频等多种手段。
教学评价。时间安排可更合理些;关注面可更大些。学生没搞懂BF3与NH3是极性还是非极性分子,问学生,答错;声音低,语速快。知识点难度大,可讲细点。
改进点。《共价键的极性》为新课教学,1课时,另需习题教学。声音放大,借助小蜜蜂;放慢语速。在理解的基础上借助习题强化知识点掌握。
