人教版选择性必修一 1.1.1反应热 焓变 课件(20张PPT)
文档属性
| 名称 | 人教版选择性必修一 1.1.1反应热 焓变 课件(20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-27 10:55:45 | ||
图片预览








文档简介
(共21张PPT)
高中化学必修第一册
第1节 反应热
第一章 化学反应的热效应
(1)反应热 焓变
导入新课
7月23日12时41分,我国在中国文昌航天发射场,用长征五号遥四运载火箭成功发射首次火星探测任务天问一号探测器,火箭飞行约2167秒后,成功将探测器送入预定轨道,开启火星探测之旅,迈出了我国行星探测第一步。
火箭发动机的特点是同时使用燃料和氧化剂进行化学反应,以产生热排气,
液氢与液氧
煤油与液氧
讲授新课
如何定量分析化学反应过程中能量的释放与吸收?
1.反应热及其测定
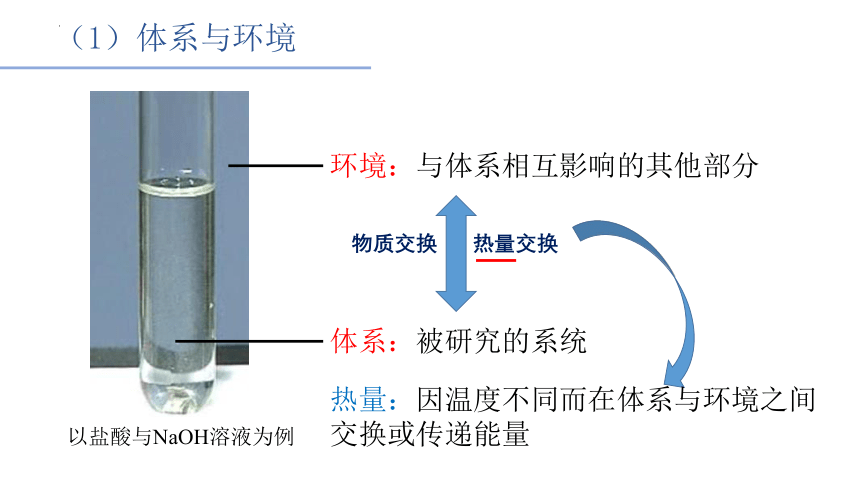
(1)体系与环境
环境:与体系相互影响的其他部分
体系:被研究的系统
以盐酸与NaOH溶液为例
物质交换
热量交换
热量:因温度不同而在体系与环境之间
交换或传递能量
(2)反应热
定义:等温条件下,化学体系向环境释放或从环境吸收热量。
称为化学反应的热效应(简称反应热)
注意:
等温含义:反应前后体系的温度相等
测量仪器:量热计
如何测量化学反应的热量?
2.中和反应反应热的测定
(1)步骤
①组装量热计
②反应物温度测量:
用量筒量取50mL 0.50mol/L盐酸, 打开杯盖, 倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
用另一个量筒量取50mL 0.55mol/L NaOH溶液, 用温度计测量并记录NaOH溶液的温度(数据填入下表)。
避免影响实验结果
③测量中和反应时最高温度
打开杯盖, 将量筒中的NaOH溶液迅速倒入量热计的内筒, 立即盖上杯盖, 插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)
④重复实验1-2次
⑤数据处理
(2)公式
Q = ( m1+m2 ) × c ×( t2 - t1 )
H = Q / n(H2O)
①公式
②反应后生成的溶液的比热容c=4.18 J/(g .℃),50 mL 0.50 mol/L盐酸与 50 mL 0.55 mol/LNaOH溶液发生中和反应时放出的热量为:(m1+m2)·c·(t2-t1)=_______________。
0.418(t2 - t1)kJ
③生成1mol水时放出的热量为 。
0.418(t2 - t1)
0.025
kJ
(3)措施
提高测定反应热准确度的措施有哪些?
使用比较精准的温度计
保温装置良好
操作时动作要快
多次试验求平均值
(4)定义
中和热——强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol 液态水时,放出的热量
若是弱酸、弱碱的稀溶液,由于弱酸、弱碱在电离时会吸热,所以放热小于57.3kJ。
若是酸、碱的浓溶液,由于酸、碱的浓溶液在稀释时会放热,所以放热大于57.3kJ。
注意事项:
57.3KJ
练习
1. 关于中和反应反应热的测定实验,下列说法正确的是( )
A.为了使反应进行得更完全,可以使酸或碱适当过量
B.为了使反应充分,可以向酸(碱)中分次加入碱(酸)
C.中和反应反应热测定的实验结果与所用酸、碱的用量和种类均无关
D.用铜丝代替玻璃搅拌棒,会使中和反应反应热的测定值偏大
A
练习
2.某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和反应反应热的测定。实验装置如图所示。
(1)仪器a的名称是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0 ℃。近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,实验后所得溶液的比热容c=4.18 J/(g·℃)。 则计算得ΔH= (取小数点后一位)。
玻璃搅拌器
53.5KJ
3.反应热与焓变
(1)焓与焓变
①内能:体系内物质的各种能量的总和
受温度、压强和物质的凝聚状态等影响
②焓:与内能有关的物理量 符号“H”
③焓变:生成物的焓-反应物的焓
即 H生-H反
符号“△H”单位:kJ·mol-1
等压条件,反应热等于焓变
(2)宏观分析
反应物
反应物
生成物
生成物
吸热反应
放热反应
焓减少
ΔH<0
ΔH值为“-”
焓增多
ΔH>0
ΔH值为“+”
生成物的总能量
反应物的总能量
ΔH =
(3)微观分析
反应物的总键能
生成物的总键能
ΔH =
1 mol H2与1 mol Cl2反应生成2 mol HCl分子的过程中,释放 了 183 kJ的能量
练习
3. 下列说法正确的是( )
A.焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
C
高中化学必修第一册
第1节 反应热
第一章 化学反应的热效应
(1)反应热 焓变
导入新课
7月23日12时41分,我国在中国文昌航天发射场,用长征五号遥四运载火箭成功发射首次火星探测任务天问一号探测器,火箭飞行约2167秒后,成功将探测器送入预定轨道,开启火星探测之旅,迈出了我国行星探测第一步。
火箭发动机的特点是同时使用燃料和氧化剂进行化学反应,以产生热排气,
液氢与液氧
煤油与液氧
讲授新课
如何定量分析化学反应过程中能量的释放与吸收?
1.反应热及其测定
(1)体系与环境
环境:与体系相互影响的其他部分
体系:被研究的系统
以盐酸与NaOH溶液为例
物质交换
热量交换
热量:因温度不同而在体系与环境之间
交换或传递能量
(2)反应热
定义:等温条件下,化学体系向环境释放或从环境吸收热量。
称为化学反应的热效应(简称反应热)
注意:
等温含义:反应前后体系的温度相等
测量仪器:量热计
如何测量化学反应的热量?
2.中和反应反应热的测定
(1)步骤
①组装量热计
②反应物温度测量:
用量筒量取50mL 0.50mol/L盐酸, 打开杯盖, 倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
用另一个量筒量取50mL 0.55mol/L NaOH溶液, 用温度计测量并记录NaOH溶液的温度(数据填入下表)。
避免影响实验结果
③测量中和反应时最高温度
打开杯盖, 将量筒中的NaOH溶液迅速倒入量热计的内筒, 立即盖上杯盖, 插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)
④重复实验1-2次
⑤数据处理
(2)公式
Q = ( m1+m2 ) × c ×( t2 - t1 )
H = Q / n(H2O)
①公式
②反应后生成的溶液的比热容c=4.18 J/(g .℃),50 mL 0.50 mol/L盐酸与 50 mL 0.55 mol/LNaOH溶液发生中和反应时放出的热量为:(m1+m2)·c·(t2-t1)=_______________。
0.418(t2 - t1)kJ
③生成1mol水时放出的热量为 。
0.418(t2 - t1)
0.025
kJ
(3)措施
提高测定反应热准确度的措施有哪些?
使用比较精准的温度计
保温装置良好
操作时动作要快
多次试验求平均值
(4)定义
中和热——强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol 液态水时,放出的热量
若是弱酸、弱碱的稀溶液,由于弱酸、弱碱在电离时会吸热,所以放热小于57.3kJ。
若是酸、碱的浓溶液,由于酸、碱的浓溶液在稀释时会放热,所以放热大于57.3kJ。
注意事项:
57.3KJ
练习
1. 关于中和反应反应热的测定实验,下列说法正确的是( )
A.为了使反应进行得更完全,可以使酸或碱适当过量
B.为了使反应充分,可以向酸(碱)中分次加入碱(酸)
C.中和反应反应热测定的实验结果与所用酸、碱的用量和种类均无关
D.用铜丝代替玻璃搅拌棒,会使中和反应反应热的测定值偏大
A
练习
2.某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和反应反应热的测定。实验装置如图所示。
(1)仪器a的名称是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0 ℃。近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,实验后所得溶液的比热容c=4.18 J/(g·℃)。 则计算得ΔH= (取小数点后一位)。
玻璃搅拌器
53.5KJ
3.反应热与焓变
(1)焓与焓变
①内能:体系内物质的各种能量的总和
受温度、压强和物质的凝聚状态等影响
②焓:与内能有关的物理量 符号“H”
③焓变:生成物的焓-反应物的焓
即 H生-H反
符号“△H”单位:kJ·mol-1
等压条件,反应热等于焓变
(2)宏观分析
反应物
反应物
生成物
生成物
吸热反应
放热反应
焓减少
ΔH<0
ΔH值为“-”
焓增多
ΔH>0
ΔH值为“+”
生成物的总能量
反应物的总能量
ΔH =
(3)微观分析
反应物的总键能
生成物的总键能
ΔH =
1 mol H2与1 mol Cl2反应生成2 mol HCl分子的过程中,释放 了 183 kJ的能量
练习
3. 下列说法正确的是( )
A.焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
C
