人教版选择性必修一 2.1.2. 影响化学反应速率的因素 活化能 课件(22张PPT)
文档属性
| 名称 | 人教版选择性必修一 2.1.2. 影响化学反应速率的因素 活化能 课件(22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-27 11:33:26 | ||
图片预览







文档简介
(共22张PPT)
第二课时 影响化学反应速率的因素 活化能
第一节 化学反应的速率
我们知道,相同条件下,不同的化学反应会有不同的速率。
这表明反应速率首先是由反应物的组成、结构和性质等内部因素决定。
其次,同一反应,在不同条件下的化学反应速率也是不同的,受外部因素浓度、压强、温度及催化剂等影响。
影响因素
内因:反应物本身的性质
外因:浓度、温度、压强、催化剂、接触面积
【思考】这些因素是如何影响化学反应速率的
(决定性因素)
1、通过实验探究,学会运用变量控制的方法研究化学反应速率;
2、认识反应条件对化学反应速率影响的一般规律,能运用规律解释生产、生活和科学实验中的实际问题。
3、能用简单碰撞理论说明反应条件对化学反应速率的影响。
一、影响化学反应速率的因素
1、定性研究影响化学反应速率的因素
【实验探究】浓度对化学反应速率的影响
实验 操作 原理 现象
结论 Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
溶液变浑浊,但速度慢
溶液变浑浊,但速度快
其他条件相同时,增大反应物浓度,化学反应速率加快。
【实验探究】温度对化学反应速率的影响
实验 操作 原理 现象
结论 Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
溶液变浑浊,但速度慢
溶液变浑浊,但速度快
其他条件相同时,升高反应体系的温度,化学反应速率加快。
冷水
热水
【实验探究】催化剂对化学反应速率的影响
实验 操作 原理 现象
结论 2H2O2 = 2H2O + O2↑
几乎无气泡产生
产生较多气泡
其他条件相同时,催化剂可以改变化学反应速率。
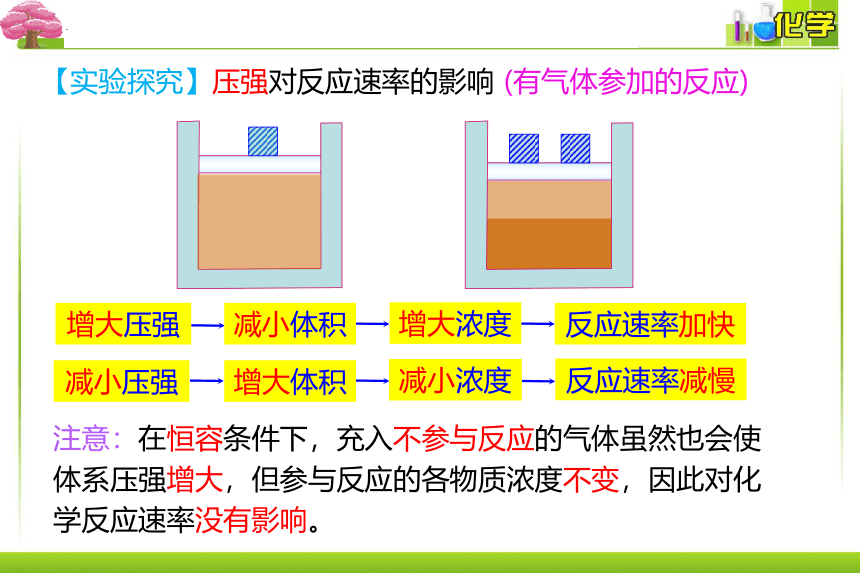
【实验探究】压强对反应速率的影响 (有气体参加的反应)
增大压强
减小体积
增大浓度
反应速率加快
减小压强
增大体积
减小浓度
反应速率减慢
注意:在恒容条件下,充入不参与反应的气体虽然也会使体系压强增大,但参与反应的各物质浓度不变,因此对化学反应速率没有影响。
实验 操作 原理 现象
结论 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
产生气泡,但速度慢
其他条件相同时,增大反应物的接触面积可以加快化学反应速率。
【实验探究】接触面积对反应速率的影响
产生气泡,但速度快
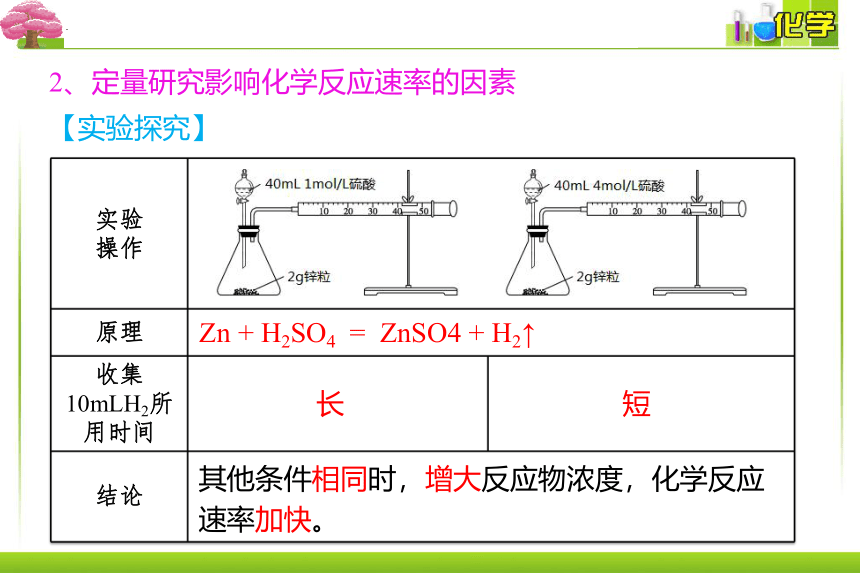
2、定量研究影响化学反应速率的因素
【实验探究】
实验 操作 原理 收集10mLH2所用时间
结论 Zn + H2SO4 = ZnSO4 + H2↑
长
短
其他条件相同时,增大反应物浓度,化学反应速率加快。
【归纳总结】
1、下列做法的目的与反应速率无关的是( ) A. 将煤块粉碎后燃烧
B. 食盐中添加碘酸钾 C. 合成氨反应中加催化剂Fe
D. 医护人员冷藏存放“新冠”疫苗
选项 金属(粉末状) 酸的浓度及体积 反应温度
A Mg,2.4g 3.0 mol/L硫酸100mL 25℃
B Zn,6.5g 6.0 mol/L硝酸100mL 30℃
C Fe,5.6g 18.4 mol/L硫酸100mL 25℃
D Zn,6.5g 6.0 mol/L盐酸100mL 25℃
2、下列各组反应(表中物质均为反应物)刚开始时,放出H2速率最快的是( )
B
A
C
4、足量块状铁与100mL 0.01mol/L的稀硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加NaCl溶液 ②加NaOH固体 ③加CH3COONa固体
④升高温度 ⑤将块状铁改为铁粉 ⑥改用的98%浓硫酸
A. ①②③ B. ③④⑥ C. ④⑤ D. ④⑤⑥
C
3、可使C(s)+CO2(g) 2CO(g)化学反应速率增大的措施是( )①缩小容器体积 ②升高温度 ③恒容条件下充N2 ④增加碳的量 ⑤恒压下充N2
A. ①②③④⑤ B. ①②③ C. ①② D. ②③
【思考】如何解释浓度、压强、温度及催化剂等因素对化学反应速率产生的影响呢
【回顾旧知】
要解释浓度、压强、温度及催化剂等因素对化学反应速率产生的影响,就必须清楚分子间发生化学反应的必要条件。
【思考】那分子间发生化学反应的必要条件是什么呢?
1918年,美国化学家路易斯提出了化学反应速率的简单碰撞理论。该理论认为,反应物分子间的碰撞是发生化学反应的先决条件。反应物分子间有效碰撞的频率越高,化学反应速率越大。
二、有效碰撞原理
实际上,大多数化学反应并不是经过简单碰撞一次就能完成的,更多的化学反应过程要分为多步进行。
【例如】 2HI = H2 + I2,实际上是经过下列两步反应完成的:
1、基元反应:通过一次碰撞就直接转化为产物的反应
【例如】
NO2 + CO = NO + CO2
2HI → H2 + 2I
2I → I2
反应历程(反应机理)
基元反应
基元反应
基元反应发生的先决条件:反应物的分子必须发生碰撞
自由基:带有单电子的原子或原子团
【思考】是不是反应物的分子每一次碰撞都能发生反应?
不是的
2、有效碰撞:能够发生化学反应的碰撞
力量不够
取向不好
有效碰撞
【思考】反应物的分子要发生有效碰撞需满足什么条件?
发生有效碰撞的条件:
(1)发生碰撞的分子必须有足够的能量;
(2)分子发生碰撞时必须有合适的取向。
4、活化分子:具有足够能量能发生有效碰撞的分子
5、活化能:反应物中的普通分子转化为活化分子所需的能量
活化分子
正反应的活化能
活化分子变成生成物
分子放出的能量
逆反应的活化能
【思考】活化能与反应热有关吗
反应热 H = E1 - E2
③有效碰撞的次数与单位体积内反应物中活化分子的数目(即活化分子百分数)有关。
6、化学反应历程
普通分子
发生反应
活化分子
吸收能量
(活化能)
有效碰撞
合适取向
注意:
①能发生有效碰撞的分子一定是活化分子;
②活化分子的碰撞不一定是有效碰撞;(由于取向问题)
④其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
1、浓度、压强对反应速率的影响
单位体积内 有效碰撞 几率 (次数) 化学反应速率
分子 总数 活化 分子数 活化分子百分数 增大浓度或增大压强
影响
外因
增加
增加
增多
加快
增大浓度
增大压强
二、碰撞理论解释化学反应速率的影响因素
不变
2、温度、催化剂对反应速率的影响
升温
催化剂作用:降低反应所需的活化能
单位体积内 有效碰撞 几率 (次数) 化学反应速率
分子 总数 活化 分子数 活化分子百分数 升高温度或加催化剂
影响
外因
不变
增加
增多
增加
加快
【归纳总结】
单位体积内 有效碰撞 几率 (次数) 化学反应速率
分子 总数 活化 分子数 活化分子百分数 增大浓度 增加 增加 不变 增多 加快
增大压强 增加 增加 不变 增多 加快
升高温度 不变 增加 增加 增多 加快
加催化剂 不变 增加 增加 增多 加快
影响
外因
结论:只有升高温度或加入催化剂能增加单位体积内的活化分子百分数 。
1、下列说法都错误的是( )①碰撞理论认为,反应物分子间进行碰撞才可能发生化学反应②活化分子间的碰撞一定是有效碰撞③催化剂加快反应速率的本质是降低了反应的活化能④只有增加活化分子的百分含量才能加快反应速率⑤对于基元反应而言,温度升高,反应速率一定增加 A. ①④ B. ②④ C. ③⑤ D. ②⑤
B
2、能改变反应物分子中活化分子百分数的条件是( )①浓度 ②压强 ③温度 ④催化剂 A. ①③ B. ②④ C. ③④ D. ①②③④
C
第二课时 影响化学反应速率的因素 活化能
第一节 化学反应的速率
我们知道,相同条件下,不同的化学反应会有不同的速率。
这表明反应速率首先是由反应物的组成、结构和性质等内部因素决定。
其次,同一反应,在不同条件下的化学反应速率也是不同的,受外部因素浓度、压强、温度及催化剂等影响。
影响因素
内因:反应物本身的性质
外因:浓度、温度、压强、催化剂、接触面积
【思考】这些因素是如何影响化学反应速率的
(决定性因素)
1、通过实验探究,学会运用变量控制的方法研究化学反应速率;
2、认识反应条件对化学反应速率影响的一般规律,能运用规律解释生产、生活和科学实验中的实际问题。
3、能用简单碰撞理论说明反应条件对化学反应速率的影响。
一、影响化学反应速率的因素
1、定性研究影响化学反应速率的因素
【实验探究】浓度对化学反应速率的影响
实验 操作 原理 现象
结论 Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
溶液变浑浊,但速度慢
溶液变浑浊,但速度快
其他条件相同时,增大反应物浓度,化学反应速率加快。
【实验探究】温度对化学反应速率的影响
实验 操作 原理 现象
结论 Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
溶液变浑浊,但速度慢
溶液变浑浊,但速度快
其他条件相同时,升高反应体系的温度,化学反应速率加快。
冷水
热水
【实验探究】催化剂对化学反应速率的影响
实验 操作 原理 现象
结论 2H2O2 = 2H2O + O2↑
几乎无气泡产生
产生较多气泡
其他条件相同时,催化剂可以改变化学反应速率。
【实验探究】压强对反应速率的影响 (有气体参加的反应)
增大压强
减小体积
增大浓度
反应速率加快
减小压强
增大体积
减小浓度
反应速率减慢
注意:在恒容条件下,充入不参与反应的气体虽然也会使体系压强增大,但参与反应的各物质浓度不变,因此对化学反应速率没有影响。
实验 操作 原理 现象
结论 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
产生气泡,但速度慢
其他条件相同时,增大反应物的接触面积可以加快化学反应速率。
【实验探究】接触面积对反应速率的影响
产生气泡,但速度快
2、定量研究影响化学反应速率的因素
【实验探究】
实验 操作 原理 收集10mLH2所用时间
结论 Zn + H2SO4 = ZnSO4 + H2↑
长
短
其他条件相同时,增大反应物浓度,化学反应速率加快。
【归纳总结】
1、下列做法的目的与反应速率无关的是( ) A. 将煤块粉碎后燃烧
B. 食盐中添加碘酸钾 C. 合成氨反应中加催化剂Fe
D. 医护人员冷藏存放“新冠”疫苗
选项 金属(粉末状) 酸的浓度及体积 反应温度
A Mg,2.4g 3.0 mol/L硫酸100mL 25℃
B Zn,6.5g 6.0 mol/L硝酸100mL 30℃
C Fe,5.6g 18.4 mol/L硫酸100mL 25℃
D Zn,6.5g 6.0 mol/L盐酸100mL 25℃
2、下列各组反应(表中物质均为反应物)刚开始时,放出H2速率最快的是( )
B
A
C
4、足量块状铁与100mL 0.01mol/L的稀硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加NaCl溶液 ②加NaOH固体 ③加CH3COONa固体
④升高温度 ⑤将块状铁改为铁粉 ⑥改用的98%浓硫酸
A. ①②③ B. ③④⑥ C. ④⑤ D. ④⑤⑥
C
3、可使C(s)+CO2(g) 2CO(g)化学反应速率增大的措施是( )①缩小容器体积 ②升高温度 ③恒容条件下充N2 ④增加碳的量 ⑤恒压下充N2
A. ①②③④⑤ B. ①②③ C. ①② D. ②③
【思考】如何解释浓度、压强、温度及催化剂等因素对化学反应速率产生的影响呢
【回顾旧知】
要解释浓度、压强、温度及催化剂等因素对化学反应速率产生的影响,就必须清楚分子间发生化学反应的必要条件。
【思考】那分子间发生化学反应的必要条件是什么呢?
1918年,美国化学家路易斯提出了化学反应速率的简单碰撞理论。该理论认为,反应物分子间的碰撞是发生化学反应的先决条件。反应物分子间有效碰撞的频率越高,化学反应速率越大。
二、有效碰撞原理
实际上,大多数化学反应并不是经过简单碰撞一次就能完成的,更多的化学反应过程要分为多步进行。
【例如】 2HI = H2 + I2,实际上是经过下列两步反应完成的:
1、基元反应:通过一次碰撞就直接转化为产物的反应
【例如】
NO2 + CO = NO + CO2
2HI → H2 + 2I
2I → I2
反应历程(反应机理)
基元反应
基元反应
基元反应发生的先决条件:反应物的分子必须发生碰撞
自由基:带有单电子的原子或原子团
【思考】是不是反应物的分子每一次碰撞都能发生反应?
不是的
2、有效碰撞:能够发生化学反应的碰撞
力量不够
取向不好
有效碰撞
【思考】反应物的分子要发生有效碰撞需满足什么条件?
发生有效碰撞的条件:
(1)发生碰撞的分子必须有足够的能量;
(2)分子发生碰撞时必须有合适的取向。
4、活化分子:具有足够能量能发生有效碰撞的分子
5、活化能:反应物中的普通分子转化为活化分子所需的能量
活化分子
正反应的活化能
活化分子变成生成物
分子放出的能量
逆反应的活化能
【思考】活化能与反应热有关吗
反应热 H = E1 - E2
③有效碰撞的次数与单位体积内反应物中活化分子的数目(即活化分子百分数)有关。
6、化学反应历程
普通分子
发生反应
活化分子
吸收能量
(活化能)
有效碰撞
合适取向
注意:
①能发生有效碰撞的分子一定是活化分子;
②活化分子的碰撞不一定是有效碰撞;(由于取向问题)
④其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
1、浓度、压强对反应速率的影响
单位体积内 有效碰撞 几率 (次数) 化学反应速率
分子 总数 活化 分子数 活化分子百分数 增大浓度或增大压强
影响
外因
增加
增加
增多
加快
增大浓度
增大压强
二、碰撞理论解释化学反应速率的影响因素
不变
2、温度、催化剂对反应速率的影响
升温
催化剂作用:降低反应所需的活化能
单位体积内 有效碰撞 几率 (次数) 化学反应速率
分子 总数 活化 分子数 活化分子百分数 升高温度或加催化剂
影响
外因
不变
增加
增多
增加
加快
【归纳总结】
单位体积内 有效碰撞 几率 (次数) 化学反应速率
分子 总数 活化 分子数 活化分子百分数 增大浓度 增加 增加 不变 增多 加快
增大压强 增加 增加 不变 增多 加快
升高温度 不变 增加 增加 增多 加快
加催化剂 不变 增加 增加 增多 加快
影响
外因
结论:只有升高温度或加入催化剂能增加单位体积内的活化分子百分数 。
1、下列说法都错误的是( )①碰撞理论认为,反应物分子间进行碰撞才可能发生化学反应②活化分子间的碰撞一定是有效碰撞③催化剂加快反应速率的本质是降低了反应的活化能④只有增加活化分子的百分含量才能加快反应速率⑤对于基元反应而言,温度升高,反应速率一定增加 A. ①④ B. ②④ C. ③⑤ D. ②⑤
B
2、能改变反应物分子中活化分子百分数的条件是( )①浓度 ②压强 ③温度 ④催化剂 A. ①③ B. ②④ C. ③④ D. ①②③④
C
