人教版选择性必修一 2.3化学反应的方向 课件30张
文档属性
| 名称 | 人教版选择性必修一 2.3化学反应的方向 课件30张 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-27 15:25:34 | ||
图片预览











文档简介
(共30张PPT)
S
H
2019人教版选择性必修一
第二章 化学反应速率和化学平衡
第三节 化学反应的方向
自发过程:在一定条件下,不借助外部力量就能自动
进行的过程,称为自发过程。
化学反应是否也能自发进行?
若能,如何判断化学反应自发进行的方向呢?
自然界中有一些过程是自发进行的,而且是有方向性的
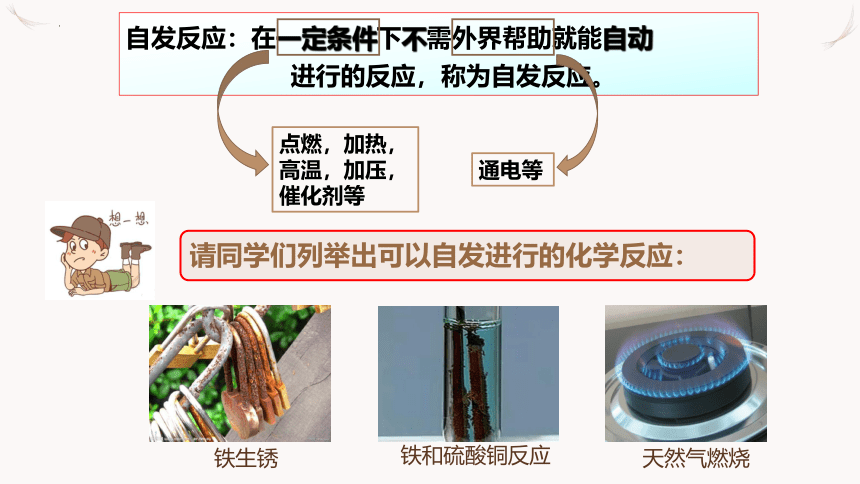
自发反应:在一定条件下不需外界帮助就能自动
进行的反应,称为自发反应。
通电等
点燃,加热,高温,加压,催化剂等
请同学们列举出可以自发进行的化学反应:
铁生锈
天然气燃烧
铁和硫酸铜反应
放热
反应物
生成物
能量
反应过程
△H<0
放热反应的能量变化图:
反应物
Ea
△H
生成物
反应进程
能量
反应物
Ea
△H
生成物
反应进程
能量
Ea很小,常温即能自发
Ea稍大,但
Ea<△H,给予外界条件一经引发后即能自发
Ea稍大,且
Ea>△H,需持续给予外界条件才能自发
反应物
Ea
△H
生成物
反应进程
能量
理想状态
H
判案依据:主要看能量变化
判词: △H<0 的反应有自发进行的倾向
放出能量,体系能量减少,△H<0
吸收能量,体系能量增加,△H>0
焓判据
吸热反应
自发
焓
实验探究
探究Ba(OH)2·8H2O (s)与NH4Cl(s)是否反应?
化学反应吸热使烧杯与木片间的水凝结成冰
△H>0
N2O5(g) = 4NO2(g) + O2(g) △ H = +56.7 kJ/mol
NaHCO3(s) +HCl(aq) = CO2(g) +NaCl(aq) + H2O(l) △ H = +31.4 kJ/mol
有的吸热反应也能自发进行
焓判据并不是判断反应自发进行的唯一标准
是什么因素“推动”了吸热反应自发进行?
【实验过程】开始时中间用玻璃片隔开,抽掉玻璃片,观察
【实验现象】盛放氯气的瓶内气体颜色逐渐变浅
而盛放氢气的瓶内显现出了浅黄绿色
最后两瓶中的颜色相同
【实验结论】不需要外界的任何作用
气体通过分子的扩散自发地混合均匀
演示实验
NH4+和NO3-在硝酸铵晶体中有序排列
被水分子包围的NH4+和NO3-在溶液中自由移动
溶解
硝酸铵溶于水的过程可以自发进行
体系自发地向混乱度增加(即有序向无序)方向转变
【思考】从混乱度的角度分析两个自发进行过程的相同点
硝酸铵溶解
气体扩散
S
熵
定义:描述体系混乱度的物理量。
符号:S 单位:J mol-1 K-1
物质存在状态:S(g)> S(l) > S(s)
微粒个数N : 微粒数越多,熵值越大
混乱度越大,熵值越大
工业生产
熵增现象:
日常生活
化学反应
1.香水味的扩散,饭香扑鼻
2.固体在液体中的溶解
1.矿石的粉碎
2.气态物质比固态物质反应速率大
金属钾的制备:Na(l)+KCl(l)=NaCl(l)+K(g)
Zn(s) + H2SO4(aq) = ZnSO4(aq) + H2(g)
2KClO3(s) = 2KCl(aq) + 3O2(g)
请判断下列反应中的熵变( △S )大小:
(1) Br2(l)
Br2(g)
牛刀小试
(3) CaCO3(s) == CaO(s) + CO2 (g)
(4) Ag+(aq) + Cl- (aq) == AgCl(s)
△S >0
△S<0
△S >0
△S<0
熵变: △S = ΣS(生成物)-ΣS(反应物)
(2) N2(g) + 3H2(g) 2 NH3 (g)
Ba(OH)2·8H2O (s) +2NH4Cl (s) =BaCl2 (s) +10H2O (l) +2NH3 (g)
△H>0
S
判词: △S>0 的反应有自发进行的倾向
熵判据
判案依据:主要看混乱度大小
当体系中混乱度增大, 计作△S >0,为熵增反应
当体系中混乱度减小, 计作△S<0,为熵减反应
熵判据也不是判断反应自发进行的唯一标准
S
判词: △S>0 的反应有自发进行的倾向
自发反应一定是熵增加的反应吗?
2NO(g) + 2CO(g) = N2(g) + 2CO2(g)
4Fe(OH)2(s) + O2(g) + 2H2O(l) = 4Fe(OH)3(s)
乙烯合成聚乙烯
有的熵减反应也能自发进行
H
△H
S
△S
= △H - T △S
自由能变化△G
△G 单位:kJ mol-1
复合判据
【资料卡片 】 自由能与化学反应的方向
在恒温、恒压下的封闭体系中(不考虑体积变化做功以外的其他功),自由能的变化综合反应了体系的焓变和熵变对自发过程的影响
吉布斯
判词: △G 0 的反应可以自发进行
△G 0 的反应不能自发进行
△G 0 的反应处于平衡状态
判词: △H<0 的反应有自发进行的倾向
判词: △S>0 的反应有自发进行的倾向
焓判据:
熵判据:
>
<
=
复合判据:
△G =△H T△S
Zn(s) + H2SO4(aq) = ZnSO4(aq) + H2(g)
【学以致用】如何综合焓变和熵变判断化学反应能否自发进行
△ H < 0,△ S > 0
任何温度下,△ G < 0,自发进行
△ G = △ H - T△ S
工业上利用石灰石制备二氧化碳
△ H > 0,△ S > 0
高温下,△ G < 0,自发进行
△ G = △ H - T△ S
CaCO3(s) = CaO(s) + CO2(g)
【学以致用】
2CO(g) = 2C(s) + O2(g)
汽车尾气中的一氧化碳和一氧化氮是现代化城市中的重要大气污染物。人们曾花费大量的时间和精力,通过实验的方法利用如下反应消除CO对环境的影响,然而却徒劳无功。你能从焓变和熵变的角度分析原因吗?
△ G > 0,不能自发进行
△ H > 0,△ S < 0
△ G = △ H - T△ S
【学以致用】
后来人们又提出通过如下反应来处理尾气的方法
2NO(g) + 2CO(g) = N2(g) + 2CO2(g)
已知:在 298 K、100 kPa,△ H = -746.8 kJ/mol
室温下,△ G < 0,反应能正向自发进行
△ H < 0,△ S < 0
△ G = △ H - T△ S
反应需要催化剂来加速
利用这个装置人们有效地将汽车尾气中的污染物NO和CO同时除去
△G = △H T △S
任何温度下均能自发
任何温度下都不自发
(第一象限)
△H>0
△S>0
△H<0
△S<0
(第三象限)
(第四象限)
△H>0
△S<0
(第二象限)
△H<0
△S>0
低温时,不自发
高温时,自发
低温时,自发
高温时,不自发
△H
△S
归纳提升
复合判据:
△G =
△H - T △S
化学反应进
行的方向
焓判据:
△H<0 的反应有
自发进行的倾向
熵判据:
△S>0 的反应有
自发进行的倾向
△G<0 反应自发进行
△G>0 反应不自发进行
△G=0 反应为平衡状态
等温等压条件下的封闭体系
从发现元素钛到冶炼出金属钛,为什么经历100多年?
原始反应:TiO2(s) + 2Cl2(g) = TiCl4 (l) + O2(g)
△ H = +161.9 kJ mol-1
引入反应:2C(s,石墨) + O2(g) = 2CO(g)
△ H = -221.04 kJ mol-1
综合反应:TiO2 (s) + 2Cl2(g) + 2C(s,石墨) =TiCl4(l) + 2CO(g)
△ H = -59.14 kJ mol-1 △ S = + 146 J K-1 mol-1
TiCl4+ 2Mg 2MgCl2 + Ti
△ H > 0,△ S < 0
△ G > 0,不能自发进行
△ H < 0,△ S > 0
△ G < 0,能自发进行
1070K
Ar
正确判断反应自发进行的方向对于生产实践具有重要的作用
反馈评价
练习:2019天津高考.10 节选
将SiCl4氢化为SiHCl3对应的反应依次为:
① SiCl4(g) + H2 (g) SiHCl3(g) + HCl(g)
△ H1 > 0
② 3SiCl4(g) + 2H2 (g) + Si(s) 4SiHCl3(g)
△ H2 < 0
已知体系自由能变△ G = △ H - T△ S,△ G < 0 时反应自发进行。二个氢化反应的△ G与温度的关系如图所示,反应①能自发进行的最低温度是 ;
1000 ℃
由△ H1 > 0,△ H2 < 0 推出△ H2 < △ H1 , 所以△ G2 < △ G1
相同温度下,反应②比反应①的△ G小,主要原因是 。
反馈评价
随堂检测
1. 下列不属于自发过程的是( )
A. 铁生锈 B. NaCl溶于水后的扩散
C. Zn与CuSO4溶液反应 D. 石墨转化为金刚石(吸热反应)
D
2.下列过程属于熵增加的是( )
A. 一定条件下,水由气态变成液态
B. Ag+(aq)+Cl-(aq)===AgCl(s)
C. 4NO2(g)+O2(g)===2N2O5(g)
D. 火柴盒中的火柴散落到地上
D
随堂检测
3. 下列说法正确的是( )
A. ΔH<0、ΔS>0的反应在温度低时不能自发进行
B. NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
B
随堂检测
△H = -78.03 kJ·mol-1
△H = +110.5 kJ·mol-1
(3)4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
△H = -444.3kJ·mol-1
△H = +178.2 kJ·mol-1
(4)CaCO3(s) = CaO(s)+CO2(g)
4.判断下列反应能否自发进行
(1) 2KClO3(s)==2KCl(s)+3O2(g)
(2) CO(g)==C(s,石墨)+1/2O2(g)
随堂检测
(1)△G<0的反应一定能发生。 ( )
(2)某反应能自发进行,则其反应速率一定较大 。 ( )
5.判断
×
×
S
H
2019人教版选择性必修一
第二章 化学反应速率和化学平衡
第三节 化学反应的方向
自发过程:在一定条件下,不借助外部力量就能自动
进行的过程,称为自发过程。
化学反应是否也能自发进行?
若能,如何判断化学反应自发进行的方向呢?
自然界中有一些过程是自发进行的,而且是有方向性的
自发反应:在一定条件下不需外界帮助就能自动
进行的反应,称为自发反应。
通电等
点燃,加热,高温,加压,催化剂等
请同学们列举出可以自发进行的化学反应:
铁生锈
天然气燃烧
铁和硫酸铜反应
放热
反应物
生成物
能量
反应过程
△H<0
放热反应的能量变化图:
反应物
Ea
△H
生成物
反应进程
能量
反应物
Ea
△H
生成物
反应进程
能量
Ea很小,常温即能自发
Ea稍大,但
Ea<△H,给予外界条件一经引发后即能自发
Ea稍大,且
Ea>△H,需持续给予外界条件才能自发
反应物
Ea
△H
生成物
反应进程
能量
理想状态
H
判案依据:主要看能量变化
判词: △H<0 的反应有自发进行的倾向
放出能量,体系能量减少,△H<0
吸收能量,体系能量增加,△H>0
焓判据
吸热反应
自发
焓
实验探究
探究Ba(OH)2·8H2O (s)与NH4Cl(s)是否反应?
化学反应吸热使烧杯与木片间的水凝结成冰
△H>0
N2O5(g) = 4NO2(g) + O2(g) △ H = +56.7 kJ/mol
NaHCO3(s) +HCl(aq) = CO2(g) +NaCl(aq) + H2O(l) △ H = +31.4 kJ/mol
有的吸热反应也能自发进行
焓判据并不是判断反应自发进行的唯一标准
是什么因素“推动”了吸热反应自发进行?
【实验过程】开始时中间用玻璃片隔开,抽掉玻璃片,观察
【实验现象】盛放氯气的瓶内气体颜色逐渐变浅
而盛放氢气的瓶内显现出了浅黄绿色
最后两瓶中的颜色相同
【实验结论】不需要外界的任何作用
气体通过分子的扩散自发地混合均匀
演示实验
NH4+和NO3-在硝酸铵晶体中有序排列
被水分子包围的NH4+和NO3-在溶液中自由移动
溶解
硝酸铵溶于水的过程可以自发进行
体系自发地向混乱度增加(即有序向无序)方向转变
【思考】从混乱度的角度分析两个自发进行过程的相同点
硝酸铵溶解
气体扩散
S
熵
定义:描述体系混乱度的物理量。
符号:S 单位:J mol-1 K-1
物质存在状态:S(g)> S(l) > S(s)
微粒个数N : 微粒数越多,熵值越大
混乱度越大,熵值越大
工业生产
熵增现象:
日常生活
化学反应
1.香水味的扩散,饭香扑鼻
2.固体在液体中的溶解
1.矿石的粉碎
2.气态物质比固态物质反应速率大
金属钾的制备:Na(l)+KCl(l)=NaCl(l)+K(g)
Zn(s) + H2SO4(aq) = ZnSO4(aq) + H2(g)
2KClO3(s) = 2KCl(aq) + 3O2(g)
请判断下列反应中的熵变( △S )大小:
(1) Br2(l)
Br2(g)
牛刀小试
(3) CaCO3(s) == CaO(s) + CO2 (g)
(4) Ag+(aq) + Cl- (aq) == AgCl(s)
△S >0
△S<0
△S >0
△S<0
熵变: △S = ΣS(生成物)-ΣS(反应物)
(2) N2(g) + 3H2(g) 2 NH3 (g)
Ba(OH)2·8H2O (s) +2NH4Cl (s) =BaCl2 (s) +10H2O (l) +2NH3 (g)
△H>0
S
判词: △S>0 的反应有自发进行的倾向
熵判据
判案依据:主要看混乱度大小
当体系中混乱度增大, 计作△S >0,为熵增反应
当体系中混乱度减小, 计作△S<0,为熵减反应
熵判据也不是判断反应自发进行的唯一标准
S
判词: △S>0 的反应有自发进行的倾向
自发反应一定是熵增加的反应吗?
2NO(g) + 2CO(g) = N2(g) + 2CO2(g)
4Fe(OH)2(s) + O2(g) + 2H2O(l) = 4Fe(OH)3(s)
乙烯合成聚乙烯
有的熵减反应也能自发进行
H
△H
S
△S
= △H - T △S
自由能变化△G
△G 单位:kJ mol-1
复合判据
【资料卡片 】 自由能与化学反应的方向
在恒温、恒压下的封闭体系中(不考虑体积变化做功以外的其他功),自由能的变化综合反应了体系的焓变和熵变对自发过程的影响
吉布斯
判词: △G 0 的反应可以自发进行
△G 0 的反应不能自发进行
△G 0 的反应处于平衡状态
判词: △H<0 的反应有自发进行的倾向
判词: △S>0 的反应有自发进行的倾向
焓判据:
熵判据:
>
<
=
复合判据:
△G =△H T△S
Zn(s) + H2SO4(aq) = ZnSO4(aq) + H2(g)
【学以致用】如何综合焓变和熵变判断化学反应能否自发进行
△ H < 0,△ S > 0
任何温度下,△ G < 0,自发进行
△ G = △ H - T△ S
工业上利用石灰石制备二氧化碳
△ H > 0,△ S > 0
高温下,△ G < 0,自发进行
△ G = △ H - T△ S
CaCO3(s) = CaO(s) + CO2(g)
【学以致用】
2CO(g) = 2C(s) + O2(g)
汽车尾气中的一氧化碳和一氧化氮是现代化城市中的重要大气污染物。人们曾花费大量的时间和精力,通过实验的方法利用如下反应消除CO对环境的影响,然而却徒劳无功。你能从焓变和熵变的角度分析原因吗?
△ G > 0,不能自发进行
△ H > 0,△ S < 0
△ G = △ H - T△ S
【学以致用】
后来人们又提出通过如下反应来处理尾气的方法
2NO(g) + 2CO(g) = N2(g) + 2CO2(g)
已知:在 298 K、100 kPa,△ H = -746.8 kJ/mol
室温下,△ G < 0,反应能正向自发进行
△ H < 0,△ S < 0
△ G = △ H - T△ S
反应需要催化剂来加速
利用这个装置人们有效地将汽车尾气中的污染物NO和CO同时除去
△G = △H T △S
任何温度下均能自发
任何温度下都不自发
(第一象限)
△H>0
△S>0
△H<0
△S<0
(第三象限)
(第四象限)
△H>0
△S<0
(第二象限)
△H<0
△S>0
低温时,不自发
高温时,自发
低温时,自发
高温时,不自发
△H
△S
归纳提升
复合判据:
△G =
△H - T △S
化学反应进
行的方向
焓判据:
△H<0 的反应有
自发进行的倾向
熵判据:
△S>0 的反应有
自发进行的倾向
△G<0 反应自发进行
△G>0 反应不自发进行
△G=0 反应为平衡状态
等温等压条件下的封闭体系
从发现元素钛到冶炼出金属钛,为什么经历100多年?
原始反应:TiO2(s) + 2Cl2(g) = TiCl4 (l) + O2(g)
△ H = +161.9 kJ mol-1
引入反应:2C(s,石墨) + O2(g) = 2CO(g)
△ H = -221.04 kJ mol-1
综合反应:TiO2 (s) + 2Cl2(g) + 2C(s,石墨) =TiCl4(l) + 2CO(g)
△ H = -59.14 kJ mol-1 △ S = + 146 J K-1 mol-1
TiCl4+ 2Mg 2MgCl2 + Ti
△ H > 0,△ S < 0
△ G > 0,不能自发进行
△ H < 0,△ S > 0
△ G < 0,能自发进行
1070K
Ar
正确判断反应自发进行的方向对于生产实践具有重要的作用
反馈评价
练习:2019天津高考.10 节选
将SiCl4氢化为SiHCl3对应的反应依次为:
① SiCl4(g) + H2 (g) SiHCl3(g) + HCl(g)
△ H1 > 0
② 3SiCl4(g) + 2H2 (g) + Si(s) 4SiHCl3(g)
△ H2 < 0
已知体系自由能变△ G = △ H - T△ S,△ G < 0 时反应自发进行。二个氢化反应的△ G与温度的关系如图所示,反应①能自发进行的最低温度是 ;
1000 ℃
由△ H1 > 0,△ H2 < 0 推出△ H2 < △ H1 , 所以△ G2 < △ G1
相同温度下,反应②比反应①的△ G小,主要原因是 。
反馈评价
随堂检测
1. 下列不属于自发过程的是( )
A. 铁生锈 B. NaCl溶于水后的扩散
C. Zn与CuSO4溶液反应 D. 石墨转化为金刚石(吸热反应)
D
2.下列过程属于熵增加的是( )
A. 一定条件下,水由气态变成液态
B. Ag+(aq)+Cl-(aq)===AgCl(s)
C. 4NO2(g)+O2(g)===2N2O5(g)
D. 火柴盒中的火柴散落到地上
D
随堂检测
3. 下列说法正确的是( )
A. ΔH<0、ΔS>0的反应在温度低时不能自发进行
B. NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
B
随堂检测
△H = -78.03 kJ·mol-1
△H = +110.5 kJ·mol-1
(3)4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
△H = -444.3kJ·mol-1
△H = +178.2 kJ·mol-1
(4)CaCO3(s) = CaO(s)+CO2(g)
4.判断下列反应能否自发进行
(1) 2KClO3(s)==2KCl(s)+3O2(g)
(2) CO(g)==C(s,石墨)+1/2O2(g)
随堂检测
(1)△G<0的反应一定能发生。 ( )
(2)某反应能自发进行,则其反应速率一定较大 。 ( )
5.判断
×
×
