人教版选择性必修一 2.2.4化学平衡图像 课件24张
文档属性
| 名称 | 人教版选择性必修一 2.2.4化学平衡图像 课件24张 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-27 15:01:01 | ||
图片预览


文档简介
(共21张PPT)
第二节 化学平衡
第四课时
勒夏特列原理及平衡图像
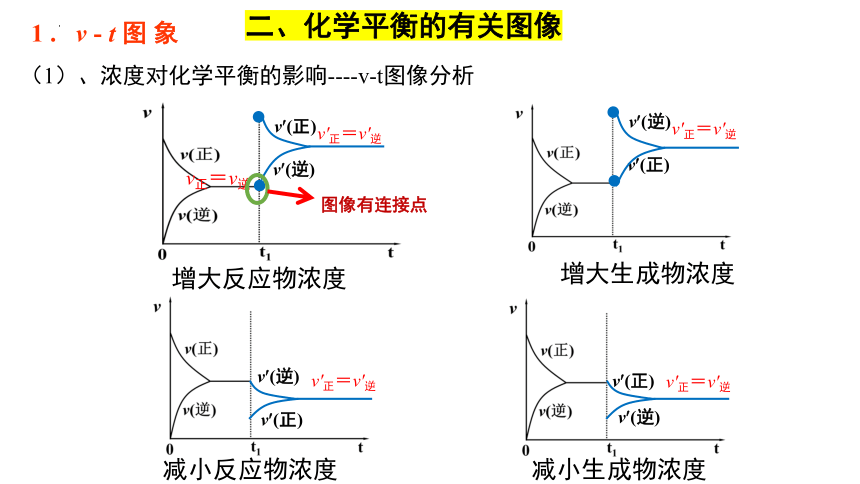
1. v-t图象
(1)、浓度对化学平衡的影响----v-t图像分析
增大反应物浓度
v (正)
v (逆)
增大生成物浓度
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
减小反应物浓度
减小生成物浓度
v (逆)
v (正)
v (逆)
v (正)
v'正=v'逆
v'正=v'逆
图像有连接点
二、化学平衡的有关图像
由以上四图可以得出结论
②增大浓度,新平衡状态下的反应速率一定大于原平衡状态;
减小浓度,新平衡状态下的反应速率一定小于原平衡状态。
①浓度对化学平衡的影响,其速率--时间图像连续。
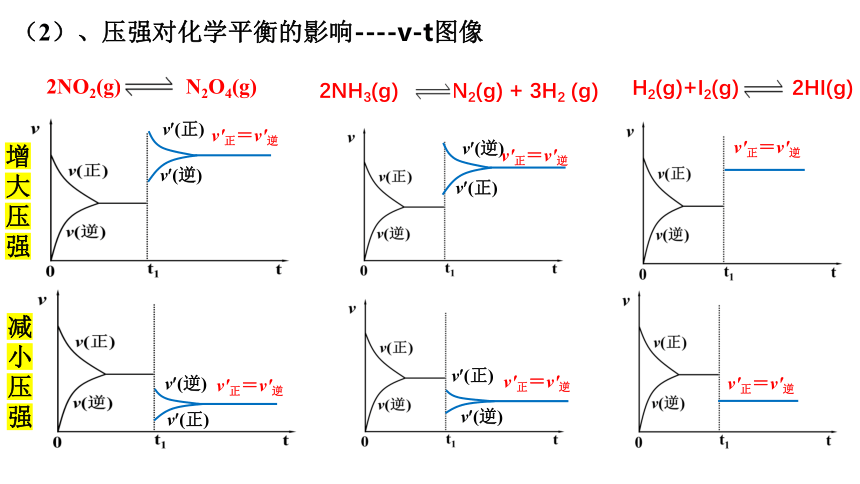
(2)、压强对化学平衡的影响----v-t图像
v (正)
v (逆)
v'正=v'逆
v (逆)
v (正)
v'正=v'逆
v'正=v'逆
增大压强
v'正=v'逆
v (正)
v (逆)
v'正=v'逆
v (逆)
v (正)
v'正=v'逆
减小压强
2NO2(g) N2O4(g)
2NH3(g) N2(g) + 3H2 (g)
H2(g)+I2(g) 2HI(g)
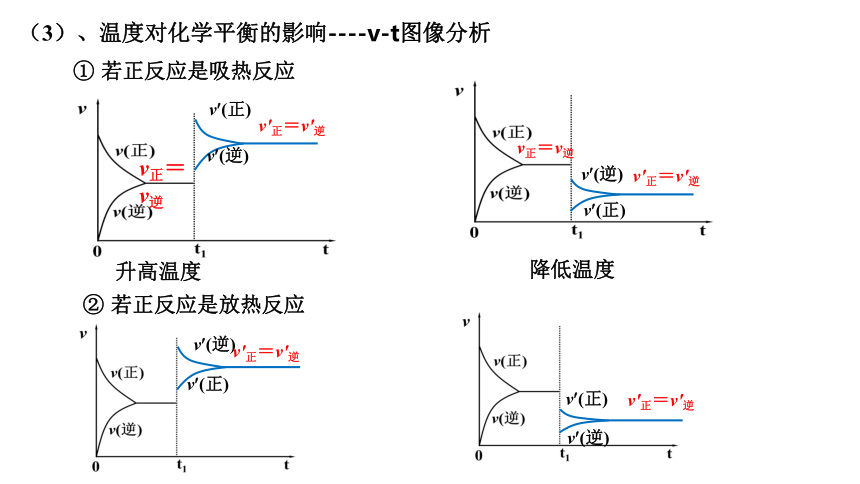
(3)、温度对化学平衡的影响----v-t图像分析
v (正)
v (逆)
v'正=v'逆
v正=v逆
升高温度
① 若正反应是吸热反应
降低温度
v (正)
v (逆)
v'正=v'逆
v正=v逆
② 若正反应是放热反应
v (逆)
v (正)
v'正=v'逆
v (逆)
v (正)
v'正=v'逆
解题方法:
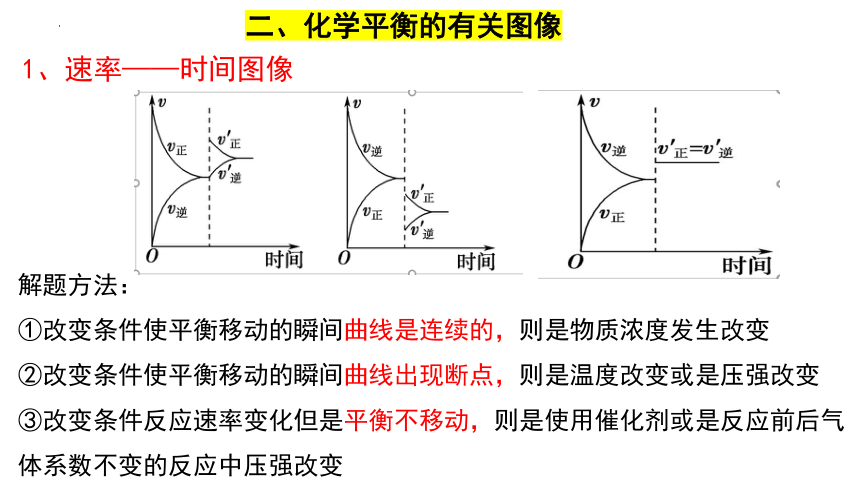
①改变条件使平衡移动的瞬间曲线是连续的,则是物质浓度发生改变
②改变条件使平衡移动的瞬间曲线出现断点,则是温度改变或是压强改变
③改变条件反应速率变化但是平衡不移动,则是使用催化剂或是反应前后气体系数不变的反应中压强改变
1、速率——时间图像
二、化学平衡的有关图像
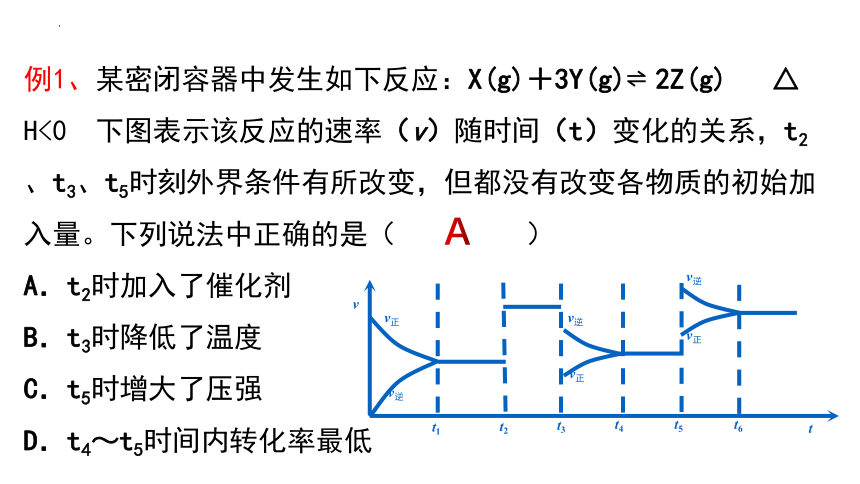
例1、某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) △ H<0 下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.t4~t5时间内转化率最低
t
t1
v正
v逆
v正
v逆
v
t2
t3
v正
v逆
t4
t5
t6
A
二、化学平衡的有关图像
2、转化率(或百分含量)-时间-温度(或压强)图:
二、化学平衡的有关图像
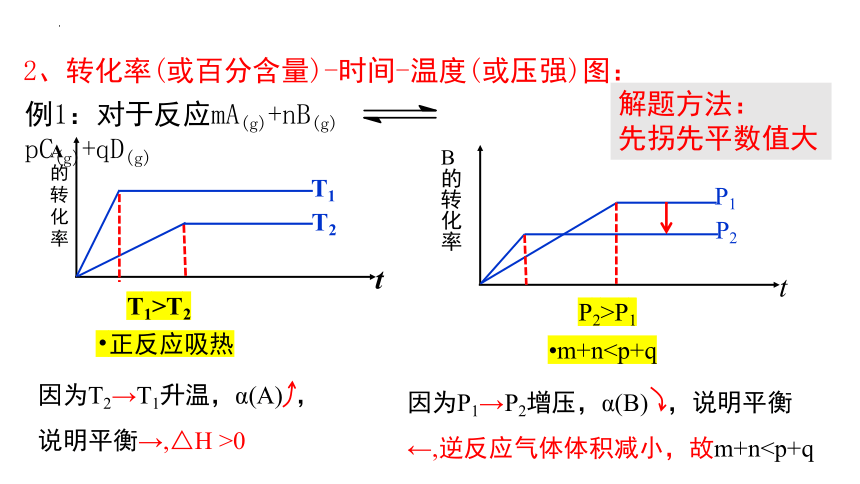
例1:对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A
的转化率
T1
T2
正反应吸热
T1>T2
因为T2→T1升温,α(A) ,
说明平衡→,△H >0
t
B
的转化率
P1
P2
m+nP2>P1
因为P1→P2增压,α(B) ,说明平衡←,逆反应气体体积减小,故m+n解题方法:
先拐先平数值大
t
T1
T2
A%
C%
t
P1
P2
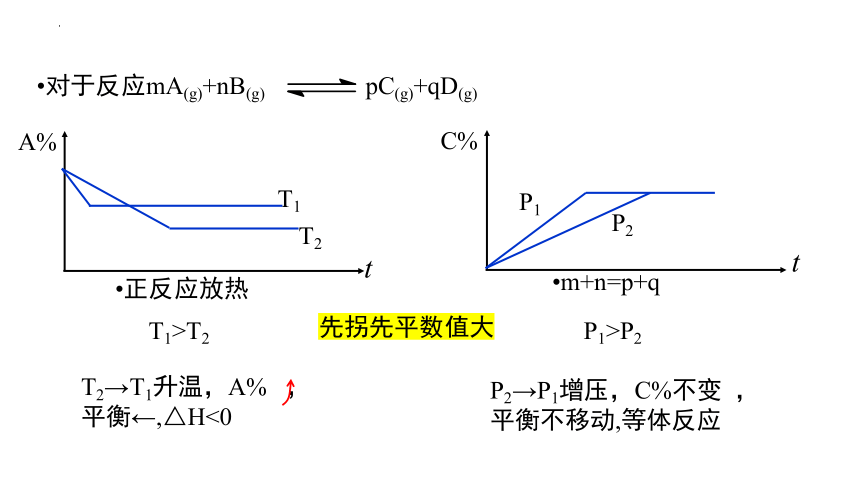
对于反应mA(g)+nB(g) pC(g)+qD(g)
T2→T1升温,A% ,
平衡←,△H<0
T1>T2
P1>P2
P2→P1增压,C%不变 ,
平衡不移动,等体反应
正反应放热
m+n=p+q
先拐先平数值大
解题策略:
①看纵坐标含义:反应物的转化率:数值越大 说明转化的越多生成物的体积分数(或物质的量分数):数值越大,说明生成物的物质的量越大。
②看拐点:口诀:先拐先平数值大(温度高/压强大/使用催化剂)
③看特殊点:平衡点对应的纵坐标利用勒夏特列原理分析吸/放热,前后气体系数关系等
小结:转化率(或百分含量)-时间-温度(或压强)图:
二、化学平衡的有关图像
例2:对于反应mA (g) + nB (g) pC (g)+qD(g)有如图所示的关系,则:
⑴、P1 ____ P2 ;T1 ____ T2 ;
⑵、m+n ______ p+q ;
⑶、正反应为_________ 反应
<
>
吸热
定一议二
t
B%
T2P2
T1P2
T1P1
P2>P1
T1>T2
因为T1时,P1→P2增大压强,B%增大,平衡左移,逆反应是缩体反应,故m+n因为P2时,T2→T1升高温度,B%减小,平衡右移,故正反应是吸热反应
解题方法:
先拐先平数值大
<
3、百分含量(或转化率)—压强或温度图像
二、化学平衡的有关图像
例1:对于反应mA(g)+nB(g) pC(g)+qD(g)
P
C%
200℃
500℃
T
A的转化率
1.01×105Pa
1.01×106Pa
1.01×107Pa
正反应放热 m+n看线(如:线的走势)
正反应吸热 m+n>p+q
正反应吸热m+n=p+q
小结:百分含量(或转化率)—压强或温度图像
解题策略:
涉及两个外界因素(P/T)对化学平衡的影响,因此需要“定一议二”即控制变量法。
①分析任意一条坐标系中任意一条曲线横坐标变量对纵坐标的影响。
②做一个“等温线”或者“恒压线”辅助线,再用勒夏特列原理进行分析。
二、化学平衡的有关图像
T
C%
450℃
T
v
v逆
v正
T1
T2
正反应吸热
T
v
v正
v逆
正反应吸热
正反应放热
P
A%
P1
m+n对于反应mA(g)+nB(g) pC(g)+qD(g)
温度由T1升到T2,v正>v逆,平衡右移,正反应吸热
温度升高,v正>v逆,平衡右移,正反应吸热
平衡点
平衡点
温度升高,C%减小,平衡左移,逆反应吸热
平衡点
压强增加,A%增加,平衡左移,逆反应缩体
4、其他特殊的图像
4、其他图像
【要点总结】
①看图像:
一看面(即纵坐标与横坐标的意义)
二看线(即线的走向和变化趋势)
三看点(即起点、折点、交点、终点)
四看辅助线(如等温线、等压线、平衡线等)
五看量的变化(如浓度变化、温度变化等)
②想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
③作判断:根据图像中表现的关系与所学规律相对比,作出符合判断。
课堂小结
影响化学平衡的因素
浓度
压强
温度
勒夏特列原理
平衡图像
理论理解
图像分析
1.对于可逆反应mA(g)+nB(g) qC(g) ΔH=Q kJ·mol-1
(1)根据图①回答问题:①m+n___q(填“>”“<”或“=”,下同);
②若Q>0,则T1_____T2;
③若T1<T2,则Q____0。
<
>
<
【课堂练习】
【课堂练习】
D
B
B
B
第二节 化学平衡
第四课时
勒夏特列原理及平衡图像
1. v-t图象
(1)、浓度对化学平衡的影响----v-t图像分析
增大反应物浓度
v (正)
v (逆)
增大生成物浓度
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
减小反应物浓度
减小生成物浓度
v (逆)
v (正)
v (逆)
v (正)
v'正=v'逆
v'正=v'逆
图像有连接点
二、化学平衡的有关图像
由以上四图可以得出结论
②增大浓度,新平衡状态下的反应速率一定大于原平衡状态;
减小浓度,新平衡状态下的反应速率一定小于原平衡状态。
①浓度对化学平衡的影响,其速率--时间图像连续。
(2)、压强对化学平衡的影响----v-t图像
v (正)
v (逆)
v'正=v'逆
v (逆)
v (正)
v'正=v'逆
v'正=v'逆
增大压强
v'正=v'逆
v (正)
v (逆)
v'正=v'逆
v (逆)
v (正)
v'正=v'逆
减小压强
2NO2(g) N2O4(g)
2NH3(g) N2(g) + 3H2 (g)
H2(g)+I2(g) 2HI(g)
(3)、温度对化学平衡的影响----v-t图像分析
v (正)
v (逆)
v'正=v'逆
v正=v逆
升高温度
① 若正反应是吸热反应
降低温度
v (正)
v (逆)
v'正=v'逆
v正=v逆
② 若正反应是放热反应
v (逆)
v (正)
v'正=v'逆
v (逆)
v (正)
v'正=v'逆
解题方法:
①改变条件使平衡移动的瞬间曲线是连续的,则是物质浓度发生改变
②改变条件使平衡移动的瞬间曲线出现断点,则是温度改变或是压强改变
③改变条件反应速率变化但是平衡不移动,则是使用催化剂或是反应前后气体系数不变的反应中压强改变
1、速率——时间图像
二、化学平衡的有关图像
例1、某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) △ H<0 下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.t4~t5时间内转化率最低
t
t1
v正
v逆
v正
v逆
v
t2
t3
v正
v逆
t4
t5
t6
A
二、化学平衡的有关图像
2、转化率(或百分含量)-时间-温度(或压强)图:
二、化学平衡的有关图像
例1:对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A
的转化率
T1
T2
正反应吸热
T1>T2
因为T2→T1升温,α(A) ,
说明平衡→,△H >0
t
B
的转化率
P1
P2
m+n
因为P1→P2增压,α(B) ,说明平衡←,逆反应气体体积减小,故m+n
先拐先平数值大
t
T1
T2
A%
C%
t
P1
P2
对于反应mA(g)+nB(g) pC(g)+qD(g)
T2→T1升温,A% ,
平衡←,△H<0
T1>T2
P1>P2
P2→P1增压,C%不变 ,
平衡不移动,等体反应
正反应放热
m+n=p+q
先拐先平数值大
解题策略:
①看纵坐标含义:反应物的转化率:数值越大 说明转化的越多生成物的体积分数(或物质的量分数):数值越大,说明生成物的物质的量越大。
②看拐点:口诀:先拐先平数值大(温度高/压强大/使用催化剂)
③看特殊点:平衡点对应的纵坐标利用勒夏特列原理分析吸/放热,前后气体系数关系等
小结:转化率(或百分含量)-时间-温度(或压强)图:
二、化学平衡的有关图像
例2:对于反应mA (g) + nB (g) pC (g)+qD(g)有如图所示的关系,则:
⑴、P1 ____ P2 ;T1 ____ T2 ;
⑵、m+n ______ p+q ;
⑶、正反应为_________ 反应
<
>
吸热
定一议二
t
B%
T2P2
T1P2
T1P1
P2>P1
T1>T2
因为T1时,P1→P2增大压强,B%增大,平衡左移,逆反应是缩体反应,故m+n
解题方法:
先拐先平数值大
<
3、百分含量(或转化率)—压强或温度图像
二、化学平衡的有关图像
例1:对于反应mA(g)+nB(g) pC(g)+qD(g)
P
C%
200℃
500℃
T
A的转化率
1.01×105Pa
1.01×106Pa
1.01×107Pa
正反应放热 m+n
正反应吸热 m+n>p+q
正反应吸热m+n=p+q
小结:百分含量(或转化率)—压强或温度图像
解题策略:
涉及两个外界因素(P/T)对化学平衡的影响,因此需要“定一议二”即控制变量法。
①分析任意一条坐标系中任意一条曲线横坐标变量对纵坐标的影响。
②做一个“等温线”或者“恒压线”辅助线,再用勒夏特列原理进行分析。
二、化学平衡的有关图像
T
C%
450℃
T
v
v逆
v正
T1
T2
正反应吸热
T
v
v正
v逆
正反应吸热
正反应放热
P
A%
P1
m+n
温度由T1升到T2,v正>v逆,平衡右移,正反应吸热
温度升高,v正>v逆,平衡右移,正反应吸热
平衡点
平衡点
温度升高,C%减小,平衡左移,逆反应吸热
平衡点
压强增加,A%增加,平衡左移,逆反应缩体
4、其他特殊的图像
4、其他图像
【要点总结】
①看图像:
一看面(即纵坐标与横坐标的意义)
二看线(即线的走向和变化趋势)
三看点(即起点、折点、交点、终点)
四看辅助线(如等温线、等压线、平衡线等)
五看量的变化(如浓度变化、温度变化等)
②想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
③作判断:根据图像中表现的关系与所学规律相对比,作出符合判断。
课堂小结
影响化学平衡的因素
浓度
压强
温度
勒夏特列原理
平衡图像
理论理解
图像分析
1.对于可逆反应mA(g)+nB(g) qC(g) ΔH=Q kJ·mol-1
(1)根据图①回答问题:①m+n___q(填“>”“<”或“=”,下同);
②若Q>0,则T1_____T2;
③若T1<T2,则Q____0。
<
>
<
【课堂练习】
【课堂练习】
D
B
B
B
