人教版选择性必修一 化学平衡-等效平衡 课件30张
文档属性
| 名称 | 人教版选择性必修一 化学平衡-等效平衡 课件30张 |  | |
| 格式 | pptx | ||
| 文件大小 | 890.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-27 14:50:58 | ||
图片预览








文档简介
(共30张PPT)
第二章 化学反应速率和化学平衡
第二节 化学平衡
2.2.4 等效平衡
人教版化学选择性必修1
2SO2+ O2 2SO3
起始C(mol/L) 2 1 0
平衡C(mol/L) 0.8 0.4 1.2
2SO2+ O2 2SO3
0 0 2
0.8 0.4 1.2
以上两个平衡,有什么异同?化学平衡的建立与什么有关?
【结论】
1.化学平衡状态的建立与条件(如浓度、温度、压强)有关,与途径无关,
①正向建立 ③从中间某状态建立
②逆向建立 ④分批加入反应物等
上面两个平衡有什么关系呢?
2.建立平衡状态有4条途径:
等效平衡
等效平衡
一定条件(温度体积一定或温度压强一定)下的同一可逆反应,只是起始加入物质的情况不同,达到平衡后,任何相同组分的分数(体积分数、物质的量分数、质量分数等)均相同,这样的化学平衡互称为等效平衡。
1、等效平衡的含义:
反应混合物中各组分的质量分数、体积分数、物质的量分数均相同
2、等效平衡的标志:
CO2
CO
0.006mol
H2O
0.006mol
0.004mol
0.004mol
H2
1L
1L
CO
0.01mol
H2O
0.01mol
A
1L
CO2
0.01mol
H2
0.01mol
B
1L
C
CO 0.005mol
H2O 0.005mol
CO2 0.005mol
H2 0.005mol
CO+H2O(g) CO2+H2
催化剂
恒温恒容条件下
CO2
CO
0.006mol
H2O
0.006mol
0.004mol
0.004mol
H2
1L
CO2
CO
0.006mol
H2O
0.006mol
0.004mol
0.004mol
H2
1L
H2 (g)+I2 (g) 2HI(g)
起始①
H2 1 mol
I2 2 mol
HI 0 mol
H2 0.5 mol
I2 1.5 mol
HI 1 mol
平衡状态①
起始②
H2 2mol
I2 4 mol
HI 0mol
恒温恒容条件下
H2 1 mol
I2 3 mol
HI 2 mol
平衡状态②
起始③
H2 0mol
I2 2 mol
HI 4mol
H2 1 mol
I2 3 mol
HI 2 mol
平衡状态③
等效平衡
任何状态的体系,都用“极端状态”来比较,通过可逆反应的化学计量数换算成同一边物质
3、等效平衡的判断方法:
(1)定温(T)、定容(V)
(2)定温(T)、定压(p)
4、等效平衡的分类:
1.恒温恒容条件下等效平衡的条件
(1)、反应前后气体分子数不变的可逆反应
恒温恒容下,H2 (g)+I2 (g) 2HI(g)
途径1起始 2 mol 1mol 0
途径2起始 1mol 0 1mol
途径3起始 4mol 2mol 0
途径4起始 3mol 1mol 2mol
途径2、3、4与途径1等效吗?
3、4与1等效
1.恒温恒容条件下等效平衡的条件
(1)、反应前后气体分子数不变的可逆反应
2molH2 1molI2
500℃
2molH2 1molI2
1L
1L
恒温恒容下,H2 (g)+I2 (g) 2HI(g)
途径1起始 2 mol 1mol 0
途径3起始 4mol 2mol 0
2molH2
1molI2
1
500℃ 1L
2molH2 1molI2
2molH2 1molI2
4molH2
2molI2
3
500℃ 1L
2
平衡不移动
加压
等效
1.恒温恒容条件下等效平衡的条件
(1)、反应前后气体分子数不变的可逆反应
只要通过可逆反应的化学计量数换算成同一边物质的物质的量之比与原平衡起始加入量相同,则二平衡等效。
一边倒后比相同则等效
在固定体积的密闭容器内,加入2mol A、1mol B,发生反应:A(气)+B(气) 2C(气)达到平衡时,C的质量分数为W。在相同(T、V)条件下,按下列情况充入物质达到平衡时C的质量分数仍为W的是
A. 2mol C
B. 3mol C
C. 4mol A、2mol B
D. 1mol A、2mol C
CD
练习1
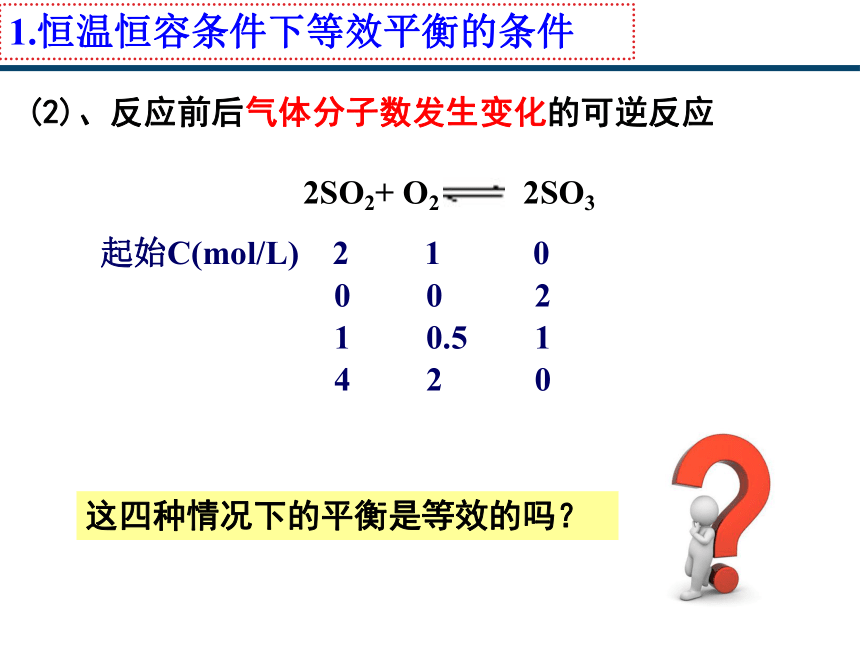
1.恒温恒容条件下等效平衡的条件
(2)、反应前后气体分子数发生变化的可逆反应
起始C(mol/L) 2 1 0
0 0 2
1 0.5 1
4 2 0
2SO2+ O2 2SO3
这四种情况下的平衡是等效的吗?
1.恒温恒容条件下等效平衡的条件
(2)、反应前后气体分子数发生变化的可逆反应
2SO2 + O2
2SO3
2mol SO2 1mol O2
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
SO2 a%
O2 b%
SO3 c%
平衡状态
2mol SO3
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
相当于开始加入1molSO2、0.5molO2和1molSO3
1.恒温恒容条件下等效平衡的条件
(2)、反应前后气体分子数发生变化的可逆反应
起始(mol): 2 1 0
平衡时(mol): x y z
平衡时体积分数: a% b% c%
2SO2 + O2
2SO3
2mol SO2
1mol O2
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
若起始(mol) :4 2 0
2mol SO2
1mol O2
2mol SO2
1mol O2
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
加压
(此为放缩法)
4mol SO2
2mol O2
开始
SO2O2 SO3 >c%
平衡状态
1.恒温恒容条件下等效平衡的条件
(2)、反应前后气体分子数发生变化的可逆反应
相同物质的起始物质的量相等
把不同的起始状态,通过化学方程式中的计量数,换算成同一边物质(反应物一边或生成物一边),如果各反应物或生成物的_______________相等,则是等效平衡。
处理方法
物质的量
一边倒后,量相同才等效
有一个固定体积的密闭容器中,加入2molA和1molB发生反应,2A(g) + B(g) 3C(g) + D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是( )
A.4mol A + 2mol B
B.2mol A + 1mol B + 3mol C + 1mol D
C.3mol C + 1mol D +1mol B
D.3mol C + 1mol D
E、1molA+0.5molB+1.5molC+0.5molD
DE
练习2
恒温恒容
2.恒温恒压条件下等效平衡的条件
恒温恒容 2SO2(g)+O2(g) 2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 4 mol 2 mol 0
压
途径1和2是否为等效平衡?
恒温恒容下 不等效
恒温恒压下 等效
2.恒温恒压条件下等效平衡的条件
2SO2 + O2
2SO3
起始(mol) : 2 1 0
平衡(mol) : x y z
平衡时体积分数: a% b% c%
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
2mol SO2
1mol O2
若起始(mol): 4 2 0
2mol SO2
1mol O2
2mol SO2
1mol O2
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
4mol SO2
2mol O2
SO2 a%
O2 b%
SO3 c%
2.恒温恒压条件下等效平衡的条件
换算成平衡式同一边物质的物质的量与原平衡比例相同,则达平衡后与原平衡等效。
恒温恒压 :H2(g)+ I2(g) 2HI(g)
途径1起始 2 mol 1mol 0
途径2起始 4mol 2mol 0
途径1和2为等效平衡
在一定温度下保持压强相等的密闭容器中,充入1molA、2molB发生A+B 2C+D,达到平衡时A的含量为w,下列物质组合充入该容器中,A的含量仍为w的是( )
BD
练习3
A. 2mol C+1mol D
B. 1mol B+2mol C+1mol D
C. 1mol A+1mol B
D. 1mol A+4mol B+4mol C+2mol D
恒温恒压
随堂检测
1.在一恒容的容器中充入2 mol A和1 mol B,发生反应2 A(g) + B(g) x C(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6 mol,B为0.3 mol,C为1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为 ( )
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
C
2、将amolPCl5充入一个容积恒为VL的密闭容器中,发生如下反应:PCl5(g) PCl3(g) + Cl2(g) ,在t℃的温度下反应达到化学平衡,此时容器内气体压强为P1,保持温度不变,再向该容器中充入amolPCl5再达到化学平衡时,容器内气体压强为P2,则P1和P2的大小关系是 ( )
A、2P1﹥P2 B、2P1=P2
C、2P1﹤P2 D、P1=P2
随堂检测
A
小结
I类:对于一般的可逆反应,通过化学计量数比换算成同一边物质的物质的量与原平衡相同,则两平衡等效(等同)。
等效平衡的分类
Ⅱ类:m+n=p+q,通过化学计量数比换算成同一边物质的物质的量的比例与原平衡相同,则两平衡等效。
(2)定T、定p下
(1)定温(T)、定容(V)
mA(气)+nB(气) pC(气)+qD(气)
Ⅲ类:换算成平衡式同一边物质的物质的量与原平衡比例相同,则达平衡后与原平衡等效。
小结
等效平衡的分类
mA(气)+nB(气) pC(气)+qD(气)
条件 等效条件 结果
恒温恒容 (△n(g)≠0)
恒温恒容 (△n(g)=0)
恒温恒压
全等平衡
相似平衡
相似平衡
两次平衡时各组分百分量、n、c均相同
两次平衡时各组分百分量
相同,n、c同比例变化
两次平衡时各组分百分量、c相同,n同比例变化
投料换算成相同物质表示时量相同
投料换算成相
同物质表示时
等比例
投料换算成相
同物质表示时
等比例
补充
【例1】恒温恒容容器中建立如下平衡2NO2 N2O4,
达到平衡后,若再向容器中充入2 mol NO2,
平衡移动方向?重新达到平衡后NO2的转化率?
变式: 恒温恒容容器中建立如下平衡:
2SO3 2SO2 +O2 ,达到平衡后,若再向
容器中充入一定量SO3,平衡移动方向?
重新达到平衡后,SO3的转化率?
向右(正向)
增大
减小
(正向)
补充
变式: 恒温恒容容器中建立如下平衡:
2SO2 +O2 2 SO3, 达到平衡后,若再向
容器中充入一定量SO3,平衡移动方向?
重新达到平衡后,SO3的质量分数?
增大
(逆向)
补充
【例2】恒温恒容时1molN2、3molH2在密闭容
器中反应达到平衡状态,此时压强为P1;
若再充入2mol NH3 。
a、平衡如何移动?
b、重新平衡后总压强为P2, 则P1 和P2的关系?
逆向
P1< P2 < 2P1
典型例题
例1、t0C在VL密闭容器中加入vmolN2和3vmol H2,当反应N2+3H2 2NH3达平衡时,混合气体中N2、H2、NH3分别为A、B、Cmol,仍在t0C,若只改变起始物的加入量,但要维持A、B、C值不变,则在N2、H2、NH3的加入量用X、Y、Z表示,应满足的条件是
若X=0,Y=0,则Z=_______
若X=0.75vmol,则Y= Z=________
X、Y、Z应满足的一般条件,用X、Y、Z的方程式表示式是
______________________、________________。
2vmol
2.25vmol
0.5vmol
2x+z=2v
Y+ Z=3V
典型例题
例2、在一个盛有催化剂的体积可变的密闭容器内,保持一定的温度和压强不变,发生以下反应:N2 + 3H2 2NH3 。已知加入1mol N2 和4mol H2 时,达到平衡状态生成amol NH3 。在相同温度和压强下,且保持平衡时的各物质的百分含量相同,则填写下列空白:
编号 起始状态(mol) 平衡时NH3物质的量(mol)
N2 H2 NH3 已知 1 4 0 a
① 1.5 6 0
② 1 0.5a
③ m n(n≥4m)
1.5a
0
0.5
2(n-4m)
(n-3m)a
典型例题
例3、在温度和容积相同的三个密闭容器中,发生反应
2 SO2(g)+O2(g) 2 SO3(g) △H=-196 kJ/mol。起始投入反应物和平衡时测得的有关数据如下表:
容器 投料量 转化率 c(SO3) 能量变化 O2体积分数
甲 2 mol SO2和1 mol O2 α1 c1 放出Q1kJ热量 V1%
乙 2mol SO3 α2 c2 吸收Q2kJ热量 V2%
丙 4 mol SO2和2 mol O2 α3 c3 放出Q3kJ热量 V3%
请判断(用“>”、“<”或“=”填空)
(1)Q1+Q2 196 (2) 2Q1 Q3 (3) c1 c2 (4) 2c1 c3 (5) α1 α3 (6)α1+α2 1 (7) α2 +α3 1 (8) V1% V2% (9) V1% V3%
(10)达到平衡的时间:t甲 t丙。
(11)甲、乙、丙三个容器中,平衡常数的关系为 。
第二章 化学反应速率和化学平衡
第二节 化学平衡
2.2.4 等效平衡
人教版化学选择性必修1
2SO2+ O2 2SO3
起始C(mol/L) 2 1 0
平衡C(mol/L) 0.8 0.4 1.2
2SO2+ O2 2SO3
0 0 2
0.8 0.4 1.2
以上两个平衡,有什么异同?化学平衡的建立与什么有关?
【结论】
1.化学平衡状态的建立与条件(如浓度、温度、压强)有关,与途径无关,
①正向建立 ③从中间某状态建立
②逆向建立 ④分批加入反应物等
上面两个平衡有什么关系呢?
2.建立平衡状态有4条途径:
等效平衡
等效平衡
一定条件(温度体积一定或温度压强一定)下的同一可逆反应,只是起始加入物质的情况不同,达到平衡后,任何相同组分的分数(体积分数、物质的量分数、质量分数等)均相同,这样的化学平衡互称为等效平衡。
1、等效平衡的含义:
反应混合物中各组分的质量分数、体积分数、物质的量分数均相同
2、等效平衡的标志:
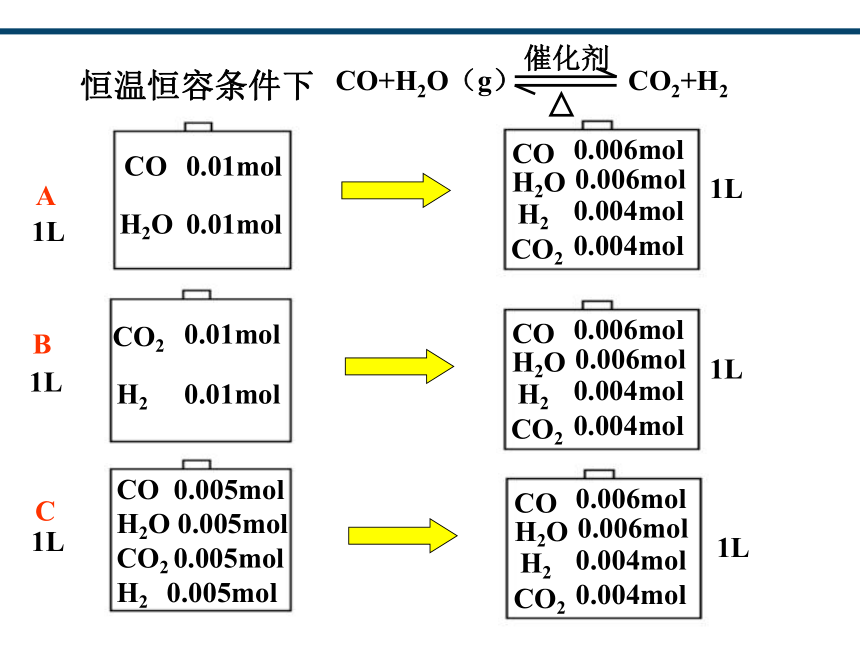
CO2
CO
0.006mol
H2O
0.006mol
0.004mol
0.004mol
H2
1L
1L
CO
0.01mol
H2O
0.01mol
A
1L
CO2
0.01mol
H2
0.01mol
B
1L
C
CO 0.005mol
H2O 0.005mol
CO2 0.005mol
H2 0.005mol
CO+H2O(g) CO2+H2
催化剂
恒温恒容条件下
CO2
CO
0.006mol
H2O
0.006mol
0.004mol
0.004mol
H2
1L
CO2
CO
0.006mol
H2O
0.006mol
0.004mol
0.004mol
H2
1L
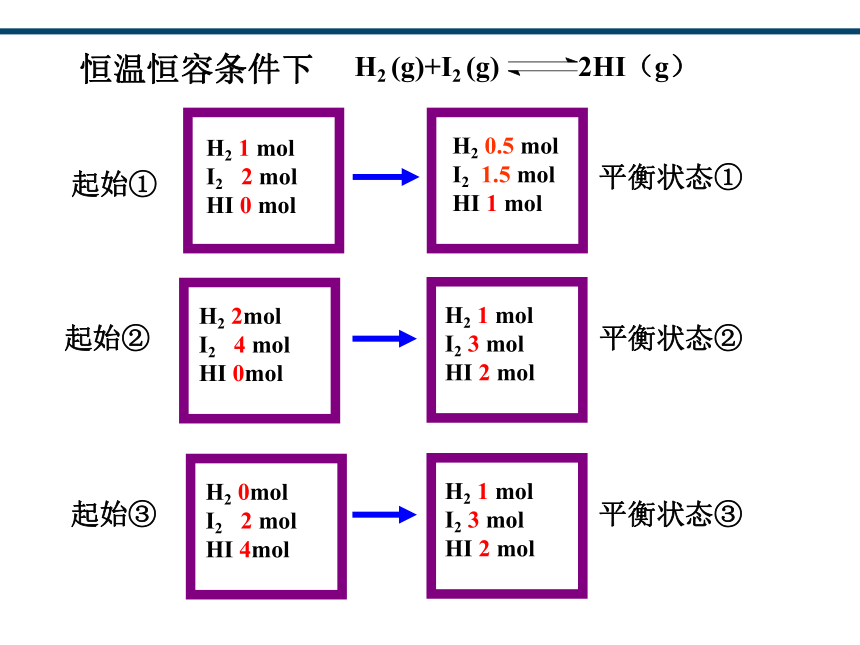
H2 (g)+I2 (g) 2HI(g)
起始①
H2 1 mol
I2 2 mol
HI 0 mol
H2 0.5 mol
I2 1.5 mol
HI 1 mol
平衡状态①
起始②
H2 2mol
I2 4 mol
HI 0mol
恒温恒容条件下
H2 1 mol
I2 3 mol
HI 2 mol
平衡状态②
起始③
H2 0mol
I2 2 mol
HI 4mol
H2 1 mol
I2 3 mol
HI 2 mol
平衡状态③
等效平衡
任何状态的体系,都用“极端状态”来比较,通过可逆反应的化学计量数换算成同一边物质
3、等效平衡的判断方法:
(1)定温(T)、定容(V)
(2)定温(T)、定压(p)
4、等效平衡的分类:
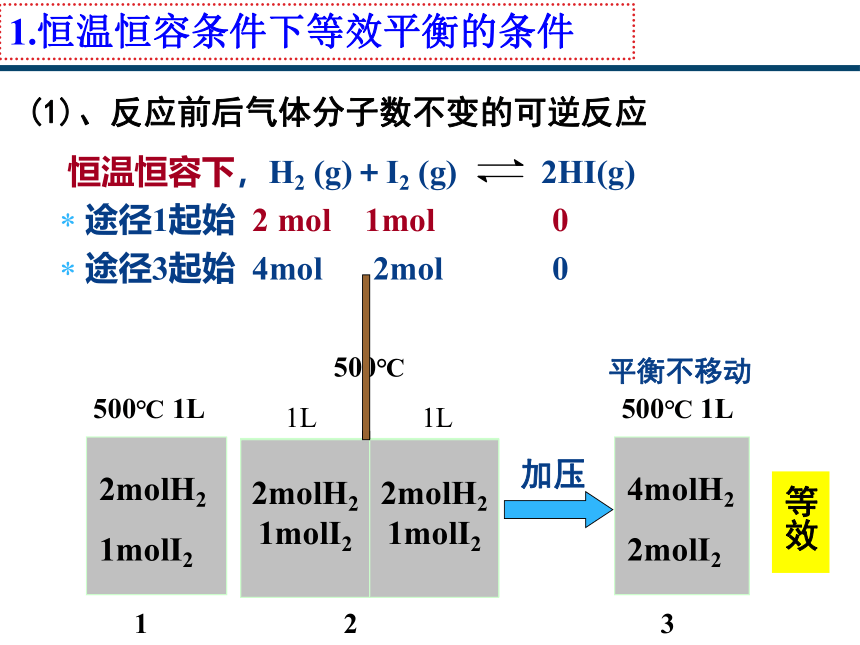
1.恒温恒容条件下等效平衡的条件
(1)、反应前后气体分子数不变的可逆反应
恒温恒容下,H2 (g)+I2 (g) 2HI(g)
途径1起始 2 mol 1mol 0
途径2起始 1mol 0 1mol
途径3起始 4mol 2mol 0
途径4起始 3mol 1mol 2mol
途径2、3、4与途径1等效吗?
3、4与1等效
1.恒温恒容条件下等效平衡的条件
(1)、反应前后气体分子数不变的可逆反应
2molH2 1molI2
500℃
2molH2 1molI2
1L
1L
恒温恒容下,H2 (g)+I2 (g) 2HI(g)
途径1起始 2 mol 1mol 0
途径3起始 4mol 2mol 0
2molH2
1molI2
1
500℃ 1L
2molH2 1molI2
2molH2 1molI2
4molH2
2molI2
3
500℃ 1L
2
平衡不移动
加压
等效
1.恒温恒容条件下等效平衡的条件
(1)、反应前后气体分子数不变的可逆反应
只要通过可逆反应的化学计量数换算成同一边物质的物质的量之比与原平衡起始加入量相同,则二平衡等效。
一边倒后比相同则等效
在固定体积的密闭容器内,加入2mol A、1mol B,发生反应:A(气)+B(气) 2C(气)达到平衡时,C的质量分数为W。在相同(T、V)条件下,按下列情况充入物质达到平衡时C的质量分数仍为W的是
A. 2mol C
B. 3mol C
C. 4mol A、2mol B
D. 1mol A、2mol C
CD
练习1
1.恒温恒容条件下等效平衡的条件
(2)、反应前后气体分子数发生变化的可逆反应
起始C(mol/L) 2 1 0
0 0 2
1 0.5 1
4 2 0
2SO2+ O2 2SO3
这四种情况下的平衡是等效的吗?
1.恒温恒容条件下等效平衡的条件
(2)、反应前后气体分子数发生变化的可逆反应
2SO2 + O2
2SO3
2mol SO2 1mol O2
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
SO2 a%
O2 b%
SO3 c%
平衡状态
2mol SO3
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
相当于开始加入1molSO2、0.5molO2和1molSO3
1.恒温恒容条件下等效平衡的条件
(2)、反应前后气体分子数发生变化的可逆反应
起始(mol): 2 1 0
平衡时(mol): x y z
平衡时体积分数: a% b% c%
2SO2 + O2
2SO3
2mol SO2
1mol O2
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
若起始(mol) :4 2 0
2mol SO2
1mol O2
2mol SO2
1mol O2
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
加压
(此为放缩法)
4mol SO2
2mol O2
开始
SO2
平衡状态
1.恒温恒容条件下等效平衡的条件
(2)、反应前后气体分子数发生变化的可逆反应
相同物质的起始物质的量相等
把不同的起始状态,通过化学方程式中的计量数,换算成同一边物质(反应物一边或生成物一边),如果各反应物或生成物的_______________相等,则是等效平衡。
处理方法
物质的量
一边倒后,量相同才等效
有一个固定体积的密闭容器中,加入2molA和1molB发生反应,2A(g) + B(g) 3C(g) + D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是( )
A.4mol A + 2mol B
B.2mol A + 1mol B + 3mol C + 1mol D
C.3mol C + 1mol D +1mol B
D.3mol C + 1mol D
E、1molA+0.5molB+1.5molC+0.5molD
DE
练习2
恒温恒容
2.恒温恒压条件下等效平衡的条件
恒温恒容 2SO2(g)+O2(g) 2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 4 mol 2 mol 0
压
途径1和2是否为等效平衡?
恒温恒容下 不等效
恒温恒压下 等效
2.恒温恒压条件下等效平衡的条件
2SO2 + O2
2SO3
起始(mol) : 2 1 0
平衡(mol) : x y z
平衡时体积分数: a% b% c%
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
2mol SO2
1mol O2
若起始(mol): 4 2 0
2mol SO2
1mol O2
2mol SO2
1mol O2
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
4mol SO2
2mol O2
SO2 a%
O2 b%
SO3 c%
2.恒温恒压条件下等效平衡的条件
换算成平衡式同一边物质的物质的量与原平衡比例相同,则达平衡后与原平衡等效。
恒温恒压 :H2(g)+ I2(g) 2HI(g)
途径1起始 2 mol 1mol 0
途径2起始 4mol 2mol 0
途径1和2为等效平衡
在一定温度下保持压强相等的密闭容器中,充入1molA、2molB发生A+B 2C+D,达到平衡时A的含量为w,下列物质组合充入该容器中,A的含量仍为w的是( )
BD
练习3
A. 2mol C+1mol D
B. 1mol B+2mol C+1mol D
C. 1mol A+1mol B
D. 1mol A+4mol B+4mol C+2mol D
恒温恒压
随堂检测
1.在一恒容的容器中充入2 mol A和1 mol B,发生反应2 A(g) + B(g) x C(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6 mol,B为0.3 mol,C为1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为 ( )
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
C
2、将amolPCl5充入一个容积恒为VL的密闭容器中,发生如下反应:PCl5(g) PCl3(g) + Cl2(g) ,在t℃的温度下反应达到化学平衡,此时容器内气体压强为P1,保持温度不变,再向该容器中充入amolPCl5再达到化学平衡时,容器内气体压强为P2,则P1和P2的大小关系是 ( )
A、2P1﹥P2 B、2P1=P2
C、2P1﹤P2 D、P1=P2
随堂检测
A
小结
I类:对于一般的可逆反应,通过化学计量数比换算成同一边物质的物质的量与原平衡相同,则两平衡等效(等同)。
等效平衡的分类
Ⅱ类:m+n=p+q,通过化学计量数比换算成同一边物质的物质的量的比例与原平衡相同,则两平衡等效。
(2)定T、定p下
(1)定温(T)、定容(V)
mA(气)+nB(气) pC(气)+qD(气)
Ⅲ类:换算成平衡式同一边物质的物质的量与原平衡比例相同,则达平衡后与原平衡等效。
小结
等效平衡的分类
mA(气)+nB(气) pC(气)+qD(气)
条件 等效条件 结果
恒温恒容 (△n(g)≠0)
恒温恒容 (△n(g)=0)
恒温恒压
全等平衡
相似平衡
相似平衡
两次平衡时各组分百分量、n、c均相同
两次平衡时各组分百分量
相同,n、c同比例变化
两次平衡时各组分百分量、c相同,n同比例变化
投料换算成相同物质表示时量相同
投料换算成相
同物质表示时
等比例
投料换算成相
同物质表示时
等比例
补充
【例1】恒温恒容容器中建立如下平衡2NO2 N2O4,
达到平衡后,若再向容器中充入2 mol NO2,
平衡移动方向?重新达到平衡后NO2的转化率?
变式: 恒温恒容容器中建立如下平衡:
2SO3 2SO2 +O2 ,达到平衡后,若再向
容器中充入一定量SO3,平衡移动方向?
重新达到平衡后,SO3的转化率?
向右(正向)
增大
减小
(正向)
补充
变式: 恒温恒容容器中建立如下平衡:
2SO2 +O2 2 SO3, 达到平衡后,若再向
容器中充入一定量SO3,平衡移动方向?
重新达到平衡后,SO3的质量分数?
增大
(逆向)
补充
【例2】恒温恒容时1molN2、3molH2在密闭容
器中反应达到平衡状态,此时压强为P1;
若再充入2mol NH3 。
a、平衡如何移动?
b、重新平衡后总压强为P2, 则P1 和P2的关系?
逆向
P1< P2 < 2P1
典型例题
例1、t0C在VL密闭容器中加入vmolN2和3vmol H2,当反应N2+3H2 2NH3达平衡时,混合气体中N2、H2、NH3分别为A、B、Cmol,仍在t0C,若只改变起始物的加入量,但要维持A、B、C值不变,则在N2、H2、NH3的加入量用X、Y、Z表示,应满足的条件是
若X=0,Y=0,则Z=_______
若X=0.75vmol,则Y= Z=________
X、Y、Z应满足的一般条件,用X、Y、Z的方程式表示式是
______________________、________________。
2vmol
2.25vmol
0.5vmol
2x+z=2v
Y+ Z=3V
典型例题
例2、在一个盛有催化剂的体积可变的密闭容器内,保持一定的温度和压强不变,发生以下反应:N2 + 3H2 2NH3 。已知加入1mol N2 和4mol H2 时,达到平衡状态生成amol NH3 。在相同温度和压强下,且保持平衡时的各物质的百分含量相同,则填写下列空白:
编号 起始状态(mol) 平衡时NH3物质的量(mol)
N2 H2 NH3 已知 1 4 0 a
① 1.5 6 0
② 1 0.5a
③ m n(n≥4m)
1.5a
0
0.5
2(n-4m)
(n-3m)a
典型例题
例3、在温度和容积相同的三个密闭容器中,发生反应
2 SO2(g)+O2(g) 2 SO3(g) △H=-196 kJ/mol。起始投入反应物和平衡时测得的有关数据如下表:
容器 投料量 转化率 c(SO3) 能量变化 O2体积分数
甲 2 mol SO2和1 mol O2 α1 c1 放出Q1kJ热量 V1%
乙 2mol SO3 α2 c2 吸收Q2kJ热量 V2%
丙 4 mol SO2和2 mol O2 α3 c3 放出Q3kJ热量 V3%
请判断(用“>”、“<”或“=”填空)
(1)Q1+Q2 196 (2) 2Q1 Q3 (3) c1 c2 (4) 2c1 c3 (5) α1 α3 (6)α1+α2 1 (7) α2 +α3 1 (8) V1% V2% (9) V1% V3%
(10)达到平衡的时间:t甲 t丙。
(11)甲、乙、丙三个容器中,平衡常数的关系为 。
