人教版选择性必修一2.2 化学平衡的移动 课件
文档属性
| 名称 | 人教版选择性必修一2.2 化学平衡的移动 课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-27 15:10:14 | ||
图片预览





文档简介
(共24张PPT)
第二章 化学反应速率和化学平衡
第二节 化学平衡
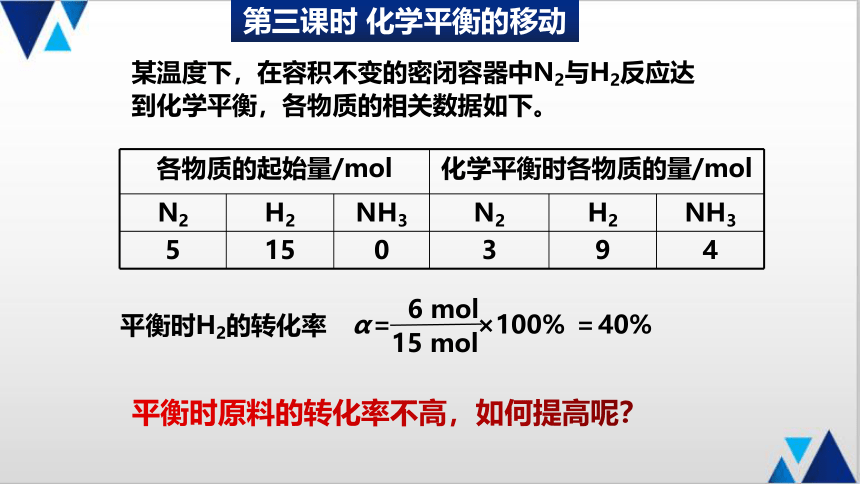
某温度下,在容积不变的密闭容器中N2与H2反应达到化学平衡,各物质的相关数据如下。
各物质的起始量/mol 化学平衡时各物质的量/mol N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
α= ×100% =40%
6 mol
15 mol
平衡时H2的转化率
平衡时原料的转化率不高,如何提高呢?
第三课时 化学平衡的移动
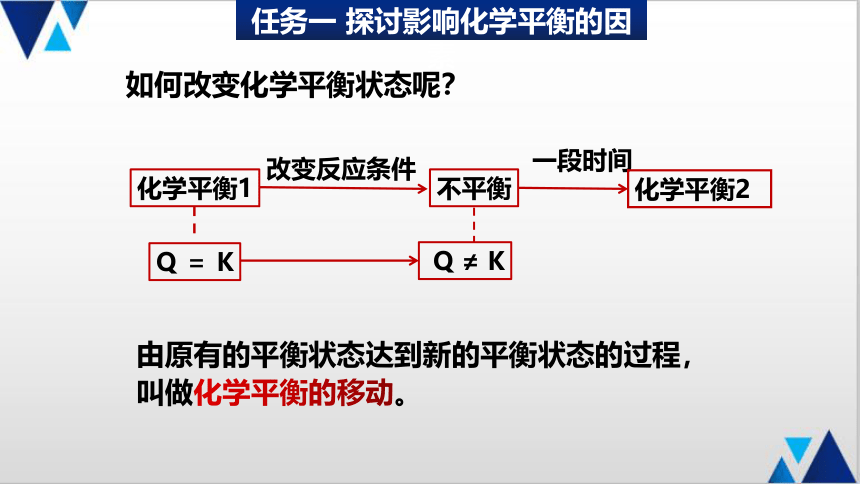
任务一 探讨影响化学平衡的因素
化学平衡1
Q = K
不平衡
Q ≠ K
一段时间
化学平衡2
如何改变化学平衡状态呢?
由原有的平衡状态达到新的平衡状态的过程,叫做化学平衡的移动。
改变反应条件
改变哪些反应条件可使Q ≠ K,从而改变化学平衡状态?
改变浓度,使Q 发生改变
改变温度,使K 发生改变
浓度商只与浓度有关,平衡常数只与温度有关。
任务一 探讨影响化学平衡的因素
利用浓度商与平衡常数比较判断化学平衡移动的方向
Q = K
任意时刻的浓度商
Q =
cp(C) cq(D)
cm(A) cn(B)
平衡状态
Q < K
向正反应方向移动
向逆反应方向移动
Q > K
反应物浓度增大,Q 减小,使得Q < K,反应不再平衡,向正反应方向移动。
若其他条件不变,仅增加反应物的浓度,化学平衡如何移动?
任意时刻的浓度商
Q =
cp(C) cq(D)
cm(A) cn(B)
任务二 研究浓度对化学平衡的影响
m A(g) + n B(g) p C(g) + q D(g)
若其他条件不变,仅减小反应物的浓度,化学平衡如何移动?
反应物浓度减小,Q 变大,使得Q > K,反应不再平衡,向逆反应方向移动。
如何增加反应物的浓度?
如何减小反应物的浓度?
滴加饱和FeCl3溶液或
高浓度的KSCN溶液
加入NaOH降低Fe3+浓度
验证浓度对化学平衡的影响
研究体系:
红色
Fe3+ + 3SCN- Fe(SCN)3
无色
黄色
变量控制:温度等其他因素不变,只改变一种物质的浓度。
任务二 研究浓度对化学平衡的影响
注意:保持溶液总体积(基本)不变,使其他粒子浓度不变
加入4滴饱和FeCl3溶液
滴入4滴 1 mol·L-1 KSCN 溶液
实验操作
将 5 mL 0.01 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
平衡后均分在a、b两支试管中
a
b
加入5滴2mol/LNaOH溶液
加入1滴2mol/LNaOH溶液
任务二 研究浓度对化学平衡的影响
实验现象
将 5 mL 0.01 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
平衡后均分在a、b两支试管中
a
加入4滴饱和FeCl3溶液
滴入4滴 1 mol·L-1 KSCN 溶液
b
加入1滴2mol/LNaOH溶液
加入5滴2mol/LNaOH溶液
任务二 研究浓度对化学平衡的影响
其他条件不变时:
减小生成物的浓度,平衡向正反应方向移动;
增大生成物的浓度,平衡向逆反应方向移动。
大量实验也可以证明:
任务二 研究浓度对化学平衡的影响
其他条件不变时:
增大反应物的浓度,平衡向正反应方向移动;
减小反应物的浓度,平衡向逆反应方向移动。
压强的改变,可能影响反应体系中多种物质的浓度。如果增大压强(缩小容积)以下反应各物质的浓度会如何变化?浓度商会如何变化?
2NO2(g) N2O4(g)
红棕色
无色
任务三 研究压强对化学平衡的影响
理论分析
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
扩大容积至 V /2时
通过计算Q2 =K/2 , 即Q2 < K ,向正反应方移动
2P1
b
a2
= K
Q1=
2NO2(g) N2O4(g)
同温度:
任务三 研究压强对化学平衡的影响
2a
2b
2b
(2a)2
b
2a2
Q2=
=
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
扩大容积至2V 时
通过计算Q2 =2 K , 即Q2 > K 向逆反应方移动
P1
1
2
a
1
2
b
1
2
b
( a)2
=
2b
a2
Q2=
1
2
1
2
b
a2
= K
Q1=
2NO2(g) N2O4(g)
同温度:
任务三 研究压强对化学平衡的影响
容积减小
颜色变深②
颜色又变浅③
原平衡气①
向正反应方向移动
物质浓度瞬间增大
加压前
实验现象与分析
2NO2(g) N2O4(g)
红棕色
无色
加压
NO2浓度比②中的减小,但比①中的增大
任务三 研究压强对化学平衡的影响
容积增大
颜色变浅②
颜色又变深③
原平衡气①
向逆反应方向移动
物质浓度瞬间减小
减压前
实验现象与分析
2NO2(g) N2O4(g)
红棕色
无色
减压
NO2浓度比②中的增大,但比①中的减小
任务三 研究压强对化学平衡的影响
其他条件不变时,增大压强(减小容器的容积)会使化学平衡向气体体积缩小的方向移动;
减小压强(增大容器的容积),会使平衡向气体体积增大的方向移动。
实验结论:
任务三 研究压强对化学平衡的影响
对于H2(g)+ I2(g) 2HI(g) 当其他条件不变,减小或增大容器容积来改变压强时,化学平衡如何变化呢?
对于反应前后气体物质的总体积没有变化的可逆反应,压强改变不能使化学平衡发生移动。
任务三 研究压强对化学平衡的影响
对于只有固体或液体参加的反应,体系压强的改变会使化学平衡移动吗?
固态或液态物质的体积受压强影响很小,可以忽略不计。当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
实验 浸泡在热水中 浸泡在冰水中
现象 颜色加深 颜色变浅
移动方向
结论 红棕色
无色
向逆反应方向移动
向正反应方向移动
实验现象和结论
任务四 探究温度对化学平衡的影响
2NO2(g) N2O4(g) △H=-56.9KJ/mol
其他条件不变时,
升高温度,化学平衡向吸热反应方向移动;
降低温度,化学平衡向放热反应方向移动。
加入催化剂会使化学平衡发生移动吗?
催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间。
改变反应条件 化学平衡移动方向 移动规律
增大反应物浓度 向正反应方向
减小反应物浓度 向逆反应方向
增大压强 向气体体积缩小方向
减小压强 向气体体积增大方向
升高温度
降低温度
整理与归纳
向降低温度的方向
向升高温度的方向
向吸热反应方向
向放热反应方向
向减少反应物浓度的方向
向增大反应物浓度的方向
向减小压强的方向
向增大压强的方向
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方向移动。这就是勒夏特列原理,也称化学平衡移动原理。
勒夏特列原理
怎样理解勒夏特列原理中的“减弱这种改变”?
反应的移动方向总是想对抗外界条件的改变
减弱
减弱不是消除
这种改变:外界条件的改变
增加某物质浓度,升温,加压
减小某物质浓度,降温,减压
老子:天之道,损有余而补不足
这种改变
新平衡
c
.
b
.
旧平衡
a
.
这种改变
新平衡
c
.
b
.
旧平衡
a
.
化学平衡状态
化学平衡移动
勒夏特列原理
温度
压强
Q 与K比较
(定量分析)
(定性分析)
化学平衡的建立
定量研究:
化学平衡常数
浓度
改变
小结
利用化学平衡移动原理,可以更加科学、有效地调控和利用化学反应,尽可能地让化学反应按照人们的需要进行。
达标检测
1.下列实验事实可以用平衡移动原理解释的是( )
A.“NO2”球浸泡在热水中,颜色变深
B.H2(g)+ I2 (g) 2HI(g),加压后颜色变深
C.过量铁和稀硝酸反应,溶液变成浅绿色
D.合成氨工业中使用铁触媒作催化剂
A
达标检测
2.某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如表所示。
下列说法正确的是( )
A.升高温度,若W的体积分数减小,则此反应 H>0
B.该温度下,此反应的平衡常数K=6.75
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,加入催化剂既能加快反应速率又能使平衡正向移动
B
3.分析合成氨工艺条件的选择符合勒夏特列原理的是哪些?
N2 + 3H2 2NH3 △H<0
达标检测
第二章 化学反应速率和化学平衡
第二节 化学平衡
某温度下,在容积不变的密闭容器中N2与H2反应达到化学平衡,各物质的相关数据如下。
各物质的起始量/mol 化学平衡时各物质的量/mol N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
α= ×100% =40%
6 mol
15 mol
平衡时H2的转化率
平衡时原料的转化率不高,如何提高呢?
第三课时 化学平衡的移动
任务一 探讨影响化学平衡的因素
化学平衡1
Q = K
不平衡
Q ≠ K
一段时间
化学平衡2
如何改变化学平衡状态呢?
由原有的平衡状态达到新的平衡状态的过程,叫做化学平衡的移动。
改变反应条件
改变哪些反应条件可使Q ≠ K,从而改变化学平衡状态?
改变浓度,使Q 发生改变
改变温度,使K 发生改变
浓度商只与浓度有关,平衡常数只与温度有关。
任务一 探讨影响化学平衡的因素
利用浓度商与平衡常数比较判断化学平衡移动的方向
Q = K
任意时刻的浓度商
Q =
cp(C) cq(D)
cm(A) cn(B)
平衡状态
Q < K
向正反应方向移动
向逆反应方向移动
Q > K
反应物浓度增大,Q 减小,使得Q < K,反应不再平衡,向正反应方向移动。
若其他条件不变,仅增加反应物的浓度,化学平衡如何移动?
任意时刻的浓度商
Q =
cp(C) cq(D)
cm(A) cn(B)
任务二 研究浓度对化学平衡的影响
m A(g) + n B(g) p C(g) + q D(g)
若其他条件不变,仅减小反应物的浓度,化学平衡如何移动?
反应物浓度减小,Q 变大,使得Q > K,反应不再平衡,向逆反应方向移动。
如何增加反应物的浓度?
如何减小反应物的浓度?
滴加饱和FeCl3溶液或
高浓度的KSCN溶液
加入NaOH降低Fe3+浓度
验证浓度对化学平衡的影响
研究体系:
红色
Fe3+ + 3SCN- Fe(SCN)3
无色
黄色
变量控制:温度等其他因素不变,只改变一种物质的浓度。
任务二 研究浓度对化学平衡的影响
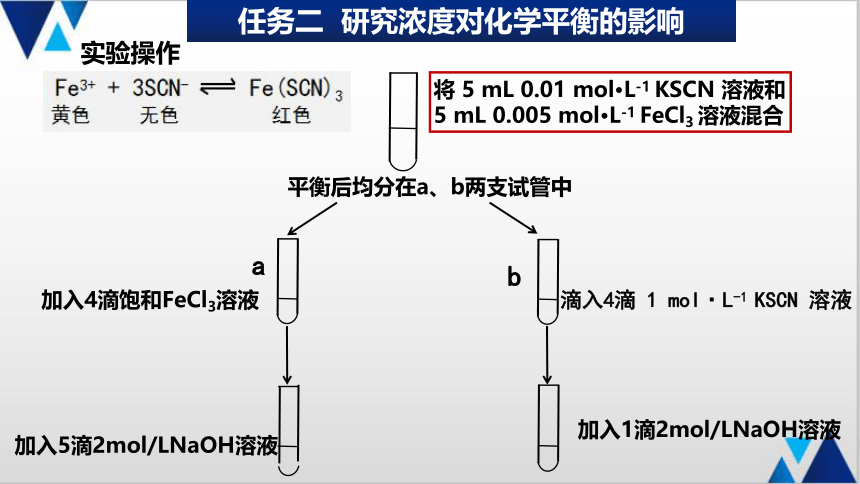
注意:保持溶液总体积(基本)不变,使其他粒子浓度不变
加入4滴饱和FeCl3溶液
滴入4滴 1 mol·L-1 KSCN 溶液
实验操作
将 5 mL 0.01 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
平衡后均分在a、b两支试管中
a
b
加入5滴2mol/LNaOH溶液
加入1滴2mol/LNaOH溶液
任务二 研究浓度对化学平衡的影响
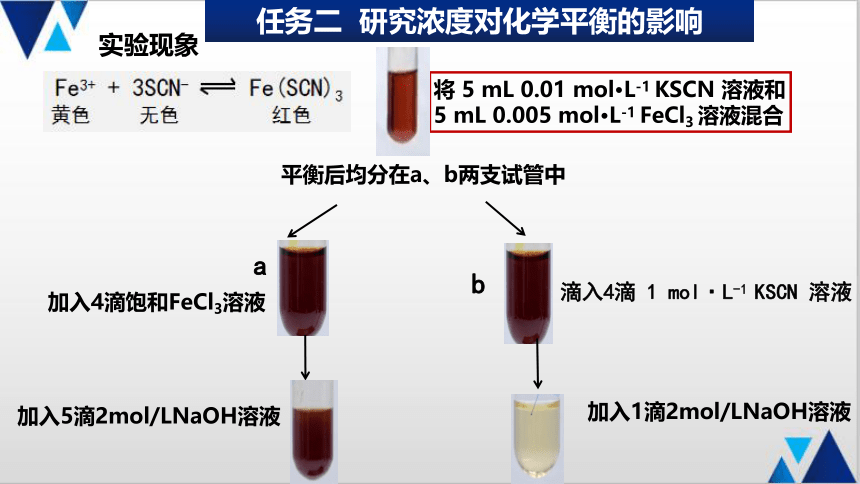
实验现象
将 5 mL 0.01 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
平衡后均分在a、b两支试管中
a
加入4滴饱和FeCl3溶液
滴入4滴 1 mol·L-1 KSCN 溶液
b
加入1滴2mol/LNaOH溶液
加入5滴2mol/LNaOH溶液
任务二 研究浓度对化学平衡的影响
其他条件不变时:
减小生成物的浓度,平衡向正反应方向移动;
增大生成物的浓度,平衡向逆反应方向移动。
大量实验也可以证明:
任务二 研究浓度对化学平衡的影响
其他条件不变时:
增大反应物的浓度,平衡向正反应方向移动;
减小反应物的浓度,平衡向逆反应方向移动。
压强的改变,可能影响反应体系中多种物质的浓度。如果增大压强(缩小容积)以下反应各物质的浓度会如何变化?浓度商会如何变化?
2NO2(g) N2O4(g)
红棕色
无色
任务三 研究压强对化学平衡的影响
理论分析
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
扩大容积至 V /2时
通过计算Q2 =K/2 , 即Q2 < K ,向正反应方移动
2P1
b
a2
= K
Q1=
2NO2(g) N2O4(g)
同温度:
任务三 研究压强对化学平衡的影响
2a
2b
2b
(2a)2
b
2a2
Q2=
=
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
扩大容积至2V 时
通过计算Q2 =2 K , 即Q2 > K 向逆反应方移动
P1
1
2
a
1
2
b
1
2
b
( a)2
=
2b
a2
Q2=
1
2
1
2
b
a2
= K
Q1=
2NO2(g) N2O4(g)
同温度:
任务三 研究压强对化学平衡的影响
容积减小
颜色变深②
颜色又变浅③
原平衡气①
向正反应方向移动
物质浓度瞬间增大
加压前
实验现象与分析
2NO2(g) N2O4(g)
红棕色
无色
加压
NO2浓度比②中的减小,但比①中的增大
任务三 研究压强对化学平衡的影响
容积增大
颜色变浅②
颜色又变深③
原平衡气①
向逆反应方向移动
物质浓度瞬间减小
减压前
实验现象与分析
2NO2(g) N2O4(g)
红棕色
无色
减压
NO2浓度比②中的增大,但比①中的减小
任务三 研究压强对化学平衡的影响
其他条件不变时,增大压强(减小容器的容积)会使化学平衡向气体体积缩小的方向移动;
减小压强(增大容器的容积),会使平衡向气体体积增大的方向移动。
实验结论:
任务三 研究压强对化学平衡的影响
对于H2(g)+ I2(g) 2HI(g) 当其他条件不变,减小或增大容器容积来改变压强时,化学平衡如何变化呢?
对于反应前后气体物质的总体积没有变化的可逆反应,压强改变不能使化学平衡发生移动。
任务三 研究压强对化学平衡的影响
对于只有固体或液体参加的反应,体系压强的改变会使化学平衡移动吗?
固态或液态物质的体积受压强影响很小,可以忽略不计。当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
实验 浸泡在热水中 浸泡在冰水中
现象 颜色加深 颜色变浅
移动方向
结论 红棕色
无色
向逆反应方向移动
向正反应方向移动
实验现象和结论
任务四 探究温度对化学平衡的影响
2NO2(g) N2O4(g) △H=-56.9KJ/mol
其他条件不变时,
升高温度,化学平衡向吸热反应方向移动;
降低温度,化学平衡向放热反应方向移动。
加入催化剂会使化学平衡发生移动吗?
催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间。
改变反应条件 化学平衡移动方向 移动规律
增大反应物浓度 向正反应方向
减小反应物浓度 向逆反应方向
增大压强 向气体体积缩小方向
减小压强 向气体体积增大方向
升高温度
降低温度
整理与归纳
向降低温度的方向
向升高温度的方向
向吸热反应方向
向放热反应方向
向减少反应物浓度的方向
向增大反应物浓度的方向
向减小压强的方向
向增大压强的方向
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方向移动。这就是勒夏特列原理,也称化学平衡移动原理。
勒夏特列原理
怎样理解勒夏特列原理中的“减弱这种改变”?
反应的移动方向总是想对抗外界条件的改变
减弱
减弱不是消除
这种改变:外界条件的改变
增加某物质浓度,升温,加压
减小某物质浓度,降温,减压
老子:天之道,损有余而补不足
这种改变
新平衡
c
.
b
.
旧平衡
a
.
这种改变
新平衡
c
.
b
.
旧平衡
a
.
化学平衡状态
化学平衡移动
勒夏特列原理
温度
压强
Q 与K比较
(定量分析)
(定性分析)
化学平衡的建立
定量研究:
化学平衡常数
浓度
改变
小结
利用化学平衡移动原理,可以更加科学、有效地调控和利用化学反应,尽可能地让化学反应按照人们的需要进行。
达标检测
1.下列实验事实可以用平衡移动原理解释的是( )
A.“NO2”球浸泡在热水中,颜色变深
B.H2(g)+ I2 (g) 2HI(g),加压后颜色变深
C.过量铁和稀硝酸反应,溶液变成浅绿色
D.合成氨工业中使用铁触媒作催化剂
A
达标检测
2.某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如表所示。
下列说法正确的是( )
A.升高温度,若W的体积分数减小,则此反应 H>0
B.该温度下,此反应的平衡常数K=6.75
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,加入催化剂既能加快反应速率又能使平衡正向移动
B
3.分析合成氨工艺条件的选择符合勒夏特列原理的是哪些?
N2 + 3H2 2NH3 △H<0
达标检测
